香叶木素保护对乙酰氨基酚诱发的急性肝损伤
2018-11-06刘星李晓娜刘翠玲黄金龙黄卫锋
刘星,李晓娜,刘翠玲,黄金龙,黄卫锋
(三峡大学医学院感染与损伤研究所,湖北宜昌 443002)
对乙酰氨基酚(acetaminophen,APAP)是临床常用的解热镇痛类非处方药,在正常剂量使用APAP时具有很好的治疗效果,然而长期或过剂量服用APAP则会导致严重的肝损伤[1]。在西方国家,APAP过量已成为引发急性肝功能衰竭最主要的原因[2],在美国每年因APA过量引起的死亡人数就多达500人[3]。我国目前也有过量服用APAP致死的病例报道,APAP诱导的急性肝损伤已经成为严重的公共卫生问题。然而引起肝损伤的发病机制尚未阐明,有研究报道氧化应激在参与其中,核因子E2相关因子2(nuclear factor erythroid 2-related factor,Nrf2)作为一种重要的转录,其与抗氧化应答元件(antioxidant response element,ARE)相互作用可调控下游抗氧化酶和Ⅱ相代谢酶的表达,促使细胞增强清除活性氧自由基的能力,从而降低细胞、组织、器官等因氧化应激带来的损伤[4]。因此,抑制氧化应激可改善APAP引起的肝损伤。香叶木素(Diosmetin,Dios)是一种黄酮类化合物的主要活性成分,在各种食物来源中均有应用,包括牛至,柑橘类水果,也可以从某些药草中提取,如玫瑰花科,菊花菊科和石竹花[5],黄酮类化合物被认为与多种有益的作用相关,包括抗氧化活性[6],它能保护组织免受氧化应激和相关病理炎症[7],具有抗氧化、抗菌、抗炎症、抗过敏、抗肿瘤以及植物雌激素作用等多种药理活性。前期我们的研究表明香叶木素通过激活 Nrf2信号通路预防肾缺血再灌注引起肾脏的氧化应激[8]。但香叶木素能否通过抗氧化应激对APAP引起的肝损伤起保护作用,目前尚无相关研究。故本研究旨在探讨香叶木素对预防APAP引起肝损伤的保护性作用,并探讨这一保护性作用是否与Nrf2/ARE信号通路有关,为进一步研究治疗APAP诱发急性肝损伤的新型药物提供理论思路和实验依据。
1 材料与方法
1.1 实验细胞与动物
人非肿瘤肝细胞LO2由中国上海中科院提供。雄性C57BL/6J小鼠,6~8周龄,体质量18~22 g,由三峡大学实验动物中心提供,实验动物护理和使用经中国三峡大学实验动物管理委员会批准(许可证编号:2017090D),动物分笼饲养于温度:20 ℃~22 ℃,相对湿度:40%~50%,12 h昼夜交替的三峡大学实验动物中心的SPF级动物房中,自由饮水和进食,适应性饲养1周后随机分为4组进行实验。
1.2 药物与试剂
香叶木素(纯度>98%)、对乙酰氨基酚(化学纯,含量≥98%)、MTT均购自美国Sigma-AIdrich公司;苏木精-苏红染液(HE)由上海碧云天生物技术有限公司提供;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、丙二醛(MDA)及谷胱甘肽(GSH)试剂盒,购自中国南京建成生物工程有限公司;多克隆兔抗Nrf2 抗体(1:1500)、兔抗 β-actin 抗体(1:8000)购自Santa Cruz公司;HRP标记的二抗(1:5000)、BCA蛋白质测定试剂盒、超敏型化学发光底物试剂盒均购自美国Pierce公司;医用X射线胶片由锐珂(厦门)医疗器材有限公司提供;Trizol试剂购自Invitrogen公司;RNA逆转录酶购自中国Toyobo公司;引物序列由生工生物科技公司设计合成;其他试剂为分析纯。
1.3 仪器
电子分析天平,北京赛多斯仪器系统有限公司;高速冷冻离心机,Sigma公司;SZ-93A自动双重纯水蒸馏器,上海亚荣生化仪器厂;CO2培养箱,SHELLAB公司;超净工作台,苏州苏云净化设备有限公司;水平摇床和DYY-6C型电泳仪,北京市六一仪器厂;全波长酶标仪,Thermo Electron公司;核酸检测仪,Thermo SCIENTFIC公司;PCR扩增仪,ABI公司;Real Time PCR仪,Whatman Biometra公司;TP 1020型脱水机、ULTRACUTR型超薄切片机、石蜡包埋机、图像分析仪,Leica公司;CS-V1型摊片烤片机,孝感市宏业医用仪器有限公司;光学显微镜,Olympus公司。
1.4 方法
1.4.1 药物配制
称取Dios,溶解于含有浓度为2%二甲基亚砜的0.9%氯化钠溶液配制成 1 mg/mL浓度的药物;称取APAP溶于0.9%氯化钠溶液配制成300 mg/kg浓度药物。
1.4.2 细胞分组及处理
人非肿瘤肝细胞 LO2由中国上海中科院提供,LO2细胞用含有10% FBS的DMEM培养基培养,培养箱环境为温度为5% CO2、37 ℃的恒温进行培养。开始细胞培养的处理分为空白对照组,不同浓度的Dios无血清培养基代替旧培养基(15,30 μM)6 h。然后,将细胞进一步加入APAP 10 mM再温育24 h。收集的细胞用PBS洗涤两次,用于细胞活力和GSH分析。
1.4.3 动物分组及处理
购买雄性SPF级C57BL/6J小鼠40只,适应性饲养1周后随机分成4组,即对照组、APAP组、Dios 30 mg/kg和Dios 60 mg/kg给药组,每组10只,各组灌胃给药,对照组和模型组灌胃给予等量生理盐水,Dios组每日分别给药1次,连续给药7 d。给药第6 d,模型组与Dios组小鼠腹腔注射给予溶解在0.9%氯化钠中的APAP 300 mg/kg,对照组腹腔注射给予等量0.9%氯化钠,24 h后小鼠眼球取血,血液室温凝结1 h后4 ℃离心(4000 r/min,15 min),留取上清供血清指标ALT和AST检测。切取一部分肝脏组织溶于0.9%氯化钠中制成肝匀浆用于检测GSH和MDA水平,取相同部位的肝组织固定在 4%多聚甲醛中,用于肝组织切片观察病理变化,其余部分立即冻存在-80 ℃冰箱。
1.4.4 MTT测定法测定细胞活力
每孔加入20 μL的MTT溶液,继续培养4 h后,终止培养,小心吸去孔内培养液,每孔加入150 μL二甲基亚砜,置摇床低速振荡10 min,使结晶物充分溶解,用酶标仪OD490nm处测量各孔的吸光(A),重复3次。细胞存活率(%)=(Dios组 A490nm-空白对照组A490nm)/(细胞对照组 A490nm-空白对照组A490nm)×100%。用 GraphPad Prism5软件进行分析处理,吸光强度反映细胞生长状况。
1.4.5 LO2细胞GSH含量检测
将LO2细胞在1 mL PBS含有1 mM EDTA(pH 7.5)匀浆,取上清液(4 ℃,10000 r/min,10 min)。采用南京建成生物有限公司提供的 GSH定量试剂盒按照说明书测量GSH含量。
1.4.6 氧化应激指标检测
取冻存的肝脏组织,制备组织匀浆,取上清液,采用二硫代硝基苯法和硫代巴比妥法试剂盒测定GSH和MDA含量,按照试剂盒说明书进行操作。
1.4.7 血清生化指标检测
将从小鼠获得的血液置于室温下1 h凝固,4 ℃离心(4000 r/min,15 min)收集血清。采用南京建成生物有限公司提供的试剂盒说明书,采用微板法检测血清中ALT和AST肝功能活性水平。
1.4.8 HE染色检测肝组织病变
将肝脏组织用 4%多聚甲醛液浸泡固定过夜,常规脱水、包埋、切片,按HE染色步骤进行染色,中性树胶封片,光镜下观察肝组织切片的病理学改变,并在相同设置下不同视野随机拍照取图。
1.4.9 Western Blot印迹法检测Nrf2蛋白表达
称取0.2 g肝组织于1.5 mL EP管剪碎后用RIPA裂解缓冲液制备小鼠肝裂解物,匀浆、离心后取上清。蛋白浓度用BCA试剂盒测定。制备SDS-PAGE电泳分离蛋白后,通过湿转法将蛋白转移到PVDF膜上,并用5%的脱脂牛奶封闭1 h,4 ℃冰箱孵育一抗过夜,室温孵育二抗1 h左右,暗室发光后显影和定影,将蛋白表达于胶片,扫描仪扫描胶片。Image-Pro Plus6.0灰度扫描、GraphPad Prism5软件进行分析处理。
1.4.10 RT-PCR法检测基因表达变化
小鼠肝脏Nqo1、G6pdx、SOD2 mRNA表达情况。Trizol法提取RNA,核酸检测仪测定RNA浓度及纯度后逆转录为cDNA。具体引物信息:Nqo1上游引物序列:5’-GGGACATGAACGTCATTCTCTG-3’,下游引物序列 5’-GGTCTCCTCCCAGACGGTTT-3’G6pdx上 游 引 物 序 列 5’-GCTGCACAAGATTGATCGA GAA-3’, 下 游 引 物 序 5’-GGTACCCTCGTACTG GAAGCC-3’,SOD2 上游引物序列 5’-GCAAGG TCGCTTACAGATTGC-3’,下游引物序列 5’-GCTT TCAGATAGTCAGGTCTGACG-3’,18S rRNA 上游引物序列为5’-GGTCATAAGCTTGCGTTGATTAAG-3’,下 游 引 物 为 5’-CTACGGAAACCTTGTTACGA CTTT-3’。扩增体系为20 μL,配置96孔板封条、离心后放置于ABI PRISMx 7000荧光定量PCR仪进行Real-Time PCR,18S rRNA为内参基因,精确定量目的基因的mRNA表达水平。
1.4.11 统计学方法
采用GraphPad Prism 5和Image-Pro Plus软件处理并进行统计学分析。结果均采用(±s)形式表示,各组均数之间比较用单因素方差分析,p<0.05为差异具有统计学意义。
2 结果与讨论
2.1 香叶木素对LO2细胞活力及GSH的影响

图1 不同浓度的香叶木素(15, 30 μM)对APAP致LO2细胞活力及GSH含量的影响Fig.1 Effects of Dios on cell viability in LO2 with 10 mM APAP exposure
肝细胞中谷胱甘肽的浓度非常高,在肝脏代谢外援物质过程中发挥主导作用。因此,如图1所示,与正常对照组相比,APAP组LO2细胞活力明显降低,与APAP组比较,Dios预处理组的细胞活力显著升高(##,p<0.01),与正常对照组相比,APAP组LO2细胞 GSH 含量明显降低至 4.45±1.21 μmol/mg(***,p<0.001)。与APAP组比较,Dios预处理组LO2细胞GSH 含量也显著提高至 12.33±1.47和 21.65±2.91 μmol/mg(##,p<0.01),因此 Dios预处理组可以保护APAP诱发的肝损伤且部分是通过保护自由基细胞免受APAP诱导的肝毒性。
2.2 香叶木素对小鼠血清指标的影响

图2 香叶木素对APAP致急性肝损伤小鼠血清中AST和ALT水平的影响Fig.2 Effects of Dios on serum ALT and AST levels of acute liver-injury mice induced by APAP (±s, n=10)
AST和ALT是检测肝功能的最重要、最敏感的指标,其活性的高低反映了肝脏受损的程度[9]。当肝细胞受到损伤时,这些标记物会从肝脏渗漏到血液中,从而导致二者血清浓度急剧升高。正常状态下ALT和AST存在于肝细胞浆中,而高剂量APAP引起的肝细胞损伤导致ALT和AST释放到细胞外间隙,因此ALT和 AST是评估肝细胞损伤程度的一个有效的定量标记[10]。如图2所示,与正常对照组比较,APAP组血清中ALT和AST水平显著升高至975.6±207.8 IU/L和1543.7±224.6 IU/L(***,p<0.001),说明小鼠急性肝损伤模型制备成功;Dios 30 mg/kg和60 mg/kg组的血清ALT和AST水平明显低于APAP组194.2±129.1 IU/L 和 46.9±310.4 IU/L(###,p<0.001),且存在一定的剂量效应关系。说明Dios可以降低急性肝损伤的转氨酶活性,具有较好的保护肝脏受损的作用。
2.3 香叶木素对小鼠肝脏中GSH和MDA的影响

图3 香叶木素对APAP致急性肝损伤小鼠肝匀浆中GSH和MDA水平的影响Fig.3 Effects of Dios on Liver GSH and MDA levels of acute liver-injury mice induced by APAP (±s, n=10)
GSH主要在肝脏中产生[11],当APAP过量时,过多的NAPQI的产生会耗尽GSH,而GSH的耗竭会影响肝脏的正常功能。MDA是一种很好的脂质过氧化程度的生物标志物,其含量高低可反映机体细胞受自由基攻击的严重程度[12]。如图3所示,APAP组小鼠肝组织匀浆中 GSH水平明显低于正常对照组显著降低 5.54±0.89 μmol/mg(***,p<0.001),而Dios组抑制了GSH水平的降低,且Dios 60 mg/kg组明显升高了 GSH 含量 6.94±0.72 和 8.95±0.86 μmol/mg(##,p<0.01)。与正常对照组比较,APAP组的MDA含量明显升高至1.91±0.27 nmol/mg(***,p<0.001),Dios 30 mg/kg和60 mg/kg组较APAP组明显降低,分别下降至 1.04±0.16 和 0.55±0.14 nmol/mg(###,p <0.001)。以上数据说明 Dios能够提高肝组织抗氧化能力以及减轻APAP对肝细胞产生的脂质过氧化作用。
2.4 香叶木素对小鼠肝组织病理变化影响

图4 香叶木素对APAP致急性肝损伤小鼠肝组织病理变化的影响(×100)Fig.4 Effects of Dios on liver tissue pathological changes of acute liver-injury mice induced by APAP(×100)
肝脏组织病理学检查被认为是判断肝脏损伤的金标准,肉眼观察正常对照组小鼠肝脏颜色暗红,组织紧实富有弹性;模型组肝脏组织颜色呈红褐色,表面出现可见白色颗粒。Dios组大体病变减轻,且随着剂量增大减轻更为明显。显微镜下观察对照组病理切片,如图4所示,正常对照组小鼠肝细胞以中央静脉为中心呈放射状整齐排列,肝小叶结构完整,未见明显病理改变(见图 4a);模型组肝脏组织切片显示中央静脉周围的肝小叶中心坏死,肝细胞出现明显的肿胀变性,汇管区及间质有大量炎性细胞浸润,细胞边界气球样变性减少(见图4b);Dios 30 mg/kg组细胞坏死显著减轻,炎性细胞浸润减轻(见图4c)。Dios 60 mg/kg组细胞坏死显著减轻,肝小叶结构基本正常,汇管区炎性细润浸润较少,肝索整齐(见图 4d)。肝细胞损伤面积如图所示,与对照组相比,APAP组损伤面积高达39.55±3.45%(***,p<0.001),与APAP 组相比,Dios 30 mg/kg和60 mg/kg组肝细胞损伤面积明显降低 20.45±1.33%和10.45±2.75%(###,p<0.001)。因此,Dios组明显缓解肝组织损伤均有一定的作用。
2.5 香叶木素对小鼠肝组织 Nrf2蛋白表达的影响
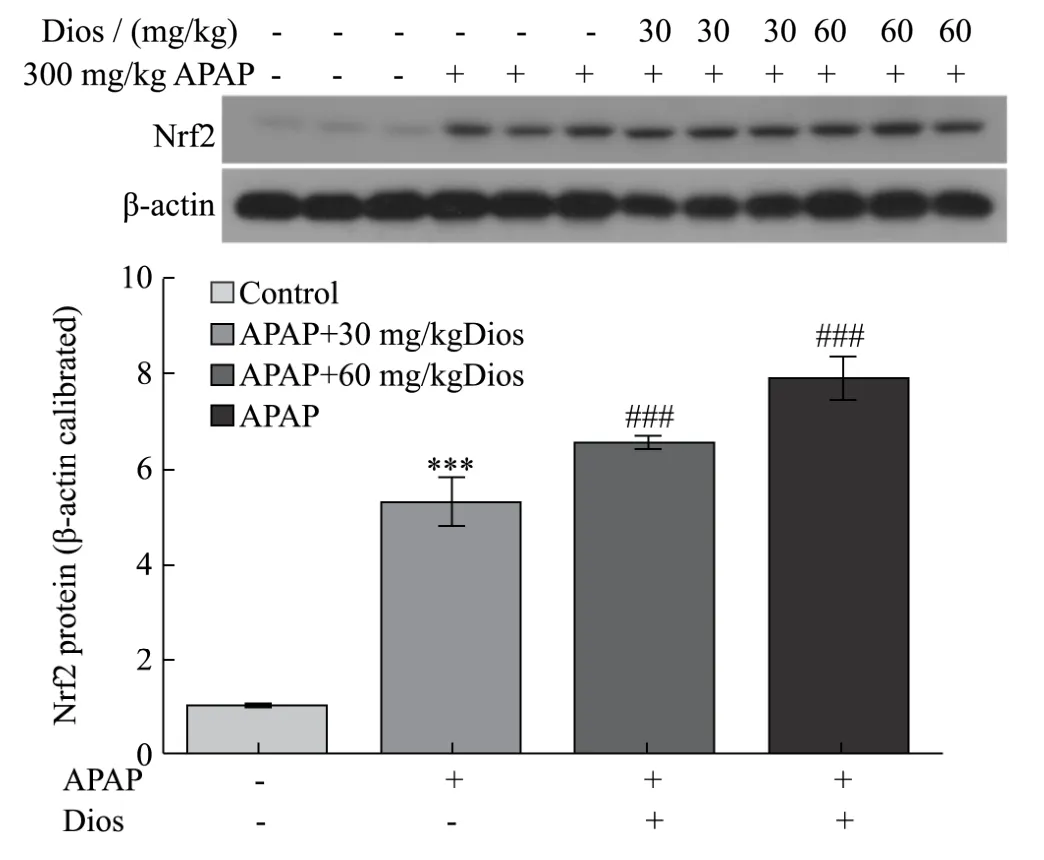
图5 香叶木素对APAP致急性肝损伤小鼠肝组织中Nrf2蛋白表达的影响Fig.5 Effects of Dios on protein expression of Nrf2 in liver of acute liver-injury mice induced by APAP
核因子 Nrf2是激活抗氧化防御系统必不可少的转录因子,其通过与 ARE相互作用调节编码抗氧化蛋白,是迄今为止发现的最为重要的内源性抗氧化应激通路[13]。生理状态下,Nrf2在细胞质中与它的抑制蛋白果蝇肌动蛋白结合蛋白Kelch样ECH相关蛋白1( Kelch-like ECH-associated protein 1,Keap1)结合,无法进入到细胞核中发挥转录活性[14]。当受到 ROS等刺激时,Keap1与Nrf2解偶联使得Nrf2转位入核,与Maf蛋白结合成异质二聚体后与ARE结合,激活下游靶基因如NQO1、G6pdx、SOD2等表达,从而发挥抗氧化损伤作用[15]。如图5所示,Western blot法检测肝组织 Nrf2蛋白表达水平,与正常对照组相比,APAP组Nrf2表达增加5.61倍(***,p<0.001),Dios低剂量组Nrf2表达水平与APAP组无明显差异,而Dios高剂量组核内Nrf2表达水平显著升高,差异有统计学意义(#,p<0.05)。
2.6 香叶木素对小鼠肝组织NQO1、G6pdX、SOD2 mRNA水平的影响

图6 香叶木素对APAP致急性肝损伤小鼠肝组织中NQO1、mG6pdX、SOD2 mRNA表达的影响Fig.6 Effects of Dios on mRNA expression of mNQO1, G6pdx,SOD2 in liver of acute liver-injury mice induced by APAP
氧化应激是 APAP诱发急性肝损伤最重要的发病机制之一,其中氧自由基对APAP引起的急性肝损伤的发生起着重要作用,NQO1、G6pdx、SOD2都是重要的抗氧化转录因子,有报道mNQO1、mG6pdx、mSOD2都是Nrf2的直接转录靶标。如图6所示,实时定量PCR结果显示,APAP组NQO1、G6pdX、SOD2表达水平比正常对照组升高(*,p<0.05);Dios低剂量组相比于APAP组略有上调,但差异无统计学意义;与APAP组相比,Dios高剂量组NQO1、G6pdX、SOD2的表达水平明显升高,差异有统计学意义(#,p<0.05)。这些结果提供了有力的证据支持香叶木素介导的抗氧化基因上调可归因于Nrf2表达增强。
3 结论
3.1 急性肝损伤是多种肝脏疾病发生、发展及最终导致肝功能衰竭的始动环节和共同途径,目前对急性肝损伤的治疗仍是一个全球性的问题。建立APAP诱发的小鼠急性肝损伤模型是研究药物护肝活性的经典方法,为深入研究急性肝损伤的发生机制,开发新的安全高效药物奠定基础。香叶木素是一种黄酮类化合物的主要活性成分,此类物质具有抗活性氧自由基、抗感染、抗炎症、抗过敏、抗肿瘤以及植物雌激素作用等多种药理活性。杨阳等[16]研究发现香叶木素可抑制肝癌HepG2细胞的活力、促进细胞凋亡、促使肝癌细胞 HepG2细胞的生长阻滞。Yang[17]研究发现香叶木素通过抗氧化、抑制NF-κB信号传导、抑制炎症介质,对内毒素引起的小鼠急性肝衰竭具有保护作用。Wang等[18]报道通过香叶木素激活Nrf2/NQO1-HO-1信号通路对抗氧化应激保护H2O2诱导的LO2细胞氧化损伤。然而,香叶木素能否通过抗氧化应激对APAP引起的肝损伤起保护作用尚未被研究。本研究第一次表明,在体外和体内已证明显著抑制APAP诱导的肝毒性,香叶木素预处理具有潜在的肝脏保护作用。
3.2 现有研究表明氧化应激在APAP诱导的肝细胞毒性中起关键作用[19],毒性主要由NAPQI(APAP的活性代谢物)与 GSH的巯基结合,其他细胞蛋白(如线粒体蛋白)及其随后的氧化的共价结合介导。过度生成肝细胞中的自由基可能引发脂质过氧化,损害线粒体呼吸,并干扰钙稳态,从而诱导肝细胞死亡和肝功能衰竭[20]。我们目前的实验研究表明,与APAP组相比,香叶木素能通过降低小鼠血清中ALT、AST水平,增加肝细胞谷胱甘肽 GSH的含量,减少脂质过氧化物MDA的生成,小鼠肝组织H & E染色显微镜观察结果显示,香叶木素可以在一定程度上抑制了小鼠肝脏组织坏死,保护了小鼠肝细胞的完整性,对肝脏起到保护作用。而香叶木素中所含黄酮类化合物具有抑制自由基的生成,降低脂质过氧化和刺激抗氧化酶的作用,香叶木素可以清除机体内的氧自由基和过氧化物,具有良好的抗氧化能力,进而显著改善小鼠的肝损伤。香叶木素通过上调肝组织Nrf2的表达,诱导下游靶基因NQO1、G6pdx、SOD2的表达,提高组织内GSH的含量,清除ROS,增强抗氧化损伤的能力。
3.3 综上所述,香叶木素具有抗氧化、明显减轻APAP引起的急性肝损伤,抑制急性肝损伤的发生与发展,具有预防性保护作用,其可能机制是通过激活Nrf2/ARE信号通路,增加下游NQO1、G6pdx、SOD2的表达,提高组织内GSH含量,促进ROS的清除,减轻肝脏组织脂质过氧化,从而对APAP引起的肝损伤起保护作用。
