集胞藻PCC6803中S2P蛋白酶Sll0528参与铵盐胁迫响应的重要性
2018-11-06刘小芳陈谷林诗琪许白雪
刘小芳,陈谷,林诗琪,许白雪
(华南理工大学食品科学与工程学院,广东广州 510640)
随着现代工业和农业的快速发展,大量的污水排放以及肥料重施,造成废水中氮的含量剧增。近几十年来,我国地表水和地下水中氮的浓度不断增加,例如 1980年到 2010年,我国每年的氮沉积量增加60%[1,2]。氮过量影响生态环境稳定和农业效益,处理废水成为重要的工作。微藻不但可以用于新型能源的开发,也可以应用于处理工农业废水[3]。微藻可以利用废水中各种形式的氮源,如铵盐或硝酸根;但是微藻的生长对铵盐浓度较敏感,处理废水过程中过高浓度的铵会抑制微藻的生长。研究微藻在铵盐中的生长,探索微生物适应高浓度 NH4+/NH3的机制,将为未来提高微藻对铵盐的耐受奠定基础。研究拟南芥中EGY1突变导致的铵敏感突变株amso1对铵盐胁迫的响应机制,揭示参与铵胁迫响应的基因中90%的基因调控都依赖于EGY1[4]。EGY1是拟南芥S2P蛋白酶编码基因之一,故本研究探讨集胞藻中的S2P蛋白酶基因sll0528是否参与集胞藻对铵盐胁迫的响应。
集胞藻PCC6803(Synechocystis sp. PCC6803)属蓝藻门色球藻目集胞藻属,它通过二分裂方式增殖,培养周期短,既可光合自养、混养还可异养。类似绿色植物,集胞藻PCC6803有两个光合作用系统,光系统Ⅰ(PSⅠ)和光系统Ⅱ(PSⅡ)。由于集胞藻PCC6803独特的生理特征,以及测序完全等特点,已成为研究光合作用、胁迫响应等的模式生物,也作为工程菌应用于新型能源的开发[5,6]。S2P家族蛋白酶存在于从细菌到人类的多数物种,不同物种间的S2P蛋白酶都具有保守的催化基序[7],S2P蛋白酶介导的调节膜内蛋白水解机制被认为是潜在的外界信号接收传导机制。在大肠杆菌等原核细菌中,当机体受到刺激时,S1P和S2P蛋白酶连续剪切抗σ因子,释放EFCσ因子,EFCσ因子结合RNA聚合酶中心酶,转录表达相应的蛋白以适应刺激[8]。集胞藻PCC6803中有四个S2P蛋白酶 Sll0862、Slr0643、Sll0528、Slr1821。通过敲除基因slr0643并研究该缺失藻株Δslr0643,发现Slr0643参与酸胁迫响应机制[9]。基因sll0862的敲除导致缺失藻株Δsll0862在高温和氧化胁迫响应中表现出缺陷,说明Sll0862参与调控高温和氧化胁迫响应[10]。应用实时荧光定量PCR技术(RT-qPCR)研究集胞藻基因sll0528在不同胁迫下的表达谱,以及对sll0528敲除的缺失藻株Δsll0528进行各种胁迫响应实验,都表明Sll0528参与多种胁迫包括盐、渗透压、高光等[11,12]。而敲除slr1821的缺失藻株Δslr1821在热胁迫响应研究中揭示了 Slr1821对热胁迫响应机制起着重要作用[13]。
本研究构建了集胞藻PCC6803基因sll0528在光诱导强启动子-基因psbA2启动子(PpsbA2)驱动下的过表达藻株 OE0528,并探究比较了不同氯化铵浓度条件下野生型(wild type,WT)、过表达藻株OE0528和缺失藻株Δsll0528的生理表型,初步揭示S2P蛋白酶Sll0528响应NH4+的功能与机理,为后续深入探索微藻对NH4+胁迫响应机制打下基础。
1 材料和方法
1.1 实验材料与仪器
实验材料:质粒 pUC118,质粒 pET-30b(+),大肠杆菌DH10B,限制性内切酶,T4 DNA Ligase,Taq DNA聚合酶,Primer Star NDA聚合酶,硫酸卡那霉素,氯霉素,氨苄青霉素,BG11培养基(实验室自配),HEPES,Na2S2SO3,三羟甲基甲胺基乙磺酸(TES),质粒小量提取试剂盒,细菌基因组DNA快速提取试剂盒,细菌/细胞RNA提取试剂盒,DNA纯化回收试剂盒,反转录试剂盒,RT-qPCR试剂盒,氯化铵等。集胞藻PCC6803野生型,购自美国标准藻种库。
主要仪器:PCR仪,核酸电泳仪,冷冻循环水浴锅,干式恒温器,超净工作台,恒温培养箱,台式恒温振荡器,凝胶成像系统,高压灭菌锅,鼓风烘箱,多功能组合摇床,生物安全柜,紫外分光光度计,小型台式离心机,台式冷冻离心机,移液枪等。
1.2 实验方法
1.2.1 重组质粒的构建与鉴定
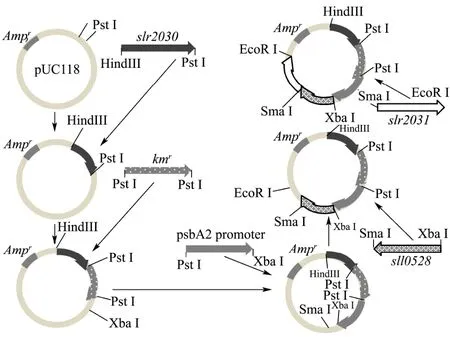
图1 重组质粒p3031P0K构建示意图Fig.1 Schematic diagram of construction program for the recombinant plasmid p3031P0K
以集胞藻 PCC6803基因组 DNA为模板,通过PCR扩增得到slr2030和slr2031片断,sll0528片段,和psbA2的启动子片段,以pET-30b(+)为模板PCR扩增得到抗卡那霉素(kmr)片段,引物见表1,引物作用位置见图2。基因参考序列来自NCBI数据库。将获得的目的基因片段纯化回收后利用限制性内切酶剪切,同时用同样的限制性内切酶剪切载体质粒pUC118,再用连接酶将目的基因片段和载体质粒按顺序一一连接起来,构建重组质粒 p3031P0K,重组质粒p3031P0K构建方案如图1所示。构建完成重组质粒后通过PCR技术在DNA水平验证目的基因片段是否插入质粒。
1.2.2 同源重组质粒转化集胞藻PCC6803
采用 Williams[14]的方法将构建好的重组质粒p3031P0K通过同源臂slr2030和slr2031同源转化进入集胞藻PCC6803野生型。使过表达元件kmr+启动子PpsbA2+sll0528插入到集胞藻基因slr2030和slr2031中间的中性位点,方案如图2所示。得到转化子后,将转化子在含低浓度硫酸卡那霉素的固体培养基上生长,待长出单藻落,转移到含低浓度硫酸卡那霉素的液体培养基中培养,按此方式逐步提高抗生素浓度并对过表达藻株传代。期间不断检测DNA水平上的中性位点是否被替代,最终得到中性位点被替代的能稳定遗传的过表达藻株OE0528。进而进行基因sll0528表达水平的验证。
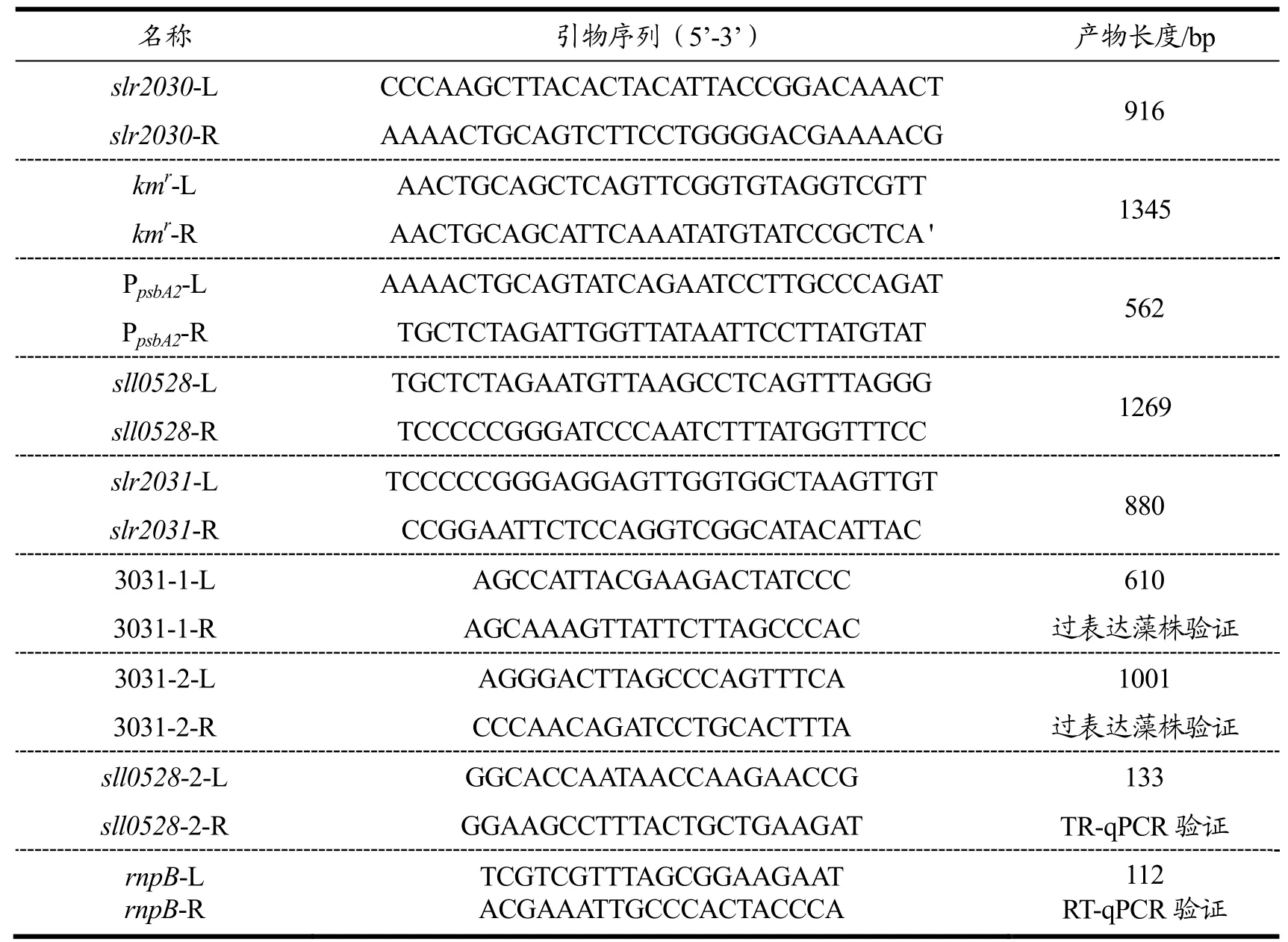
表1 引物序列Table 1 Sequences of primers
1.2.3 集胞藻PCC6803的培养方法
以OD730=0.1为起始浓度将集胞藻接入液体BG11培养基,在光照 25 µmol/(m2·s),温度 29 ℃,转速 150 r/min摇床中连续培养5 d。液体BG11培养基中加入终浓度为0.02 M的HEPES。集胞藻藻落生长于固体BG11培养基中。固体BG11培养基加入浓度为0.02 M的HEPES,终浓度为0.3%的Na2S2SO3和终浓度为8 mM的TES。培养过程需加入相应抗生素。
1.2.4 过表达藻株OE0528在DNA水平的鉴定
用试剂盒提取WT和过表达藻株OE0528的基因组DNA,用表1所示过表达藻株验证用引物进行PCR扩增,分别扩增中性位点基因序列,或者是插入中性位点的片段,看产物电泳图条带位置与理论值是否一致,来判断过表达元件是否进入到集胞藻WT基因组相应位置。
1.2.5 过表达藻株OE0528在RNA水平的验证
用试剂盒分别提取WT和过表达藻株OE0528的RNA,用DNase去除RNA中残留的DNA,再将RNA反转录成单链cDNA,以cDNA为模板用RT-qPCR验证用引物(表1所示)进行RT-qPCR扩增,来验证sll0528是否得到过表达。采用相对定量法,以 rnpB基因作为内参。基因rnpB在集胞藻中负责编码RNase P的亚基B,表达量恒定[15]。得到扩增曲线后统一阈值线得出CT值,将参照基因与目的基因CT值相减得∆CT值,目的基因表达量=2∆CT,得到野生型WT和过表达藻株OE0528中sll0528相对表达量,归一化后进行比较。每个样品做三个平行,每个平行4个重复。
1.2.6 集胞藻吸光度值和全细胞吸收值的测定
将WT和过表达藻株OE0528以OD730=0.1作为起始浓度接入液体BG11培养基中,控制胁迫条件,在光照 25 µmol/(m2·s),温度 29 ℃,转速 150 r/min 摇床中连续培养5 d,每24 h取样2 mL用紫外分光光度计测定730 nm处的吸光度值(A730/OD730)或进行全波长扫描,得到数据绘制曲线。每个样品做3个平行。
1.2.7 数据统计分析
本文采用Origin Pro 8.5,SPSS 19.0等软件处理分析实验数据,得到集胞藻生长曲线图和全细胞吸收图,基因表达量柱状图等。实验重复数均为 3次,n=3;图中误差线均表示实验结果=均数±标准差(±SD)。显著性检验采用单因素方差分析,与对照组做比较,“*”表示 p<0.05 为显著差异,“**”p<0.01 为极显著差异。
2 结果和讨论
2.1 重组质粒的构建与鉴定
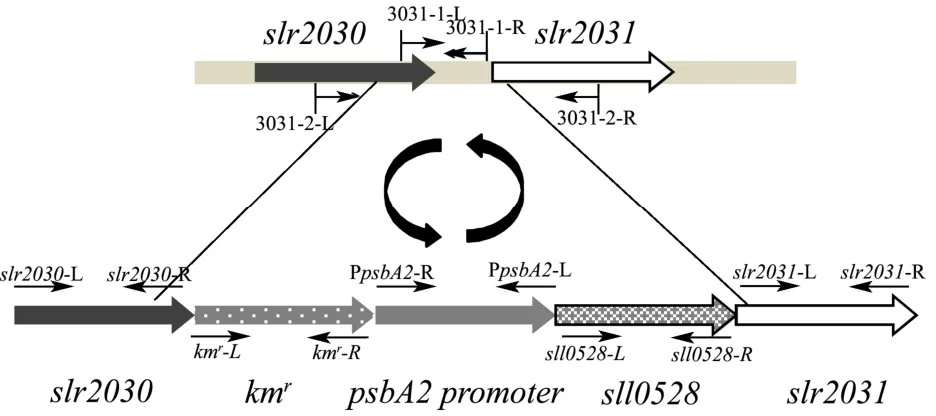
图2 重组质粒p3031P0K同源转化入集胞藻示意图Fig.2 Schematic diagram of recombinant plasmid p3031P0K homologous transformed into Synechocystis sp. PCC6803
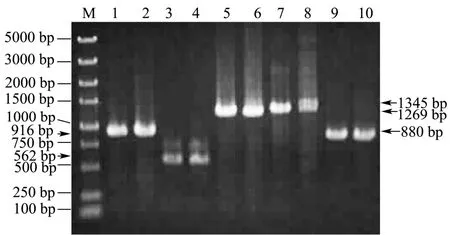
图3 重组质粒鉴定Fig.3 Identification of the recombinant plasmid
按图1所示方案,构建好重组质粒p3031P0K,质粒插入基因slr2030片段、kmr,强启动子PpsbA2,基因sll0528和基因slr2031片断。重组质粒构建完成后采用PCR鉴定目的基因是否插入质粒,所用引物与构建时扩增5段目的基因用引物相同,见表1,引物作用位置图2所示。以重组质粒和WT基因组分别作模板,扩增基因slr2030片段、强启动子PpsbA2、sll0528、基因slr2031片断;再以重组质粒和pET-30b(+)分别作模板,扩增 kmr。产物电泳并分析比较,结果显示重组质粒中各个片段PCR产物与以WT基因组、PET-30b(+)作模板各个片段PCR产物电泳后条带位置一致(图3)。测定PCR产物序列并比对,结果相同,说明5个目的片段成功插入到载体质粒pUC118。
2.2 过表达藻株OE0528的构建与鉴定
2.2.1 DNA水平上鉴定
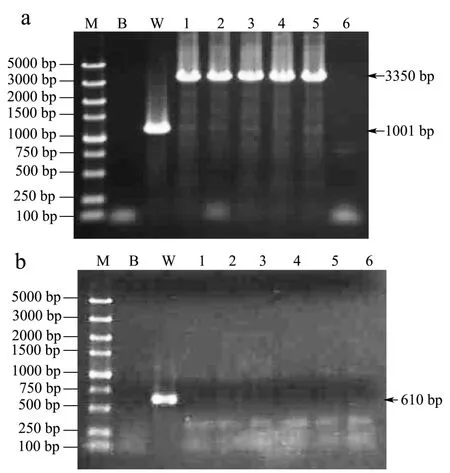
图4 OE0528在DNA水平的鉴定Fig.4 Identification of the OE0528 at the DNA level
按图2所示方案,将构建好的重组质粒p3031P0K转化导入集胞藻PCC6803野生型基因组,通过同源重组双交换,借助同源臂slr2030和slr2031,将过表达元件 kmr+启动子 PpsbA2+sll0528插入到野生型基因组的slr2030和slr2031基因中间,以期达到过表达基因sll0528的目的。基因slr2030和slr2031中间位置可以用于插入外源基因[16],作为中性位点,故选这两段基因作为同源臂。待筛选到sll0528过表达藻株OE0528后,提取过表达藻株DNA,用引物3031-2-L,3031-2-R和3031-1-L,3031-1-R(表1)PCR扩增相应片段,引物作用位置见图2,在DNA水平验证sll0528的过表达。结果见图 4。通过不断提高培养基中卡那霉素(Km)的浓度,最终筛选出6株独立的sll0528过表达藻株OE0528。分别以野生型和6株过表达藻株基因组为模板,用引物3031-2-L,3031-2-R和3031-1-L,3031-1-R进行PCR扩增。先以3031-2-L,3031-2-R为引物 PCR扩增,野生型扩增结果为 slr2030和slr2031部分片断和基因间片断,长度为1001 bp;当过表达藻株中 kmr+启动子 PpsbA2+sll0528三个片段完全插入到中性位点时,扩增结果包括 kmr+启动子PpsbA2+sll0528三个片段,长度为3350 bp;当过表达藻株中三个片段未完全取代中性位点片段时,扩增结果会出现3350 bp和1001 bp两条条带。如图4A所示,野生型PCR扩增条带在1001 bp附近,OE0528-1、OE0528-2、OE0528-3、OE0528-4、OE0528-5 各过表达藻株PCR扩增条带在3350 bp附近,长度与理论值一致,初步说明sll0528过表达元件已完全插入5株藻株中。但是过表达藻株 OE0528-6扩增结果显示在3350 bp附近没有条带,说明过表达藻株OE0528-6中三个片段没有插入到预期的中性位点,或者可能是引物3031-2-L和3031-2-R和OE0528-6基因组的结合位点发生变化导致引物无法正常结合而扩增。
为进一步验证结果,以3031-1-L,3031-1-R为引物进行PCR扩增集胞藻slr2030和slr2031间中性位点被取代的部分,野生型结果为slr2030和slr2031中间部分,长度为610 bp;过表达藻株中,过表达元件三个片段完全取代中性位点slr2030和slr2031中间部分时,扩增结果应当为没有任何条带;三个片段不完全取代中性位点时,扩增结果会有条带于610 bp处。结果如图4B所示,野生型PCR扩增结果电泳后条带在610 bp附近,6株过表达藻株扩增结果都没有条带于610 bp处。进一步说明过表达藻株中 kmr+启动子PpsbA2+sll0528三个片段完全取代中性位点。这些结果说明 sll0528的过表达元件在藻株 OE0528-1、OE0528-2、OE0528-3、OE0528-4、OE0528-5 中正确插入预定位置,但这些藻株中基因sll0528表达量是否高于WT仍需要进一步实验证明。
2.2.2 RNA水平上鉴定
收集WT和6株过表达藻株OE0528培养至第4 d的藻液,提取RNA,设计引物sll0528-2-L,sll0528-2-R(表1),通过RT-qPCR实验考察过表达藻株中基因sll0528是否过表达。得到目标基因和参照基因的 CT值,用∆CT值法,算出目标基因的表达量,并计算相对于WT基因sll0528的表达量(图5)。
图5a RT-qPCR扩增曲线中各样品两个基因的扩增曲线相互聚集,图5b RT-qPCR溶解曲线中两个基因各自引物的峰值单一,都显示出引物特异性好,实验结果可靠。其中OE0528和WT中的rnpB基因扩增曲线基本重叠,说明rnpB在OE0528和WT表达量恒定,适合作为内参。以WT中sll0528的表达量为1,过表达藻株 OE0528-1、OE0528-2、OE0528-3、OE0528-4、OE0528-5,OE0528-6中基因sll0528相对表达量分别是12.48、19.93、19.22、25.31、17.37(图5c),相对于WT,过表达藻株中sll0528表达量明显提高。说明启动子PpsbA2+sll0528基因片段在过表达藻株OE0528中成功插入并有效表达。6株过表达藻株中OE0528-4基因sll0528的相对表达量最高。
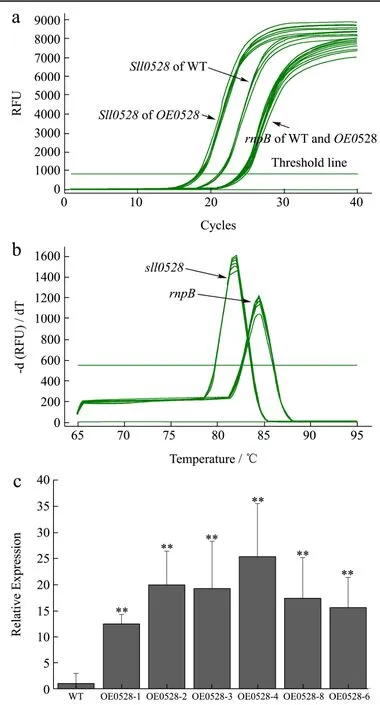
图5 OE0528在RNA水平的鉴定Fig.5 Identification of the OE0528 at the RNA level
2.3 过表达藻株OE0528的生长曲线
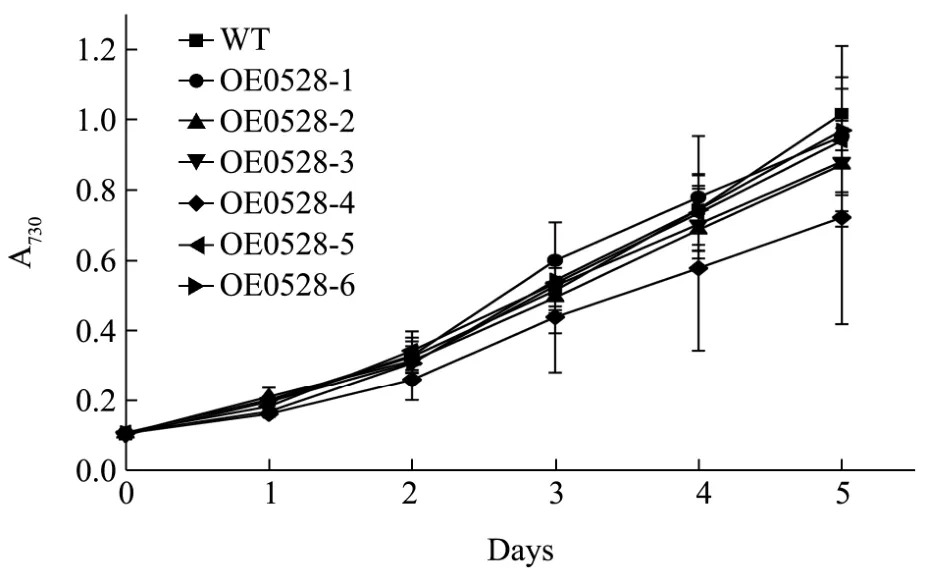
图6 OE0528的生长曲线Fig.6 Growth curve of the OE0528
为研究sll0528的过表达对集胞藻PCC6803的正常生长是否有影响,将 6株过表达藻株 OE0528和WT以起始浓度OD730=0.1开始,在正常条件下连续培养5 d,并且每24 h取样测定OD730值,测得OD730值绘制成生长曲线,如图6所示。从图中可以看出,6株过表达藻株OE0528生长曲线和WT生长曲线相近,各过表达藻株分别和WT对比进行显著性分析,所有p>0.05,无显著性差异。其中OE0528-4生长速率稍慢,但sll0528在OE0528-4中表达量最高(图5b),是否由于基因sll0528的高表达导致其生长速率降低,有待后续验证。后续胁迫实验采用过表达藻株OE0528-3,后续陈述中将其命名为OE0528。
2.4 缺失藻株∆sll0528在氯化铵胁迫下的生长情况
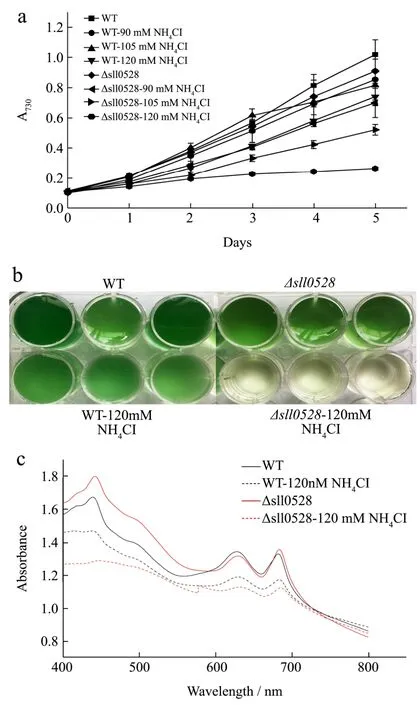
图7 ∆sll0528在氯化铵胁迫下的生长曲线和全细胞吸收图Fig.7 Growth curve and whole-cell absorption spectra of∆sll0528 under ammonium chloride stress
考察 sll0528基因对集胞藻响应铵盐胁迫的功能与作用,首先利用之前构建的敲除 sll0528缺失藻株∆sll0528进行氯化铵胁迫实验。∆sll0528构建采用同源重组双交换,用氯霉素抗性基因 cmr替换集胞藻PCC6803中的sll0528,达到完全敲除sll0528目的[12]。WT和∆sll0528分别在终浓度0 mM、90 mM、105 mM、120 mM的氯化铵,正常温度光照转速条件下,连续培养5 d,绘制生长曲线(图7a),并于第5 d测定全细胞吸收值(图7c)。从图7a中可以看出,WT在90 mM、105 mM浓度氯化铵下生长曲线和未加氯化铵下差异不大,WT生长并没有受到太多影响,在120 mM浓度氯化铵条件下,WT生长速率稍微减弱。说明WT能适应低浓度氯化铵,在高浓度氯化铵下生长会稍微受影响。而∆sll0528的生长速率随着氯化铵浓度增加明显变慢,在120 mM浓度氯化铵下生长速率为OD7300.02/d。说明∆sll0528对铵盐生长环境敏感,随着氯化铵浓度增加生长趋势明显变缓。对比WT和缺失藻株∆sll0528,缺失基因sll0528的∆sll0528对铵盐环境表现较为敏感,说明基因sll0528在适应铵盐环境起着重要作用。
比较WT和缺失藻株∆sll0528在120 mM氯化铵条件下培养至第5 d的藻液颜色(图7b),缺失藻株∆sll0528接近透明无色,和WT相比几乎没有生长,说明基因 sll0528对集胞藻适应铵盐胁迫必不可少。WT加氯化铵条件和未加氯化铵相比颜色略浅,表明120 mM氯化铵对WT生长有一定影响。
进一步观察WT和∆sll0528在120 mM氯化铵条件下培养至第5 d的全细胞吸收图(图7c)。集胞藻PCC6803在全细胞吸收光谱中有三个特征峰,类胡萝卜素:500 nm~550 nm,藻蓝蛋白:600 nm~650 nm,叶绿素:680 nm,藻蓝蛋白和叶绿素分别是藻胆体和光合系统的重要组成部分,藻胆体作为天线系统和光合系统相互作用推动光合作用的进行[17],所以藻蓝蛋白和叶绿素的含量与光合作用呈正相关。图中可以看到,120 mM氯化铵下第5 d,WT的叶绿素和藻蓝蛋白峰值高于缺失藻株∆sll0528,提示 WT优于缺失藻株∆sll0528的光合系统功能,部分解释了WT在120 mM氯化铵条件下能生长,而∆sll0528几乎不能生长。说明基因sll0528对集胞藻PCC6803适应铵盐胁迫的重要作用,它的缺失导致缺失藻株∆sll0528在120 mM氯化铵条件下几乎不生长。
同时WT在氯化铵条件下的叶绿素和藻蓝蛋白峰值明显低于其未加铵盐条件下,和WT在120 mM氯化铵条件下生长速率慢于WT未加铵盐的现象相符。
2.5 过表达藻株OE0528在氯化铵胁迫下的生长情况
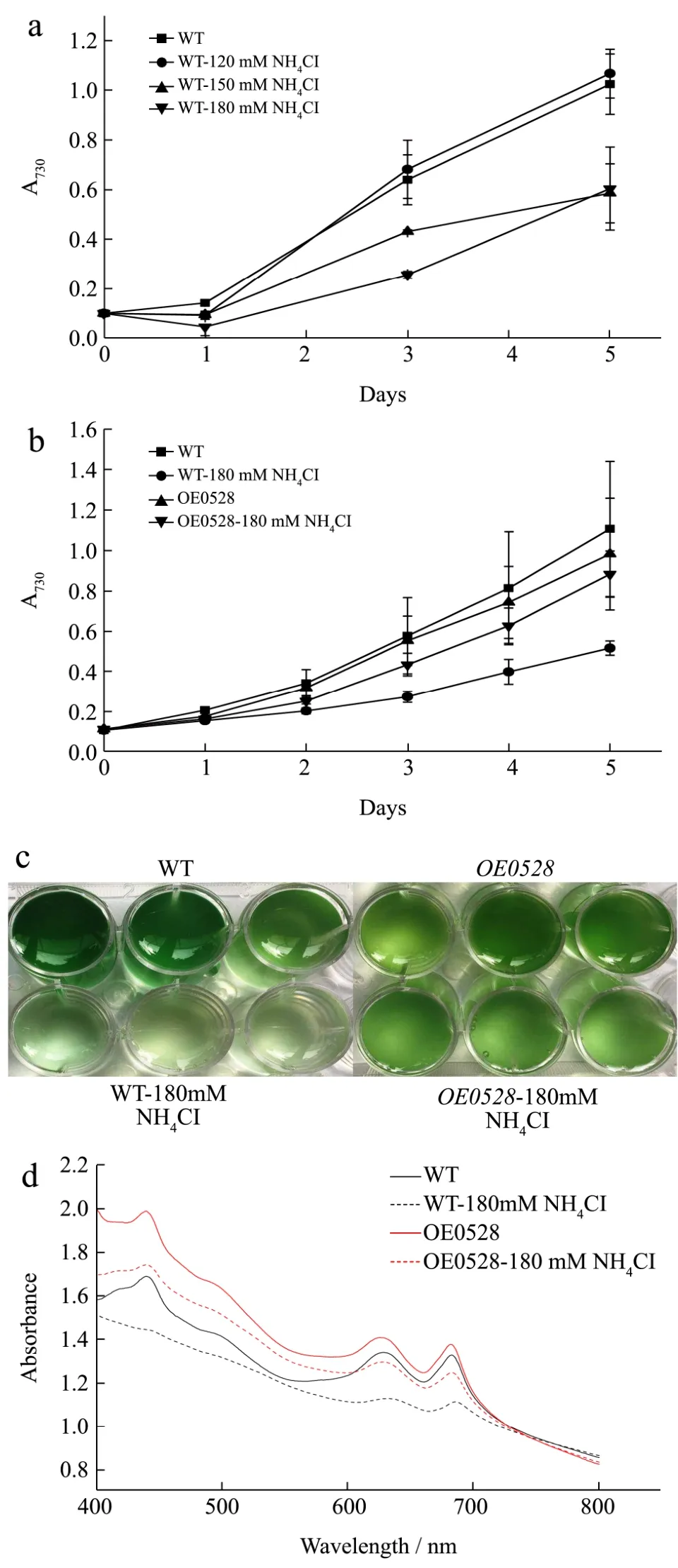
图8 OE0528在氯化铵胁迫下的生长曲线和全细胞吸收图Fig.8 Growth curve and whole-cell absorption spectra of OE0528 under ammonium chloride stress
基因sll0528的敲除导致缺失藻株∆sll0528对氯化铵比较敏感,就此探究过表达藻株 OE0528是否比WT更耐受高浓度氯化铵,故需比较过表达藻株OE0528和WT在高浓度氯化铵条件下的生长情况。首先对WT进行高浓度氯化铵培养,找出WT不能耐受的氯化铵浓度。六孔板实验结果显示,在高浓度氯化铵培养下WT生长受阻的现象随铵盐浓度上升而明显加剧(图8a),180 mM氯化铵对WT生长影响大,第3 d、第5 d OD730值仅为对照组未添加氯化铵的67%和 57%。故选用 180 mM 氯化铵来对比过表达藻株OE0528和WT的生长状况。
如图 8b所示,180 mM 氯化铵下,过表达藻株OE0528生长明显优于WT,第三天起与WT有显著差异,第5 d时,OD730为WT的1.72倍。说明过表达藻株OE0528相对于WT更能耐受高浓度氯化铵,基因sll0528的过表达有利于过表达藻株OE0528适应铵盐胁迫。
图8c中,在180 mM氯化铵下培养至第5 d的藻液图片显示,WT颜色浅绿泛白,透彻清亮,而过表达藻株OE0528比WT颜色要深得多,显示正常的深绿色,提示旺盛的生长。从第5 d的全细胞吸收图(图8d)看到,180 mM氯化铵下,WT的叶绿素和藻蓝蛋白峰值明显低于过表达藻株 OE0528,说明在 180 mM氯化铵条件下WT的光合系统严重损伤,光合作用受到较大影响,而OE0528的光合系统却得到保护或进行了修复,损伤并不明显,光合作用受到较小影响。这些结果说明,过表达藻株OE0528比WT更能适应高浓度的氯化铵胁迫,揭示基因sll0528在集胞藻PCC6803耐受高浓度铵盐胁迫中起重要作用。
NH4+作为简单的无机盐形式是植物和藻类的优选氮源,它被同化掺入碳骨架利用。低浓度的铵被铵/甲基铵转运酶 Amt摄入,该酶的活性受氮状态影响[18],高浓度铵盐影响生物正常生长。细菌中有两种铵和碳骨架2-酮戊二酸结合的途径:直接通过谷氨酸脱氢酶GDH或者先后通过谷胺酰胺合成酶GS和谷氨酸合成酶GOGAT的作用。但蓝藻中GS-GOGAT循环是铵同化的主要途径[19]。GDH缺失的集胞藻PCC6803缺失藻株在正常条件下铵的同化不受影响[20]。蓝藻中存在两种GS酶和两种GOGAT酶[21]。有趣的是,集胞藻PCC6803中GS酶的作用会因过量铵的摄入而被弱化[22],提示过量铵存在时,机体需要调低铵摄入或铵同化机制以保护正常生长。有研究表明微藻的生长在低生物量密度时对铵更为敏感[23],说明铵盐毒性可能与光合系统的捕光能力相关;研究氨对微藻的抑制作用,表明高氨引起高PH直接影响微藻的光合作用[24];铵盐对集胞藻的作用位点机制是铵盐促发了PS II的放氧复合物(OEC)的光损伤;且铵盐耐受力与位于PS II的psbA多基因家族成员相关[25,26]。
通过WT和sll0528缺失藻株∆sll0528在120 mM氯化铵条件下培养,观察到WT生长稍微受影响,而∆sll0528几乎不生长,分析培养至第5 d的全细胞吸收图,发现∆sll0528的藻蓝蛋白和叶绿素合成严重受损,表明缺失基因sll0528的∆sll0528对铵盐胁迫更敏感。而WT和过表达藻株OE0528在180 mM氯化铵条件下培养,观察到WT生长受到较严重阻碍,生长速率是对照组未加氯化铵下的一半,OE0528的生长只是稍微受到影响,同样地,分析培养至第5 d的全细胞吸收图,发现180 mM氯化铵下OE0528比WT的藻蓝蛋白和叶绿素峰值明显更高,推测OE0528的色素合成途径轻微受损或恢复得较好,说明过表达藻株OE0528比WT更耐受180 mM氯化铵。
Sll0528是集胞藻PCC6803四个S2P蛋白酶中响应胁迫种类最多、响应上调表达倍数最高的一个[12],但是它对铵盐胁迫响应的功能与机理是首次被研究。作为调节跨膜信号传导的保守机制,S2P蛋白酶调控的膜内蛋白水解机制可以在机体受到外界胁迫时,感知信号、传递信号并激活相应基因的表达,以维持机体适应外界环境。
上述对 sll0528缺失藻株∆sll0528和过表达藻株OE0528在铵盐胁迫下的研究显示,Sll0528显然参与了铵盐胁迫的快速响应,可能介导了高铵盐浓度下对光合系统的保护或修复机制。后续进一步的实验将分析WT,OE0528,∆sll0528在氯化铵胁迫下的转录组和代谢组,深入阐明 Sll0528如何通过膜内蛋白水解机制调控集胞藻适应铵盐胁迫。
3 结论
本文通过构建集胞藻PCC6803基因sll0528过表达藻株OE0528,和已经构建的sll0528敲除的缺失藻株∆sll0528,对比野生型,研究集胞藻PCC6803在氯化铵胁迫下的生长表型,发现∆sll0528比WT对铵盐胁迫更敏感,OE0528则比WT更耐受高浓度的铵盐,表明Sll0528在集胞藻PCC6803适应铵盐胁迫中发挥重要的作用,参与了铵盐胁迫的快速响应,推测Sll0528直接或间接介导高铵盐浓度下对光合系统的保护或修复机制。本研究初步揭示集胞藻中S2P蛋白酶 Sll0528对铵盐胁迫的响应作用与机制,为未来揭示微藻对铵盐的响应机制和提高微藻对铵盐的耐受性和利用率奠定基础。
