皱褶假丝酵母脂肪酶CRL1在毕赤酵母中的高效表达及其催化合成维生素E醋酸酯
2018-11-06郝月绰林影梁书利
郝月绰,林影,梁书利
(华南理工大学生物科学与工程学院,广东广州 510006)
皱褶假丝酵母(C. rugosa),原称柱状假丝酵母(C.cylindracea),是一种半子囊不产孢子的食品安全级酵母菌株[1]。皱褶假丝酵母脂肪酶(C. rugosa lipases,CRLs)主要由野生型菌株ATCC 14830和Type VII生产[1],是目前应用最为广泛的商品化脂肪酶之一,在制药、食品、化妆品和能源等领域具有广泛的应用[2~5]。目前已知CRLs由8种同工酶组成,其中CRL1具有最高的表达量和酶活力[6~8]。不同商品酶之间由于CRLs的成分和比例不同,在催化效率、区域选择性和立体选择性上表现出显著差异[9,10]。分离或生产单一的皱褶假丝酵母脂肪酶,尤其是 CRL1,对开展CRLs的进一步研究具有重要意义。
CRL1已经被报道在毕赤酵母(Pichia pastoris)中表达成功[8,11,12]。Brocca等[11]首次实现了CRL1在毕赤酵母的活性表达,并发现对丝氨酸非通用密码子的改造是重组 CRL1成功表达的关键。Chang等[13]和Xu等[12]分别通过培养基优化以及基因过表达的方法将CRL1在毕赤酵母的表达量进一步提高,而关于启动子和分泌信号肽的系统优化目前尚未报道。毕赤酵母表达系统是目前应用最为广泛的外源蛋白表达系统,既具有原核表达系统易培养、繁殖快的优点,又可对外源蛋白进行翻译后加工修饰。此外,毕赤酵母遗传背景清晰、便于遗传操作,拥有强大的启动子、能够高效表达外源蛋白,适合高密度发酵且便于分离纯化。作为模式菌株或工业生产菌株,目前已经有超过5000种外源蛋白在毕赤酵母中成功表达[14]。
维生素 E(生育酚)作为一种重要的保健药品,具有抗衰老、抗不育、提高免疫力和预防心血管疾病等重要作用[15]。由于维生素E具有易氧化、表面活性差等缺点,目前的研究热点主要集中在其酚羟基的改性上[16]。作为市场上最主要的维生素E衍生物产品,维生素E醋酸酯可用化学催化剂(三乙胺、HCl/ZnCl2等)催化D-α-生育酚与醋酸酐反应得到[17~19],但存在副产物多、污染环境、底物选择性差和产物转化率低等缺陷。而生物酶法具有反应条件温和、高效、专一和清洁生产等优点,随着人们对食品安全和绿色食品的意识和要求不断提高,开发生物酶法催化合成维生素E醋酸酯具有重要的研究意义和应用价值。
本研究结合启动子和分泌信号肽改造实现皱褶假丝酵母脂肪酶CRL1在毕赤酵母的高效表达。在蛋白纯化的基础上,进一步测定了重组CRL1的酶学性质;并建立无溶剂体系中重组CRL1催化合成维生素E醋酸酯的方法,为维生素E醋酸酯的高效合成及应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 基因、菌株和质粒
根据CRL1的蛋白序列(UniProt KB-P20261),使用OptimumGeneTM对密码子偏好性进行优化,并将其中19个非通用丝氨酸密码子CTG转化为通用丝氨酸密码子TCT,委托上海捷瑞生物工程有限公司合成。
大肠杆菌菌株Escherichia coli Top10和毕赤酵母菌株 P. pastoris GS115购自 Invitrogen公司。质粒pHKA和pHKA-AOXm/αm均由本实验室构建并保存[20]。
1.1.2 试剂与培养基
KOD酶购自TOYOBO公司;T4DNA连接酶、DNA Marker和限制性内切酶均购自Takara公司;质粒提取试剂盒和PCR产物纯化试剂盒购自Magen公司;Bradford蛋白浓度测定试剂盒购自捷瑞生物工程有限公司;对硝基苯酚丁酯(pNPB)购自Sigma公司;酵母抽提物购自Oxford公司;酵母氮源YNB和蛋白胨购自Difco公司;87.25% D-α-生育酚购自江苏玺鑫维生素有限公司;95.50% D-α-生育酚和96.00% D-α-生育酚醋酯购自Sigma公司;无水乙醇(色谱纯)购自天津科密欧化学试剂有限公司;其他试剂均为国产分析纯。
LB培养基(1 L):5.0 g酵母抽提物,10.0 g蛋白胨,10.0 g氯化钠;YPD培养基(1 L):10.0 g酵母抽提物,20.0 g蛋白胨,20.0 g葡萄糖;BMGY培养基(1 L):10.0 g酵母抽提物,20.0 g蛋白胨,13.4 g YNB,100 mL PBS (100 mmol/L,pH 6.0)缓冲液,10 mL甘油;BMMY培养基(1 L):10.0 g酵母抽提物,20.0 g蛋白胨,13.4 g YNB,100 mL PBS (100 mmol/L,pH 6.0)缓冲液,10 mL甲醇;MD筛选平板(1 L):13.4 g YNB,20.0 g葡萄糖,20.0 g琼脂;三丁酸甘油酯乳化平板(1 L):5.0 g硫酸铵,3.0 g酵母抽提物,20.0 g琼脂,1.0 g PVA,2.0×10-4g生物素,5 mL三丁酸甘油酯,5 mL甲醇,100 mL PBS (100 mmol/L,pH 6.0)缓冲液。
1.1.3 仪器与设备
PCR仪,德国Eppendorf公司;NanoDrop 1000超微量核酸蛋白测定仪,美国 Thermo公司;5804R型高速冷冻台式离心机,德国Eppendorf公司;万分之一分析天平,德国Satorius公司;ZWYR-D2402型恒温培养摇床,上海智城分析仪器制造有限公司;AKTA蛋白纯化系统,美国GE公司;UV-2350型分光光度计,美国UNICO公司;多功能酶标仪,美国Thermo公司;KS 4000 i control型恒温反应摇床,德国IKA公司;7820A型气相色谱仪,美国Agilent公司。
1.2 方法
1.2.1 重组菌株构建和发酵
以EcoR Ⅰ和Not Ⅰ分别为上、下游酶切位点,设计并合成引物(上游引物为 CRL1-F:CCGGAATTCCATCATCATCATCATCATGCTCCAAC TGCTACTTTGGC;下游引物为 CRL1-S:ATTTGCGGCCGCTTAAACGAAAAAGGAT GGTGGGT);以质粒pGH-CRL1为模板,PCR扩增CRL1基因序列。CRL1基因和质粒载体 pHKA或pHKA-AOX1m/αm(AOX1启动子的改造参照 Hartner等[21]的方法,在原AOX1启动子的基础上引入一个顺式作用原件;α分泌信号肽的改造参照Kjeldsen等[22]的方法,在原α分泌信号肽和多克隆位点之间引入一段10个氨基酸长度的间隔肽)分别进行双酶切,产物纯化回收后采用T4DNA连接酶进行连接。连接产物用CaCl2转化法转入E. coli Top10感受态,涂布于含5 mg/mL卡那霉素的LB平板,37 ℃过夜培养。挑取阳性转化子过夜培养后提取质粒,进行双酶切鉴定并送样至上海生工生物工程有限公司进行测序。
重组质粒 pHKA-CRL1或 pHKA-AOX1m/αm-CRL1经Sal Ⅰ线性化后,电击转入P. pastoris GS115感受态中,涂布MD筛选平板,30 ℃培养72 h。挑取经菌落 PCR鉴定正确的阳性转化子至三丁酸甘油酯乳化平板,30 ℃培养大约48 h。挑取产生水解圈直径较大的单菌落至 YPD培养基进行活化,然后接种BMGY培养基,30 ℃、250 r/min培养16~24 h至OD600为2.0~6.0。离心收集菌体,转接BMMY培养基,控制起始OD600为1.0,30 ℃、250 r/min摇瓶培养120 h。发酵期间每隔24 h添加1%(V/V)甲醇,诱导重组菌株产酶,同时取样测定重组菌株生长曲线和发酵液中脂肪酶活力。
1.2.2 脂肪酶水解活力测定
采用对硝基苯酚法测定脂肪酶水解活力[23]。发酵液样品经14,000 r/min离心5 min,弃菌体。取50 μL适当稀释后的酶液,加入到装有900 μL Tris-HCl (50 mmol/L,pH 8.0)缓冲液的2 mL离心管中,对照组为950 μL缓冲液,置于恒温震荡混匀仪45 ℃、800 r/min预热5 min。快速加入50 μL对硝基苯酚丁酯乳化液,相同条件下反应5 min。反应结束后14,000 r/min离心1 min,取200 μL上清液于96孔板中,用酶标仪在405 nm波长下测定吸光度值,每组设3个平行。一个酶活力单位定义为每分钟水解生成 1 μmol对硝基苯酚所需要的酶量。
1.2.3 酶蛋白纯化
发酵结束后,发酵液于4 ℃、14,000 r/min离心10 min,取上清液经10,000 MWCO PES膜包超滤浓缩,浓缩液通过35%和85%饱和硫酸铵分段盐析处理。蛋白沉淀复溶后用Buffer A (20 mmol/L Tris-HCl,pH 8.0)缓冲液平衡的Sephadex G-25S柱进行脱盐操作,见峰收集。收集液再经过Capto DEAE阴离子交换层析柱处理,Buffer B(在 Buffer A的条件下加入 500 mmol/L NaCl)溶液进行梯度洗脱,收获纯化后的酶蛋白溶液。
采用Bradford法测定蛋白浓度,以小牛血清蛋白为标准蛋白。SDS-PAGE检测纯化效果。
1.2.4 酶学性质测定
最适温度及温度稳定性:在 pH 8.0条件下,25 ℃~60 ℃温度范围内测定酶活力,确定酶的最适温度;酶液分别在40 ℃、50 ℃和60 ℃条件下水浴保温,1 h、2 h、3 h、4 h、5 h和6 h取样测定酶活力,考察酶的温度稳定性。
最适 pH及 pH稳定性:在 45 ℃条件下,pH 6.0~10.0温度范围内测定酶活力,确定酶的最适pH;酶液分别在pH 6.5、pH 7.0和pH 8.0条件下于45 ℃水浴保温,1 h、2 h、3 h、4 h、5 h和6 h取样测定酶活力,考察酶的pH稳定性。
1.2.5 CRL1催化剂制备
离心收集发酵上清液,于-80 ℃冰箱冻结6 h,再于0.37 Pa、-50 ℃条件下冷冻干燥18 h,收获CRL1冻干酶粉,于4 ℃冰箱保存。使用时在装有饱和MgCl2溶液的干燥器中平衡48 h后备用。
1.2.6 CRL1催化合成维生素E醋酸酯
称取200 mg D-α-生育酚底物于10 mL具塞反应瓶中,加入2 mL乙酸酐作为酰基供体,置于恒温振荡反应器于40 ℃、200 r/min条件下预热5 min,加入75 mg CRL1催化剂进行催化反应。反应结束后,样品经14,000 r/min离心5 min,取上清用无水乙醇适当稀释后进行气相检测。
1.2.7 气相色谱检测分析
色谱柱:J&W DB-17HT石英毛细管柱(30 m×0.32 mm,0.15 μm);升温程序:100 ℃保持 1 min,以15 ℃/min升至280 ℃并保持1 min,再以5 ℃/min升至290 ℃并保持1 min;进样口温度280 ℃,检测器(氢离子火焰检测器)温度 300 ℃,载气(N2)流速 20 mL/min,分流比 40:1,进样体积 1 μL。
以95.50% D-α-生育酚为标准品建立质量浓度-峰面积标准曲线。采用外标法对反应体系中D-α-生育酚含量进行定量分析。转化率计算见公式(1)。
1.2.8 数据统计分析
以上实验均设置三个平行组,实验数据采用EXCEL软件进行统计分析,结果以平均值±标准差表示。
2 结果与讨论
2.1 重组菌株的构建和平板筛选

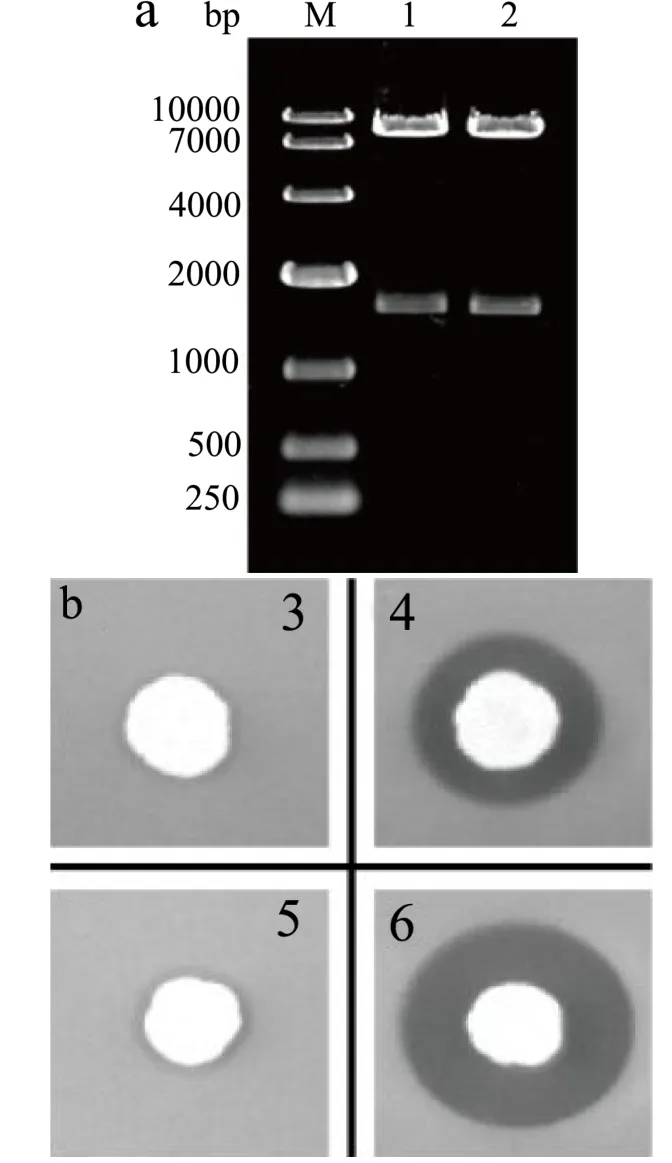
图1 重组质粒双酶切鉴定(a);重组菌株三丁酸甘油酯平板筛选(b,36 h)Fig.1 Identification of recombinant plasmid (a) and screening of recombinant strains on tributyrin agar plate(b)
以质粒pGH-CRL1为模板,PCR扩增得到长度为1600 bp左右的CRL1基因片段,经限制性内切酶切割后插入到质粒载体pHKA(或pHKA-AOX1m/αm),然后连接产物转化E.coli Top10进行复制扩增,构建重组质粒 pHKA-CRL1(或 pHKA-AOX1m/αm-CRL1)。重组质粒经EcoR Ⅰ和Not Ⅰ双酶切鉴定,在1600 bp左右和7800 bp左右出现两条条带,分别与目的基因和质粒载体大小相符(图1a)。同时,重组质粒测序结果与目的基因序列完全一致,表明重组质粒构建成功。
重组质粒线性化处理后电转P. pastoris GS115,从MD筛选平板上挑选转化子,使用5’AOX1上游通用引物和CRL1基因下游引物进行菌落PCR鉴定,阳性转化子条带大小为1800 bp左右。
挑取阳性转化子至三丁酸甘油酯乳化平板进行初筛(图1b),其中产生水解圈较早、直径较大的单菌落可能具有较高的脂肪酶水解活力,从中选取3~5个单菌落进行摇瓶发酵复筛。
2.2 重组CRL1的表达和纯化
2.2.1 重组CRL1的表达
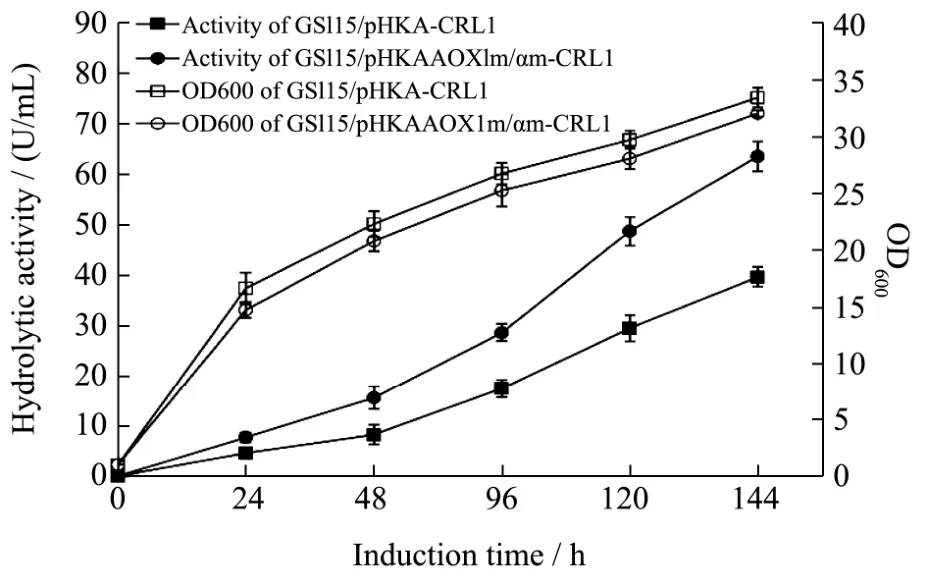
图2 CRL1重组菌株摇瓶发酵生长曲线和产酶特征曲线Fig.2 Curve of growth and lipase production of recombinant CRL1 strains in flask fermentation
重组菌株 GS115/pHKA-CRL1和 GS115/pHKAAOX1m/αm-CRL1的摇瓶发酵生长曲线和产酶特征曲线如图2所示。从图上看出,随着发酵的进行,两株重组菌株的菌体数量和脂肪酶活力都逐渐提高,并且在 120 h时分别达到最大值。重组菌株GS115/pHKA-CRL1在120 h时酶活力为39.73 U/mL,OD值为33.48。Li等[19]曾在毕赤酵母中分别对AOX1启动子和α信号肽进行改造,将AOX1启动子的-230至-190区域的顺式作用元件增加至二拷贝和删除-777至-712区域,在α信号肽和多克隆位点之间增加可被信号肽切割识别的 10个氨基酸(EEAEAEAEPK),改造后重组植酸酶的表达水平分别提高了 35%和12%。本研究采用了相同方法对AOX1启动子和α信号肽同时进行改造,改造后重组菌株GS115/pHKA-AOX1m/αm-CRL1的酶活力有明显提高,最高水解活力达到63.63 U/mL,相对提高60.18%。此外,改造对重组菌株菌体生长情况没有明显影响,OD600最高值为32.35,并且在整个过程中与重组菌株GS115/pHKA-CRL1的生长趋势保持一致,说明利用该组合策略对CRL1重组菌株的改造较为成功。
2.2.2 重组CRL1的纯化
重组菌株 GS115/pHKA-AOX1m/αm-CRL1摇瓶发酵120 h,离心收集粗酶液245 mL,酶活力为64.30 U/mL,然后按照方法1.2.3进行酶蛋白纯化。发酵液上清液首先经过10,000 MWCO PES膜包超滤浓缩,可去除分子量小于 10 ku的杂蛋白,得到浓缩液 64 mL,比酶活提高了1.06倍,酶活力回收率为72.84%。随后浓缩液通过 35%和 85%饱和硫酸铵分段盐析处理,进一步去除杂蛋白。蛋白复溶后利用AKTA蛋白纯化系统和Sephadex G-25S脱盐柱进行脱盐操作,收集液中色素明显减小,比酶活达到 604.76 U/mg。最后采用Capto DEAE阴离子交换层析柱对收集液进一步纯化,确定进样缓冲液最适pH为6.0,洗脱液分段洗脱梯度为150 mmol/L NaCl和200 mmol/L NaCl,在此条件下重组CRL1得到最佳效果。发酵液上清液经过超滤浓缩、硫酸铵沉淀及脱盐和阴离子交换层析三步纯化,收集液中重组 CRL1的比酶活达到 984.52 U/mg,纯化倍数5.41倍,酶活回收率33.81% (表1)。
将纯化过程中收集到的重组 CRL1样品进行SDS-PAGE检测,可以看到,粗酶液经过“超滤浓缩-硫酸铵沉淀后脱盐-阴离子交换层析”三步纯化后,杂蛋白逐步去除,在分子量60 ku附近得到单一的蛋白条带,与预期相符,为重组CRL1目的条带(图3)。

表1 重组CRL1的蛋白纯化Table 1 Purification of the recombinant CRL1

图3 不同纯化步骤后重组CRL1的SDS-PAGE电泳图Fig.3 SDS-PAGE patterns of recombinant CRL1 purified by different steps
2.3 重组CRL1的酶学性质
根据方法1.2.4测定了温度和pH对重组CRL1的影响。结果表明重组CRL1的最适温度为40 ℃,在35 ℃和45 ℃时分别保留了66.85%和73.51%的相对活力(图4a)。40 ℃、50 ℃和60 ℃时的半衰期分别为5 h、2 h和1 h左右,热稳定较差(图4b)。重组CRL1的最适pH为7.5,在pH值7.0~8.0范围内酶活力维持在73.93%以上(图4c)。在pH值6.5、7.0和8.0条件下经45 ℃水浴保温6 h,酶活力分别保留40.96%、26.35%和17.74%,在偏酸性环境中较为稳定(图4d)。以上测定结果与Chang等[8]报道的基本一致,对CRL1的催化应用具有指导意义。
2.4 CRL1催化合成维生素E醋酸酯
2.4.1 反应温度对维生素E醋酸酯合成的影响
温度是影响CRL1催化合成维生素E醋酸酯的主要影响因素,且主要影响反应初速度,而对最终反应平衡影响不大。在40 ℃、50 ℃和60 ℃条件下分别反应30 h、15 h和9 h,D-α-生育酚的转化率分别达到94.11%、95.58%和94.72%(图5)。随着反应的进行,底物转化逐渐趋于完全,反应36 h时40 ℃、50 ℃和60 ℃条件下的转化率分别为 94.97%、97.37%和97.53%。后续利用CRL1催化合成维生素E醋酸酯的最适反应温度选定在60 ℃。
2.4.2 摇床转速对维生素E醋酸酯合成的影响
摇床转速通过影响反应体系中的物质和能量传递而影响维生素E醋酸酯的合成效果,较低的转速不利于底物之间的充分接触,而过高的转速则会破坏底物分子之间的相互作用且浪费能量。

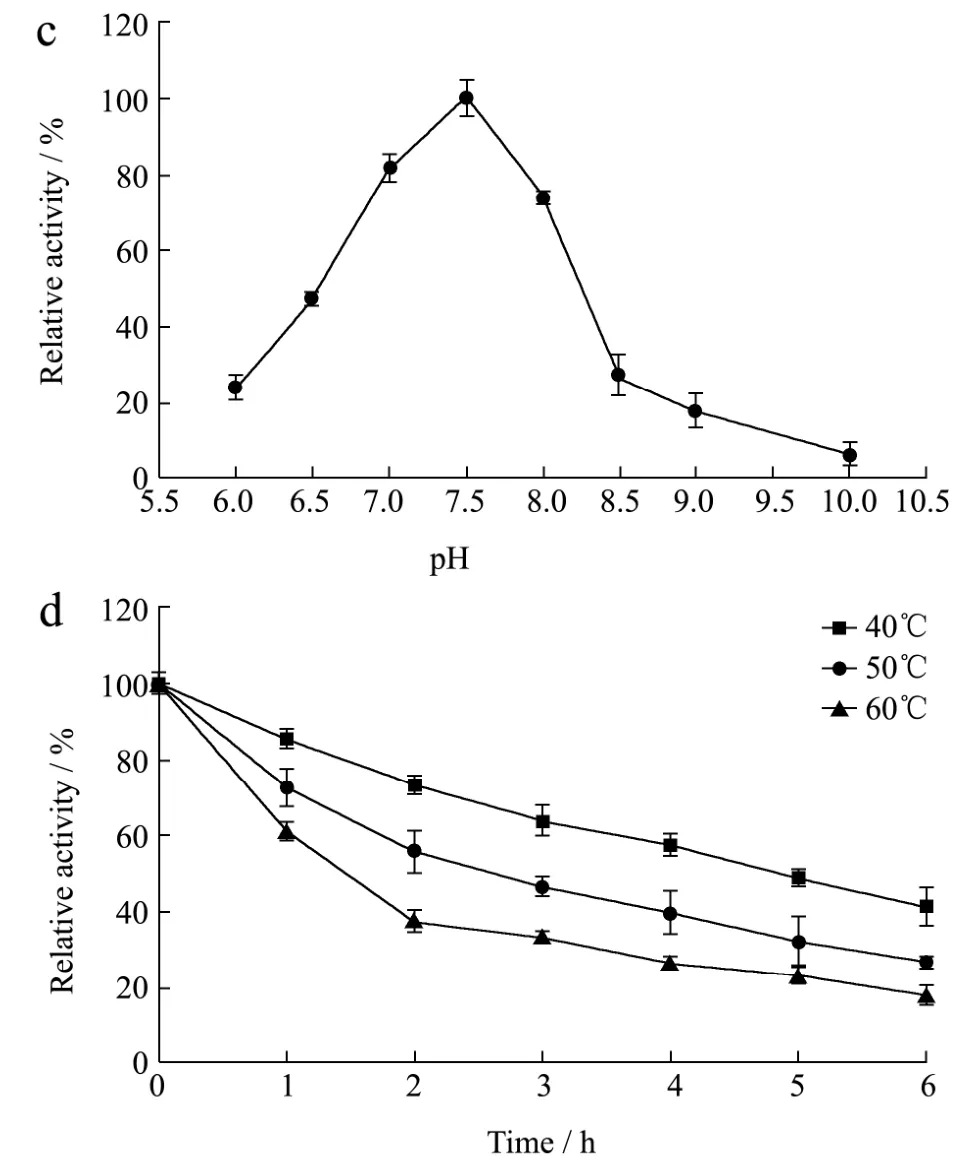
图4 重组CRL1酶学性质Fig.4 Temperature effects on the activity
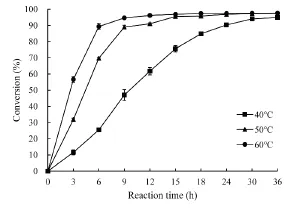
图5 反应温度对维生素E醋酸酯合成的影响Fig.5 Effect of reaction temperature on the synthesis of vitamin E acetate
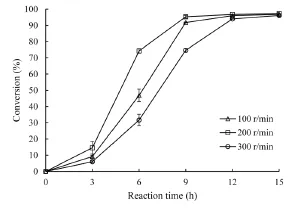
图6 摇床转速对维生素E醋酸酯合成的影响Fig.6 Effect of shaking speed on the synthesis of vitamin E acetate
转速主要影响反应初速度,在100 r/min、200 r/min和300 r/min条件下分别进行反应,反应在大约12 h、9 h和15 h时分别达到平衡且D-α-生育酚的转化率均为97.00%左右(图6)。后续利用CRL1催化合成维生素E醋酸酯的最适摇床转速为200 r/min,同时结合2.4.1实验结果,将最适反应时间确定为9 h。
2.4.3 底物浓度对维生素E醋酸酯合成的影响
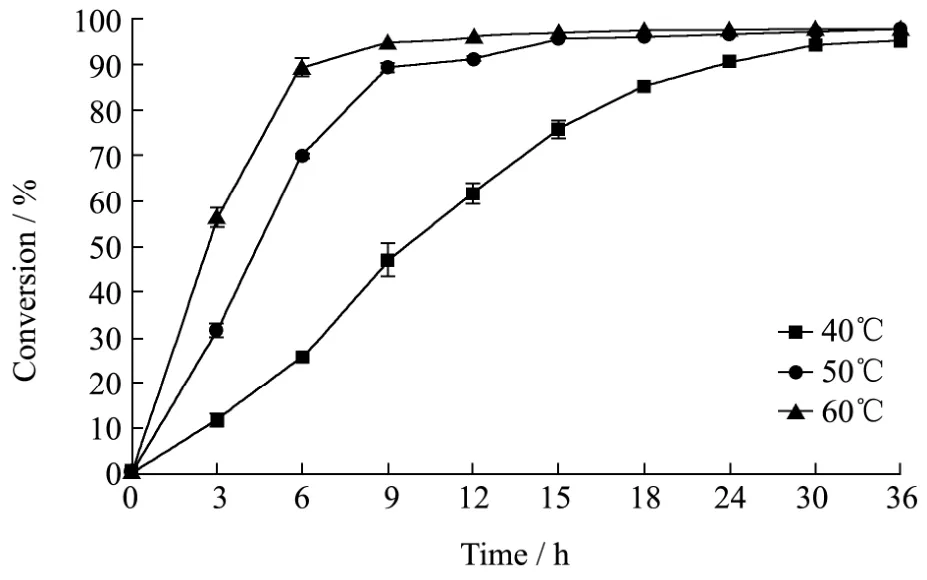
图7 底物浓度对维生素E醋酸酯合成的影响Fig.7 Effect of substrate concentration on the synthesis of vitamin E acetate
控制D-α-生育酚含量一定,改变反应体系中乙酸酐的添加量,考察了底物浓度对维生素E醋酸酯合成的影响。反应温度60 ℃,反应时间9 h。从结果中可以看到,随着乙酸酐添加量的增加,D-α-生育酚的转化率不断提高,在乙酸酐添加量为1 mL时转化率达到最大;之后继续增加乙酸酐含量对D-α-生育酚的转化率的提高没有明显影响,猜测可能是因为反应体系中酶与底物分子的结合达到了饱和状态(图7)。CRL1催化合成维生素E醋酸酯的最适底物浓度为1 mL乙酸酐/200 mg D-α-生育酚。
2.4.4 脂肪酶添加量对维生素E醋酸酯合成的影响
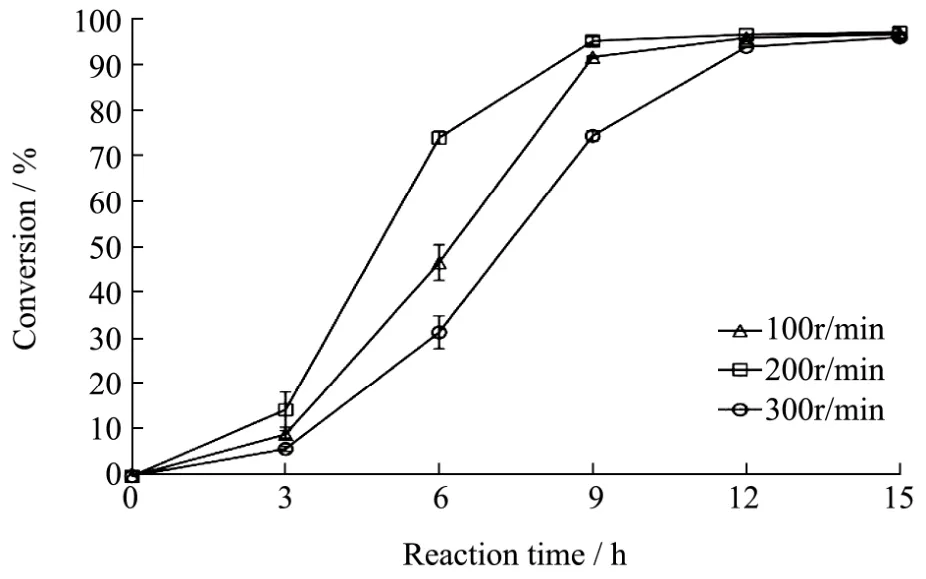
图8 脂肪酶添加量对维生素E醋酸酯合成的影响Fig.8 Effect of lipase dosage on the synthesis of Vitamin E acetate
接下来,考察了脂肪酶添加量对维生素E醋酸酯合成的影响。反应条件为:200 mg D-α-生育酚、1 mL乙酸酐、反应温度60 ℃,反应时间9 h。随着CRL1添加量从25 mg逐渐增加到100 mg,D-α-生育酚的转化率从 57.42%逐渐提高到 97.62%;之后继续增加CRL1添加量,D-α-生育酚的转化率维持在97.00%左右,可能是因为该条件下处于活跃状态的底物分子已经被过量的酶结合完全(图8)。CRL1催化合成维生素E醋酸酯的最适脂肪酶添加量为100 mg。
截至目前,关于酶法合成维生素E醋酸酯的研究较少。Torres等[15]以Novozym 435为催化剂,在叔戊醇溶剂中催化 D-α-生育酚和乙酸乙烯酯转酯反应生成维生素E醋酸酯,连续反应18 d,转化率只有65%。龚等[24]以实验室自制固定化假丝酵母脂肪酶为催化剂,在石油醚溶剂中催化D-α-生育酚和乙酸乙烯酯转酯反应生成维生素E醋酸酯,转化率达到95%,但是反应时间需要72 h,难以满足工业化生产条件。本研究通过对无溶剂体系中重组CRL1催化合成维生素E醋酸酯的主要影响因素进行逐步优化,确定最适反应条件为:200 mg D-α-生育酚、1 mL乙酸酐、100 mg CRL1、反应温度60 ℃、转速200 r/min、反应时间9 h,D-α-生育酚的转化率可达到97.00%以上,具有良好的工业化应用前景。
3 结论
皱褶假丝酵母脂肪酶在工业生产中具有广泛的应用。本研究系统研究了皱褶假丝酵母脂肪酶CRL1在毕赤酵母中的表达、纯化、酶学性质以及催化应用。通过对AOX1启动子和α分泌信号肽同时进行改造,CRL1在毕赤酵母中的表达水平由39.73 U/mL提高到63.63 U/mL,相对提高60.18%。建立了超滤浓缩、硫酸铵沉淀后脱盐和阴离子交换层析三步法纯化重组CRL1的方法,纯化后 CRL1的比酶活达到 984.52 U/mg。重组CRL1的最适温度和最适pH分别为45 ℃和7.5,经45 ℃保温6 h仍保留52.99%的相对活力,在偏酸性环境中较为稳定。以重组CRL1为催化剂,建立并优化了在无溶剂体系中高效合成维生素E醋酸酯的绿色方法,最适反应条件为:200 mg D-α-生育酚、1 mL乙酸酐、100 mg CRL1、反应温度60 ℃、转速200 r/min、反应时间9 h,D-α-生育酚的转化率可达到97.00%以上,具有良好的工业化应用前景。
