酶处理促进龙眼果汁中蔗糖的转化和低聚果糖的生成
2018-11-06程永霞魏新雨蓝海波王凯赵雷胡卓炎
程永霞,魏新雨,蓝海波,王凯,赵雷,胡卓炎
(华南农业大学食品学院,广东广州510642)
龙眼(Dimocarpus longan Lour.)在中国有着悠久的种植和食用历史,原产于中国南方[1],在广东、福建、广西、海南等省份及台湾地区均有着广泛种植[2]。龙眼凭借其美好的风味和丰富的营养价值,自古以来就被视为药食两用的滋补佳品[3]。龙眼果肉含糖量高,主要包括蔗糖、葡萄糖和果糖,其中蔗糖含量最高,占总糖的60%~70%。同时龙眼果肉富含多糖[4,5]、多酚[6]、γ-氨基丁酸[7]及人体需要的矿物质和微量元素[8,9],现代药理研究表明龙眼果肉的这些营养成分具有抗氧化[10]、抗癌[11]、增强免疫力[12]和保护关节[13]的功效。传统龙眼加工产品主要有龙眼干(桂圆肉)、龙眼浓缩汁(龙眼膏)等产品。龙眼膏一般采用龙眼果汁加热浓缩加工而成。龙眼果汁浓缩后蔗糖含量进一步提高。随着人们饮食观念的改变,高糖食品因易引发肥胖,II型糖尿病和心血管疾病[14],而不能满足现代消费者追求低糖(低热量)的健康饮食需求。利用果糖基转移酶将蔗糖转换成为低聚果糖已有不少报道。低聚果糖是一种优质的益生元,其性质稳定,不被胃肠道内源酶消化[15],具备调节肠道菌群平衡[16]、预防结肠癌[15]、改善脂质代谢[17]、促进矿物质吸收[18]、增强免疫力[19]等生理功能。低聚果糖(FOS)可以由蔗糖经果糖基转移酶处理后制得,是由1~3个果糖基通过β-(2-1)糖苷键与蔗糖中的果糖基结合生成的蔗果三糖(GF2)、蔗果四糖(GF3)和蔗果五糖(GF4)的混合物[20]。目前已有研究探讨用低聚果糖代替蔗糖制备功能性饮料的报道[21~23],也有通过发酵或发酵产酶的方法除去果汁中的蔗糖制备低热量原果汁的研究[14,24,25]。在果汁加工中采用酶处理一般是以提高出汁率或制备澄清果汁为目的,但利用酶法转化果汁中蔗糖同时生成低聚果糖的研究尚鲜见报道。基于龙眼果汁蔗糖含量高的特点,利用果糖基转移酶的作用,探讨不同酶处理时间、酶用量、温度、底物浓度和pH等工艺参数对蔗糖的转化和低聚果糖含量变化的影响,旨在为开发低热量和富含低聚果糖的龙眼果汁的研究及实际生产提供参考。
1 材料与方法
1.1 材料与试剂
龙眼(Dimocarpus longan Lour.)为“储良”品种,产于广东茂名高州,于2016年8月成熟采摘;果糖基转移酶(1824 U/mL),诺维信公司;柠檬酸(化学纯),国药集团化学试剂有限公司;柠檬酸钠(化学纯),国药集团化学试剂有限公司;乙醇(分析纯),天津市富宇精细化工有限公司;糖标准物:果糖、葡萄糖、蔗糖、蔗果三糖(GF2)、蔗果四糖(GF3)、果五糖(GF4),Sigma试剂公司;乙腈(色谱纯),默克试剂公司。
1.2 仪器与设备
WZ103糖度计,上海天呈科技有限公司;FE320 pH计,上海梅特勒—托利多有限公司;JYL-C16D九阳打浆机,九阳股份有限公司;TD5-Ⅱ低速离心机,长沙平凡仪器仪表有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;AUW120电子分析天平,日本岛津公司;SHA-CA晶波水浴恒温振荡器,常州普天仪器制造有限公司;HWS24型电热恒温水浴锅,上海一恒科学仪器有限公司;KQ5200DE数控超声波清洗器,昆山超声仪器有限公司;5430-eppendorf高速离心机,德国eppendorf公司;移液器,德国eppendorf公司;海尔BCD-256KF型冰箱,青岛海尔股份有限公司;LC-20AT高效液相色谱仪(配示差检测器RID),日本岛津公司;NH2P-50 4E色谱柱,日本昭和电工公司。
1.3 试验方法
1.3.1 果糖基转移酶酶活的测定
参照Vega-Paulino等人[26]的方法,用0.1 mol/L pH 5.5柠檬酸-柠檬酸钠缓冲液将10 g蔗糖溶解并定容至100 mL,取20 mL蔗糖溶液,加入适量的酶,置于三角瓶中,于55 ℃,转速150 r/min的恒温回旋式摇床中反应60 min,取出于95 ℃,30 s灭酶处理,冷却至室温,于10000 r/min台式离心机离心20 min,取上清液过0.45 μm微孔滤膜过滤,用高效液相色谱仪法(HPLC)分析GF2含量,并计算酶活。酶活力单位定义:在上述酶反应条件下,将蔗糖转化成低聚果糖,每分钟产生1 µmol蔗果三糖所需酶量为一个酶活力单位(U)[27]。
1.3.2 制备低聚果糖龙眼果汁工艺流程
龙眼→去皮、去核→打浆榨汁→过滤→浓缩→酶转化处理→加热钝化酶活性→冷却→样品
选择无病虫害和机械损伤的龙眼,人工去皮去核后榨汁,过滤(过100目滤布),得龙眼原果汁,测定原汁总可溶性固形物含量(TSS)为20oBrix,pH 6.8;根据试验设计,加蒸馏水将原汁稀释至TSS 10oBrix,或在60 ℃下真空浓缩至TSS 30、40、50和60oBrix,用柠檬酸调pH,随后加入果糖基转移酶进行酶转化,酶转化结束后立即进行95 ℃,30 s杀菌钝化酶活性处理,冷却,包装,冷藏待分析。
1.3.3 酶转化工艺参数的影响试验
分别以底物浓度(TSS)、pH、酶添加量(U/g蔗糖)、温度和转化作用时间对龙眼果汁中蔗糖含量、蔗糖转化率、低聚果糖生成量和低聚果糖占果汁中总糖的比例的影响进行单因素试验。
底物TSS的影响:TSS分别取10、20、30、40、50和60oBrix,其他因素取值:酶添加量9 U/g、底物pH 6.0、温度55 ℃下反应时间5 h。
pH的影响:用柠檬酸调不同的pH值,分别为4.0、5.0、6.0、7.0、8.0,其他因素取值:酶添加量9 U/g、底物TSS 30oBrix、55 ℃下转化反应5 h。
酶添加量的影响:根据底物中蔗糖的质量设置不同的酶添加量(即每克蔗糖对应的酶活力单位U:0.6、1.2、2.4、6.0、9.0和12.0 U/g),其他因素取值:pH 6.0、温度55 ℃、底物TSS 30oBrix、反应时间5 h。
因此,为保证新旧道床联结可靠,在预制的新短轨枕底部设预埋钢筋钩,以加强短轨枕与道床之间的联结。同时,浇筑强度等级不低于原道床强度的砂浆,该砂浆具有快凝、早强的性能。另外,在施工过程中,采用“解体无缝线路,拆除既有轨枕及套靴、原位换铺扣件及轨枕、灌注砂浆”的施工方法对轨道进行改造施工,以“隔三换一”的原则进行短轨枕更换,同时在轨道改造期间应限速,并且协调配合多专业,多重把控安全质量,以确保改造施工的安全和质量。
温度的影响:设置不同的作用温度35、45、55、65和75 ℃,其他因素取值:酶添加量9 U/g、底物TSS 30oBrix、底物pH 6.0、反应时间5 h。
时间的影响:设置不同的转化作用时间0、1、3、5、7、9 h,其他因素取值:酶添加量9 U/g、底物TSS 30oBrix,pH 6.0、温度55 ℃。
1.4 果汁中的糖分的分析方法
参照胡志群等[28]人的测定方法,采用高效液相色谱仪测定果汁中蔗糖、葡萄糖、果糖、低聚果糖等糖分组成及各组分含量,具体参数条件如下:
高效液相色谱分析条件:选用岛津LC-20AT高效液相色谱仪,配有RID示差检测器,色谱柱为NH2P-50 4E氨基柱(4.6 mm×250 mm),流动相为乙腈(V):水(V)=70:30,流速为1 mL/min,柱温30 ℃,进样量10 µL。标准曲线:配制系列溶度的蔗糖、葡萄糖、果糖、GF2、GF3、GF4标准溶液,通过液相色谱分析测定,制定标准物浓度与峰面积关系的标准曲线。
样品处理:准确移取龙眼果汁样品6 mL于100 mL容量瓶中,加入80%(体积比)的乙醇80 mL,在超声波振荡器中处理30 min,3500 r/min离心40 min,收集上清液,沉淀重复用同量的乙醇及超声波处理1~2次,离心收集上清液。合并上清液,真空旋转蒸发至乙醇和水分将近全干,然后用蒸馏水定容至25 mL的容量瓶中,4 ℃冰箱中放置过夜,离心取上清液,用0.45 μm微孔滤膜过滤,滤液供分析用。
蔗糖转化率(%)=(酶处理前果汁蔗糖含量-酶处理后果汁蔗糖含量)/酶处理前果汁蔗糖含量×100%。
低聚果糖(FOS)含量=蔗果三糖(GF2)+蔗果四糖(GF3)+蔗果五糖(GF4),单位为mg/mL。
低聚果糖(FOS)比例(%)=低聚果糖含量/总糖含量×100%。
总糖含量=蔗糖含量+葡萄糖含量+果糖含量+低聚果糖含量,单位:mg/mL。
1.5 数据处理
采用SPSS16.0和Excel 2010软件进行数据分析和作图,组间均值比较用单因素方差分析(One-Way ANOVA)和Tukey’s两两比较分析,结果用平均值±标准差表示,平均显著水平为p<0.05。
2 结果与讨论
2.1 底物TSS对酶转化龙眼果汁中产物的影响
在酶添加量9 U/g、pH 6.0、温度55 ℃下反应时间5 h,设置不同的底物TSS(10、20、30、40、50和60
oBrix),探讨底物TSS不同对龙眼果汁中蔗糖的转化和生成低聚果糖产量的影响,结果如图1。由图可知,随着底物浓度的提高,经过酶的作用转化了部分蔗糖,生成低聚果糖的量会显著增加(p<0.05)。底物浓度从40oBrix提高到60oBrix,虽然低聚果糖含量也明显增加,但果汁中的蔗糖含量因浓缩的原因随浓缩倍数的增加而增加,同时蔗糖的转化率显著降低(p<0.05),低聚果糖占果汁中的总糖比例并没有提高。因此,考虑到实际操作,龙眼果汁的底物TSS选择在30~40
oBrix为较适合。
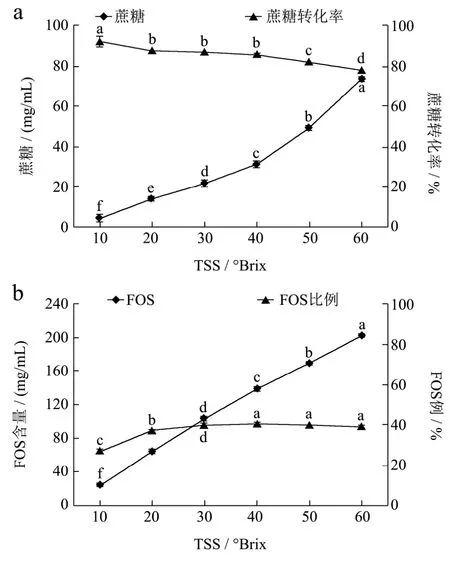
图1 底物TSS对龙眼果汁中蔗糖转化(a)和FOS产量(b)的影响Fig.1 Influence of TSS on sucrose conversion and FOS production in longan juice
2.2 pH对酶转化龙眼果汁中产物的影响
在酶添加量9 U/g、底物TSS 30oBrix、55 ℃下转化反应5 h,设置pH 4.0、5.0、6.0、7.0、8.0,探讨不同pH值对龙眼果汁中蔗糖的转化和低聚果糖产量的影响。结果如图2所示。在pH 5.0~6.0范围,蔗糖含量明显减少,转化率达最大值,在pH 5.0~7.0范围内,低聚果糖的产量及其占总糖比例达最大值,呈现先上升后下降的趋势,在pH<5.0和pH>7.0的范围,蔗糖转化率、低聚果糖含量及其占总糖的比例显著降低(p<0.05)。据参考文献[29]报道果糖的转移酶的最适pH是5.5~6.5,当pH>7.0之后果糖基转移酶的活性受到抑制,蔗糖转化率明显降低,底物中蔗糖含量较高。考虑龙眼果汁自身的pH和果糖基转移酶的酶学特性,选择pH 6.0较适合。

图2 不同pH对龙眼果汁中蔗糖的转化(a)和FOS产量(b)的影响Fig.2 Influence of pH on sucrose conversion and FOS production in longan juice
2.3 酶添加量对酶转化果汁中产物的影响
以果汁中蔗糖的含量为基准,根据果汁中蔗糖的质量设置不同的酶添加量(即每克蔗糖对应的酶活力单位U:0.6、1.2、2.4、6.0、9.0和12.0 U/g),在pH 6.0、温度55 ℃、底物TSS 30oBrix、反应时间5 h下,研究酶添加量对龙眼果汁中蔗糖的转化和低聚果糖产量的影响,结果见图3。
如图3中所示随着酶添加量的增加,果汁中蔗糖含量显著降低(p<0.05),同时低聚果糖的产量会迅速增加,在添加量为9~12 U/g时,蔗糖转化率、低聚果糖含量及其占总糖的比例达到最大值。根据酶促反应作用,当底物浓度大大超过酶浓度时,酶的反应速度与酶浓度呈正比,但当底物与酶的活力中心结合饱和后,反应速度就不再增加[30]。因此在酶添加量较少时随着酶添加量的增加,低聚果糖生成量会迅速增加,但酶添加量在9 U/g以上时,蔗糖转化率和低聚果糖生成量已没有显著增加。因此,酶的添加量范围在9~12 U/g为佳。
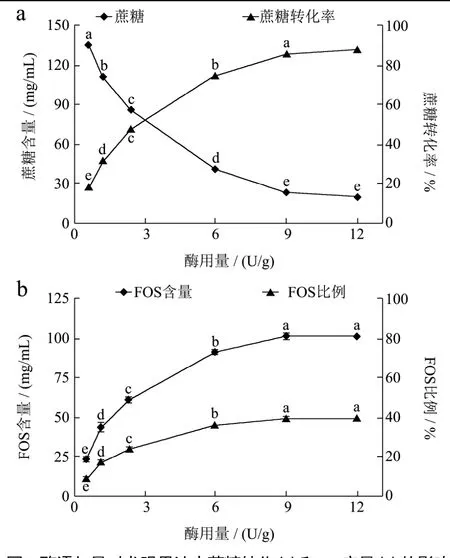
图3 酶添加量对龙眼果汁中蔗糖转化(a)和FOS产量(b)的影响Fig.3 Influence of enzyme concentration on sucrose conversion and FOS production in longan juice
2.4 温度对酶转化果汁中产物的影响
在酶添加量9 U/g、底物TSS 30oBrix、pH 6.0、反应时间5 h下,设置不同的温度(35、45、55、65和75 ℃),探讨不同的温度对龙眼果汁中蔗糖的转化和低聚果糖产量的影响,结果见图4。由图4可知,随着反应温度从35 ℃升高至55 ℃,果汁中蔗糖显著减少,转化率显著提高,低聚果糖的含量及其比例显著增加达到最大值。当温度从65 ℃提高至75 ℃时,蔗糖的转化明显受到抑制,低聚果糖的含量及其比例也显著下降。这说明果糖基转移酶在45~65 ℃的温度范围内热稳定性良好,但在75 ℃的条件下活性明显受到抑制。不同来源的果糖基转移酶热稳定性及最适温度会有所不同。
余轩等[31]研究米曲霉来源的果糖基转移酶发现其最适温度范围是20~50 ℃,当温度高于70℃时酶活基本全部丧失,李慧娟等[32]研究了耶氏酵母细胞来源的果糖基转移酶发现其热稳定温度范围是45~55℃,且最适温度是45℃。王一恬等[33]将黑曲霉YZ59果糖基转移酶的基因表达到酿酒酵母细胞上,生产出的果糖基转移酶最适反应温度为55 ℃。本研究所用果糖基转移酶来源于棘孢曲霉菌株发酵,与上述研究相比其具有更广泛的热稳定范围。综上所述,酶转化温度选择为55 ℃较合适。
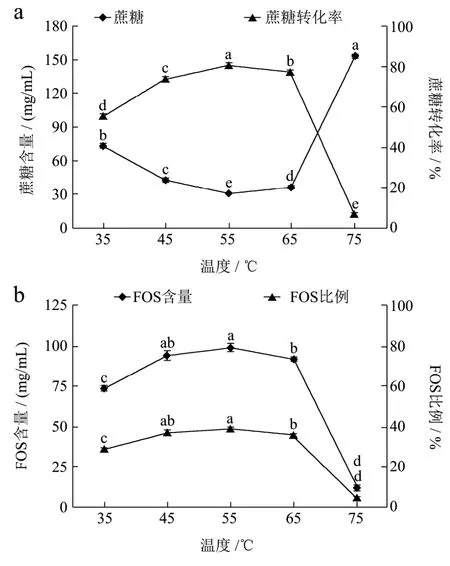
图4 不同温度对龙眼果汁中蔗糖转化(a)和FOS产量(b)的影响Fig.4 Influence of temperature on sucrose conversion and FOS production in longan juice
2.5 反应时间对酶转化果汁中产物的影响
在酶添加量9 U/g、底物TSS 30oBrix,pH 6.0、温度55 ℃下,设置不同的转化反应时间下(0、1、3、5、7、9 h),探讨反应时间对龙眼果汁中蔗糖的转化和生成低聚果糖产量的影响,结果见图5。在反应初期至5 h,随着反应时间的延长果汁中的蔗糖含量显著降低,蔗糖转化率迅速提高,显著生成低聚果糖(p<0.05)。反应至7 h后,随时间的增加,蔗糖含量和蔗糖转化率变化不显著,低聚果糖含量及其比例趋于稳定。酶处理时间选择5~9 h较合适。
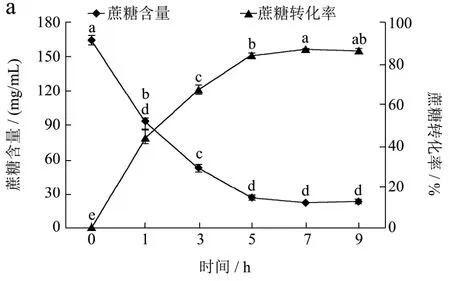
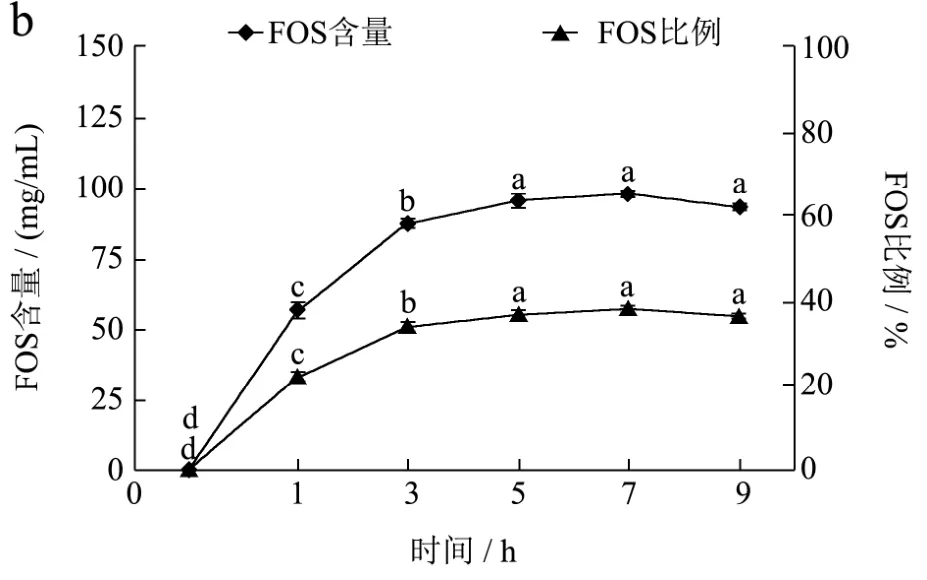
图5 酶处理时间对龙眼果汁中蔗糖转化(a)和FOS产量(b)的影响Fig.5 Influence of reaction time on sucrose conversion and FOS production in longan juice
2.6 酶处理对果汁中糖组分的影响
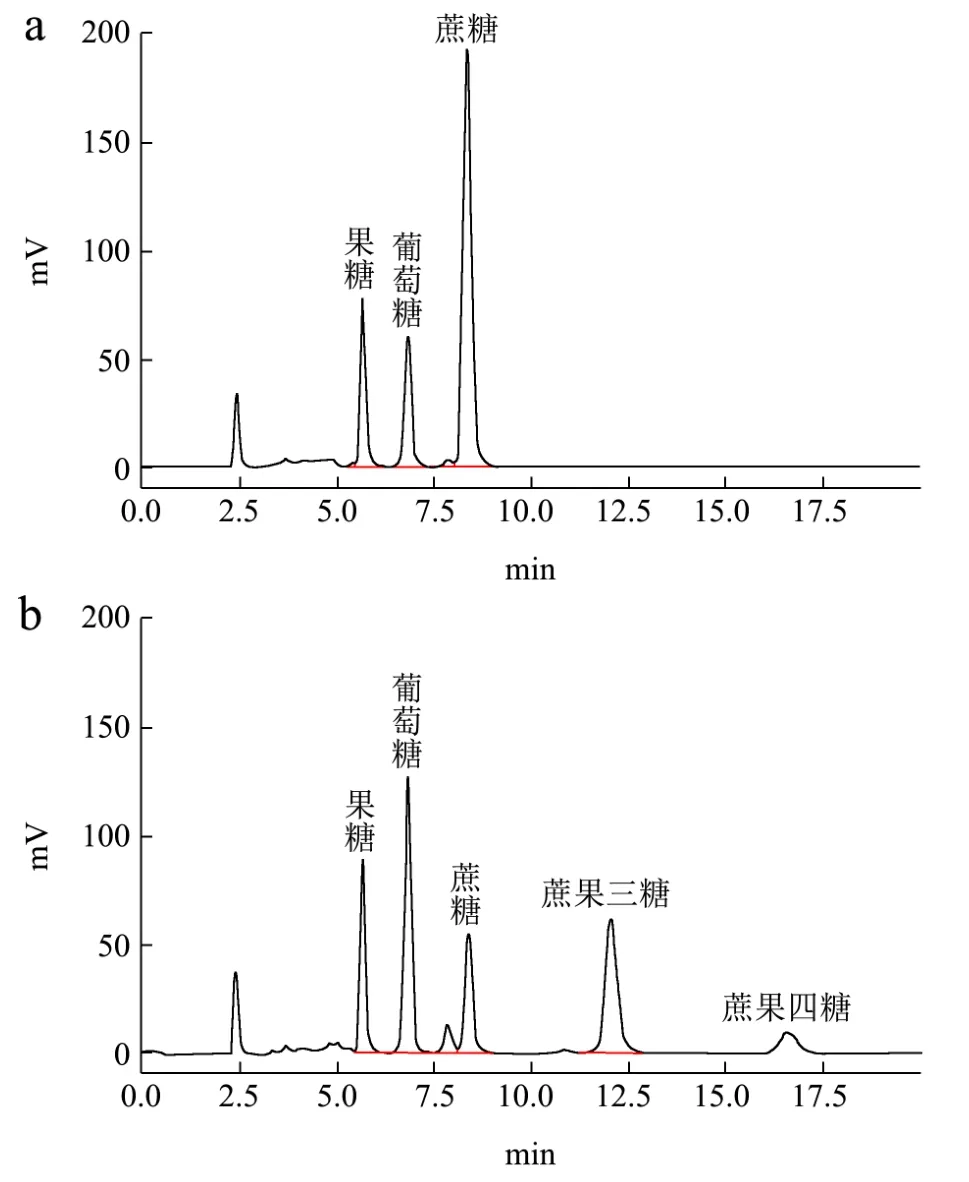
图6 酶转化前后龙眼果汁中单糖、蔗糖及低聚糖组成的液相色谱图Fig.6 The liquid chromatogram of monosaccharides, sucrose and oligosaccharides in longan juice before and after enzymatic treatment
基于单因素实验结果,选取底物总可溶性固形物为30oBrix龙眼果汁,酶添加量9 U/g,pH 6.0,在55 ℃下处理7 h的样品,采用高效液相色谱法对酶处理前后的龙眼果汁中单糖、蔗糖和低聚果糖等组分进行分析,结果见表1和图6。
结果表明,酶转化前底物TSS为30oBrix的龙眼浓缩果汁中以蔗糖为主,含量为164.36 mg/mL,果糖的含量为42.52 mg/mL、葡萄糖的含量为49.27 mg/mL,没有检测到低聚果糖。酶转化7 h所得龙眼果汁中蔗糖的含量显著减少至22.34 mg/mL,果糖的含量为37.73 mg/mL,葡萄糖的含量为98.22 mg/mL,检测到蔗果三糖和蔗果四糖,含量分别为70.50 mg/mL和27.38 mg/mL,低聚果糖含量为97.88 mg/mL。结果表明,经酶转化之后龙眼果汁中蔗糖的含量显著减少了86.41%,新生成的低聚果糖占果汁中总糖的比例为38.21%。同时值得注意的是果汁中葡萄糖含量也会增加。Roberto等[34]人用一种商业酶转化蔗糖制备低聚果糖,也得到了类似了结果,随着反应的进行葡萄糖会积累,且葡萄糖积累到一定量之后会抑制低聚果糖的生成。因此,后续的研究工作需要考虑降低果汁中葡萄糖的含量,使果汁中的低聚果糖含量和比例得到进一步的提高。当然,龙眼果汁在55 ℃处理7 h,除了糖组分产生变化外,因美拉德反应,颜色和风味等感官指标会发生变化,如颜色加深,显现出干制龙眼的香味物质,有待进一步研究。

表1 酶处理前后的龙眼果汁中糖组分的变化和含量Table 1 The sugars composition in longan juice before and after enzymatic treatment
3 结论
底物浓度(TSS)、pH、酶添加量、温度和酶处理时间等单因素对龙眼果汁中蔗糖和低聚果糖含量有显著影响,其中较适合的酶转化条件为:龙眼果汁的底物TSS为30~40oBrix,pH 6.0,酶的添加量范围在9~12 U/g,酶转化温度55 ℃,酶处理时间5~9 h。在此条件范围之内,果糖基转移酶能够有效将龙眼果汁中的蔗糖转化生成低聚果糖,且使蔗糖的转化率和低聚果糖比例分别能够保持在80%以上和38%以上;HPLC分析结果表明30oBrix的龙眼浓缩果汁,酶转化前蔗糖含量为164.36 mg/mL、果糖的含量为42.52 mg/mL、葡萄糖的含量为49.27 mg/mL,没有检测到低聚果糖,在酶添加量9 U/g、pH 6.0、55 ℃下转化7 h的龙眼果汁,蔗糖显著降低,其含量为22.34 mg/mL,果糖的含量为37.73 mg/mL,葡萄糖含量为98.22 mg/mL,蔗果三糖含量为70.50 mg/mL,蔗果四糖含量为27.38 mg/mL,低聚果糖的总含量为97.88 mg/mL,占果汁中总糖的38.21%。利用果糖基转移酶处理果汁制备一种低蔗糖(低热量)且富含低聚果糖的具有潜在益生元作用的功能性龙眼果汁。
