3D生物打印构建复层尿道组织的初步研究
2018-11-06皮庆猛王晓磊张志亮周碧玉任晓芸陆毅黄一雄傅敏刚范志宏
皮庆猛 王晓磊 张志亮 周碧玉 任晓芸 陆毅 黄一雄 傅敏刚 范志宏
生物打印技术的出现,为快速精准构建有生物活性的组织或器官提供了可能[1]。由于空腔组织或器官的特殊性,在体外快速生物打印过程中,依然面临着巨大挑战[2]。本实验前期工作已经证实,依靠同轴共轭打印系统,利用明胶衍生物和海藻酸盐分别具有光交联和离子交联的特性,可以快速构建单层的空腔组织[3-5]。为了进一步构建含有复层亚结构的空腔组织,我们改进打印喷头,借助快速离子交联和光交联固化水凝胶的方法,探讨同时打印复层亚结构的尿道组织的可行性。
1 材料与方法
1.1 材料试剂
猪源明胶(Gelatine,type-A,300 bloom)、甲基丙烯酸酐(Methacrylic Anhydride,MW=154.16)、海藻酸盐 (Sodium alginate,MW=33 KDa,low viscosity)、氯化钙、EDTA等购自Sigma公司。胎牛血清、PBS、HEPES缓冲液、0.25%胰酶、高糖基础培养液DMEM等购自Gibico公司。细胞活力检测(live/dead)试剂盒、细胞增殖能力检测试剂盒(prestoblue)、细胞骨架蛋白 F-actin(Alexa-594、Alexa-488)、细胞核染料DAPI等购自Life Technologies公司。尿道上皮细胞株和尿道平滑肌细胞株购自Scien Cell公司。
Instron 生物力学检测仪 (Model 5542,USA),RHEOPLUS-32 流变仪 (Anton Paar,Germany),3D生物打印机 NovoGen MMX bioprinter(Organovo,USA),多通道打印喷头由本实验室自行组装。
1.2 实验方法
1.2.1 复合水凝胶制备及复层打印系统改进
①本实验复合水凝胶借鉴Ali Khademmhosseni的方法[4-6],将7% GelMA与2% Alginate混合制备成复合水凝胶。②同轴共轭复层打印喷头改装参照文献[4],改进不同亚层的复合打印。③利用同轴共轭复层打印系统,分别将复合水凝胶与细胞复合后,同时打印管腔组织结构的内外亚层。
1.2.2 复层空腔结构打印
①参照文献[4],将7% GelMA和2% Alginate制备成复合水凝胶,每管3 mL,共2份,37℃培育箱孵育备用。②将复合水凝胶分别与绿色和红色microbeads颜料混合,转移至3 mL注射器内,震动混匀。③将注射器连接打印机,软管通过27 G针头固定,以匀速(10~20 μL/min)助推泵推送水凝胶。④以80~200 μL/min 推送 Ca2+,边打印边交联,将空腔管打印在含有CaCl2的培养皿内。⑤打印后,快速将空腔组织转移至 UV灯下,360~480 nm、6.9 mW/cm2紫外交联30 sec。⑥倒置荧光显微镜下拍照观察空腔管腔结构并测量不同亚层结构的管径、管壁大小。
1.2.3 复层尿道管腔组织打印
①复合水凝胶准备如上述。②取状态良好的人尿道上皮细胞(EC)和人尿道平滑肌细胞(SMC),调整细胞数量为2×106cells/mL,消化离心后,去上清,保留细胞团块,各与1 mL复合水凝胶轻轻混匀,转移至1 mL注射器内,置孵育箱备用。③将含有细胞水凝胶复合物的注射器连接软管,分别连接打印喷头并固定于打印机器NovoGen MMX bioprinter助推泵上。④注射器吸取3 mL无菌3% CaCl2后,连接打印喷头并固定。⑤通过调节打印喷头行进速度及不同通道间的推进流速,以打印出稳定空心管结构。⑥将打印出含有细胞的空腔组织转移至六孔板内,予以尿道上皮细胞和尿道平滑肌细胞混合培养液体外培养。⑦自打印当天(打印后30 min)至第7天,live/dead染色检测细胞活力及增殖情况。⑧F-actin免疫组化染色检测铺展情况:4%多聚甲醛固定1 h,0.1% TritonX100处理半小时,1% BSA封闭 2 h,Alex488 F-actin抗体4℃孵育过夜,次日PBS洗2遍,1∶1 000加入DAPI,反应5~10 min。⑨分别将样本固定后,于倒置荧光显微镜下观察,不同视野随机取3个区域拍照。
1.2.4 复层尿道组织灌注
①复层尿道组织打印方法同前。②将打印后复层管状组织用含10%胎牛血清的DMEM培养液体外培养24 h。③用27 G针头固定打印复层管一端,用含有红色颜料的灌注液持续灌注复层管状组织。④视频记录灌注情况。
2 结果
2.1 具有双亚层结构尿道空腔组织打印设想
为同时构建具有内层尿道上皮和外层尿道平滑肌复层结构的尿道组织,我们设想在打印系统中,能够独立、快速地同时分开打印不同亚层结构。在实验室前期工作基础上[4],改进一种同轴多通道生物打印系统(图1)。分别将尿道上皮细胞(内层)和尿道平滑肌细胞(外层)与含有7% GelMA和2% Alginate的复合水凝胶混合,在快速打印过程中,利用Ca2+可以快速交联海藻酸盐的特性,由计算机辅助控制系统内外双层结构分别在不同的通道匀速泵出,实现边打印边固化(图1A);然后将凝胶化的复层管腔结构,再利用紫外线交联固化水凝胶中的GelMA,实现进一步固化。这个快速打印过程中,不同亚层结构的同时分开打印是关键,为实现不同亚层在一个同轴层面,我们改进了打印喷头(图1B)。利用计算机辅助控制打印喷头、动力泵匀速助推的不同通道的细胞水凝胶复合物,来实现同时快速打印不同亚层的目的。
2.2 复层尿道管腔组织打印
为了验证我们的新打印系统,便于观察打印后不同亚层间的差异,我们将空腔管状结构的内、外层水凝胶分别与绿色和红色颜料混合,利用同轴多通道打印系统打印出空腔结构(图2)。通过颜料的差异标识,我们可以清楚看到内、外管同时打印后的绿色和红色颜料复合的橙黄色结构,以及仅单层时的绿色结构(图2B)。复层管腔结构横断面、纵切面可清楚看到红色颜料位于复层管腔结构的外层,而绿色颜料均匀分布于复层管腔的内层(图2C-D),特别是两层结构内的颜料不相互渗入,并可分离(图2D)。通过检测,复层管腔的内、外径分别为(663.66±51.74)μm和 (976.84±63.43) μm, 内、 外亚层壁厚分别为(93.78±10.25) μm 和(62.06±10.45) μm。
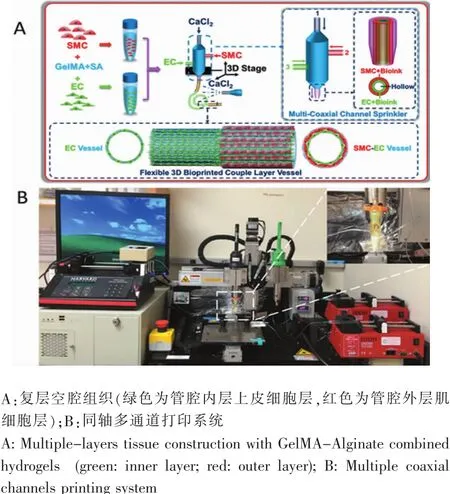
图1 复层空腔结构打印设计Fig.1 Schematic of multiple-layers structure
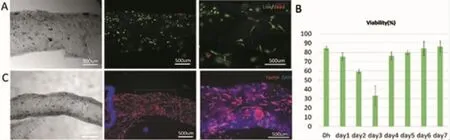
图3 尿道细胞复合水凝胶打印后细胞活力观察Fig.3 Cell viability observation of hollow tissue bioprinted with loading urethral cells
2.3 复层尿道组织长期体外培养
为了实现尿道空腔组织的生物打印构建,我们将尿道细胞(上皮细胞和平滑肌细胞)分别跟复合水凝胶(7% GelMA和2% Alginate)混合,通过同轴多通道打印系统快速打印。空腔组织打印后30 min左右的细胞活力在84.52%以上(图3A),培养7 d后空腔结构中的尿道细胞仍可以存活,并能维持细胞活力在86.26%以上(图3B)。培养7 d后,将组织固定染色,我们可以看到细胞在空腔结构内可以充分铺展开(图3C)。这说明尿道细胞经过同轴多通道打印系统打印后,细胞可以在空腔结构内长期存活,并能够铺展。
2.4 复层尿道管腔组织灌注
为进一步明确打印后组织是否是真正贯通的空腔三维结构,我们将打印的空腔组织体外培养24 h后,两端通过软管跟动力泵连接并固定(图4A),可见含有颜料的灌注液可通过空腔组织(图4B),说明打印后组织具有良好的灌注性。

图2 复层空腔结构打印Fig.2 Multiple-layers printing of hollow structure

图4 空腔结构灌注Fig.4 Perfusion of hollow structure
3 讨论
空腔组织的生物打印面临着巨大挑战[5,7]。实体组织生物打印,一般可通过计算机辅助控制实现不同层次的快速叠加来实现[8-10]。但是,空腔组织的三维结构如何维持是打印过程中面临的一个难题。理论上讲,水凝胶固化后力学性能足够,实体组织打印可构建很多层次。本实验通过复合GelMA和海藻酸盐Alginate,增加了打印过程中水凝胶固化后力学强度(力学测试数据未出示),从而实现打印后空腔组织三维结构的维持。通过不同亚层的区分打印,将复杂空腔组织的不同亚层组织细胞区分构建以实现不同亚层的功能。为了区分不同亚层,我们先将不同颜色的microbeads与复合水凝胶混合,以达到区分不同亚层的目的,实验证实不同亚层可以同时区分打印。通过测量,亚层的结构厚度分别为内层(62.06±10.45) μm 及外层(93.78±10.25) μm,约为1~2个细胞的厚度。通过打印喷头的设计调整,可以实现厚度的变化(数据未出示)。
将尿道细胞分别与复合水凝胶混合后打印,实验证实细胞可以长期存活,体外培养后细胞活力在80%以上。但是,在体外培养早期细胞活力有一个明显的下降过程,至第3天细胞活力在30%左右。这可能跟打印过程中的操作对细胞造成损伤有关,该现象跟文献报道基本一致[11-13]。实验发现,打印后空腔组织在体外培养7 d,尿道细胞可以铺展开,说明细胞在复合水凝胶空腔支架内可以生长。而打印后24 h内的灌注实验表明,打印空腔组织具有贯通的三维结构。上述结果表明,虽然打印过程中由于剪切力、管道挤压等对细胞造成损伤,但长期培养细胞是能够成活的。这进一步说明,利用该方法最终构建出具有生物学功能的尿道组织是可行的。但是,实验中我们也发现,打印后组织结构在培养液内长期静态培养后,管壁结构非常脆弱,我们尝试对培养时间较久的结构进行灌注,结果并不理想。今后通过增加打印后组织培养过程中的力学强度或进行动态培养,也许能解决这个难题,有待于进一步的实验研究。
综上所述,本实验将尿道上皮细胞和尿道平滑肌细胞分别同复合水凝胶 (7% GelMA和2% Alginate)混合,通过改装同轴多通道生物打印系统快速构建具有空腔复层结构的组织,实验初步证实尿道细胞在打印后组织中可以长期存活,并有灌注功能。
