缓释FGF2基因壳聚糖核壳微球提高颗粒脂肪移植存活率的研究
2018-11-06马莉蒋思静贾大平赵宇
马莉 蒋思静 贾大平 赵宇
颗粒脂肪是目前临床首选的填充移植物,但存在吸收率高、感染及液化等并发症。研究表明,在颗粒脂肪移植过程中添加FGF2可诱导脂肪干细胞向血管内皮细胞分化,以促进新生血管形成,提高颗粒脂肪移植存活率[1],但是单独添加FGF2易被组织稀释,存留时间短,成本高,难以长期发挥作用[2],而FGF2基因治疗技术更具有实际应用价值。病毒与脂质体由于具有细胞毒性和致畸性等潜在风险限制了其临床应用。壳聚糖具有缓释、基因载体等多种功能并广泛应用于药物缓释剂基因载体的研究。我们前期研究显示,壳聚糖衍生物巯基烷基化壳聚糖(Thiolated N-alkylated chitosan)可与DNA通过正负电荷相互作用形成包载基因的核结构 (TACS-pEGFP),核结构具转染特性。核结构再与羟丁基壳聚糖(HBC)形成核壳结构(HBC@TACS-pEGFP)。该核壳结构基因载体具有低细胞毒性、良好的转染效率和缓慢释放基因等特点[3]。因此,我们设想在颗粒脂肪移植过程中添加包埋FGF2基因的缓释转染核壳结构,以提高颗粒脂肪移植存活率。
1 材料与方法
1.1 实验动物和材料
新西兰兔18只,3月龄,体质量2.5~3.0 Kg,雌雄不限(安徽医科大学动物实验中心);人肾上皮细胞(293T细胞)(安徽医科大学免疫教研室);巯基烷基化羟丁基壳聚糖(TACS)及羟丁基壳聚糖(HBC)(中国科学技术大学材料与化学研究实验室);兔源性融合基因pFGF2-EGFP大肠杆菌菌株和空载质粒 GV219(上海吉凯生物公司);DMEM培养基(Gibco公司,美国);兔抗 CD31 抗体(Sigma公司,美国);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)。
1.2 HBC@TACS-pFGF2-EGFP核壳结构转染载体的制备
体外扩增提取质粒,测定质粒浓度后,-20℃保存备用。按照课题组前期研究结果,以20∶1的氮磷比,将TACS与pFGF2-EGFP质粒混合于PBS缓冲液中,涡旋振荡30 sec,混匀,室温下静置30 min,形成TACS-pFGF2-EGFP质粒核结构,再加入与TACS等量的HBC,涡旋振荡30 sec,混匀,室温下静置30 min,即可形成HBC@TACS-pFGF2-EGFP核壳结构[3]。
1.3 核壳结构体外降解释放pFGF2-EGFP实验
分别制备含 100 μg质粒的 TACS-pFGF2-EGFP和HBC@TACS-pFGF2-EGFP核壳结构置于透析袋中,将透析袋置于含TE缓冲液中,分别于第1、2、3、5、8、10、15、20 天时测定缓冲液中 pFGF2-EGFP的浓度。检测核壳结构包载基因相较于核结构包载基因缓释基因的释放规律。
1.4 Western-blot检测体外转染细胞表达FGF2蛋白的水平
体外培养人293T细胞,细胞融合达80%~90%时进行转染。对照组:每培养皿中加入含5 μg空载质粒(GV219)的HBC@TACS-GV219核壳结构及不含血清的培养基进行转染。实验组:每培养皿中加入含5 μg质粒的HBC@TACS-pFGF2-EGFP核壳转染载体及不含血清的培养基进行转染实验。分别于转染第2天及第4天时收集细胞,Western-blot检测各组体外转染细胞表达FGF2蛋白的情况。
1.5 颗粒脂肪移植实验
新西兰兔静脉麻醉,无菌条件下切取肩胛间区脂肪,剪碎至约1 mm3大小备用。将兔耳皮肤与耳软骨膜剥离,形成直径约3 cm的皮下腔隙作为颗粒脂肪移植受区。兔左耳作为实验组,移植2 mL脂肪颗粒和HBC@TACS-pFGF2-EGFP;兔右耳作为对照组,移植2 mL脂肪颗粒和HBC@TACS-空载质粒。每组均含质粒 20 μg,体积 200 μL。术毕,缝合皮肤,肌肉注射青霉素预防术后感染,单笼饲养。分别于术后4、8、12周取材观察大体标本,测量组织体积,行HE染色及免疫组化染色,观察移植脂肪的成活情况及新生血管情况。
1.6 观察指标
一般观察:术后动物活动及饮食情况,移植后取材区及移植区有无感染等情况。移植物大体观察:分别于术后第4、8、12周取材,观察耳部移植物大体组织形态,计算移植后不同时间点的组织存活率。HE染色:观察移植物脂肪细胞形态及新生血管情况。免疫组化:羊抗兔CD31抗体染色,测量平均光密度值,计算新生血管密度。
1.7 统计学方法
采用SPSS17.0统计软件进行分析。术后组织体积数据以(±s)表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 核壳结构体外缓释pFGF2-EGFP质粒
TACS-pFGF2在TE缓冲溶液中缓释24 h后其释放率约为45.3%,缓释48 h时释放率约为59%;第5天时,约有86.3%的pFGF2-EGFP被释放;第10天到第20天时,TACS-pFGF2-EGFP组的基因释放率无明显增高,均在90%左右。而HBC@TACS-pFGF2-EGFP组在各时间点释放的基因浓度均低于TACS组。由此可见,TACS在包裹基因后能在短时间内释放基因,而在TACS外继续包裹HBC后增加了载体的降解时间,减缓了基因释放的速度(图1)。
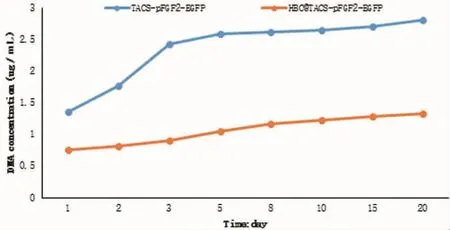
图1 核壳结构纳米粒子体外缓释实验Fig.1The release of TACS-pFGF2-EGFP and HBC@TACS-pFGF2-EGFP in the TE buffer in vitro
2.2 HBC@TACS-pFGF2-EGFP核壳结构体外转染细胞表达FGF2蛋白的情况
实验组HBC@TACS-pFGF2-EGFP核壳缓释基因载体在体外可成功转染细胞并表达FGF2蛋白,且随时间增加表达蛋白的量也在增加(P<0.01)。转染后第4天时,实验组FGF2蛋白表达水平显著高于对照组(P<0.05)。说明 HBC@TACS-pFGF2-EGFP核壳结构基因载体可成功转染细胞并表达目的蛋白FGF2,且随时间推移蛋白表达水平逐渐增加(图2)。
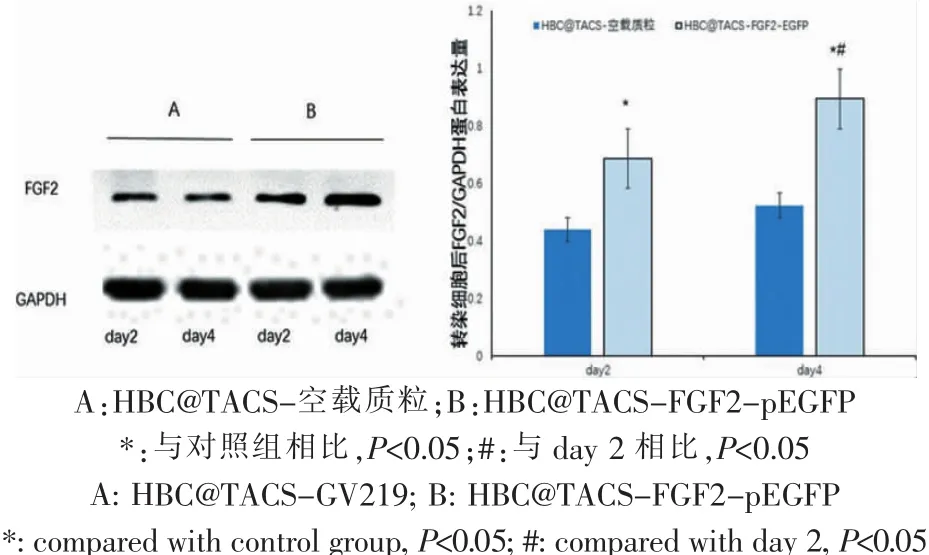
图2 体外转染细胞后不同时间点FGF2蛋白表达情况Fig.2 Expression of FGF2 at different time point after transfection
2.3 不同时间点移植物大体观察
实验组脂肪体积在不同时间点均大于对照组。移植术后第4周,实验组和对照组的脂肪组织仍呈颗粒状,脂肪颗粒颜色稍苍白、缺血明显、无明显包膜形成,对照组移植物中央可见少量脂肪无菌性液化。术后第8周时,两组颗粒脂肪移植物体积与第4周相比有所减小,大体结构与正常组织相似,组织颜色淡黄色,质地柔软,未感染或囊性液化。第12周时,两组脂肪组织可见完整包膜及大量新生血管,组织体积近一步减小,形态与正常组织无异(图3)。
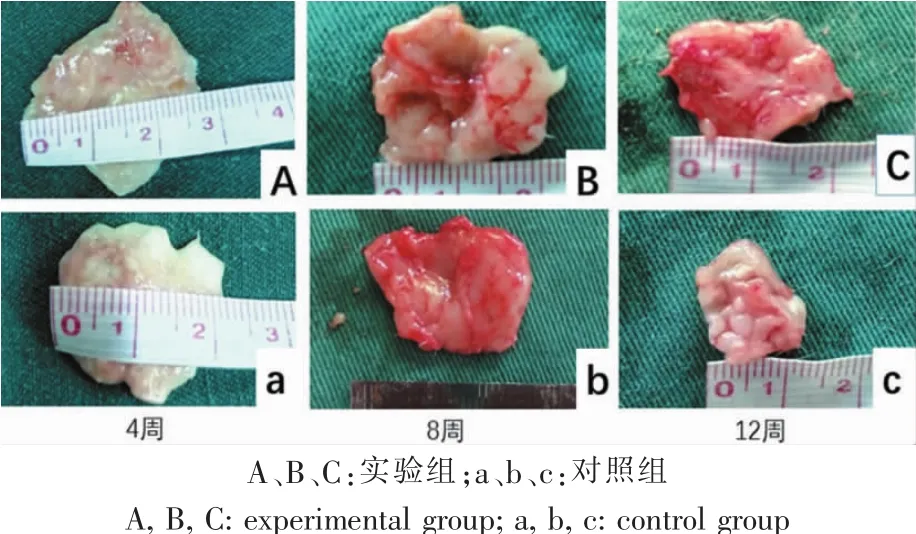
图3 不同时间点取材大体标本观察Fig.3 Gross observation of fat harvested at different time point
2.4 不同时间点脂肪体积的测定
结果显示,随移植时间的延长,实验组4、8、12周时的脂肪移植存活率分别为 (89.50±1.86)%、(79.94±1.61)%和 (75.98±2.66)%;对照组分别为(72.56±1.90)%、(64.54±3.58)%和 (57.98±4.84)%,各时间点间差异显著(P<0.05),且实验组脂肪移植存活率在各时间点均大于对照组(P<0.05)。
2.5 HE染色
术后第4周时,脂肪组织可见少量纤维包裹,实验组脂肪排列稍整齐,边缘区及中央区开始出现少量新生血管;对照组脂肪细胞大小不一,排列紊乱,少量炎症细胞浸润,并有纤维条索形成。术后第8周,实验组脂肪细胞排列逐渐整齐,新生血管进一步增多;对照组脂肪组织可见少量空泡,纤维条索进一步取代脂肪组织。术后第12周,实验组脂肪组织形态与术后第8周相比无明显变化,组织形态与正常脂肪组织差别不大,并可见大量成熟血管;对照组脂肪组织内见大量纤维条索结构形成(图4)。
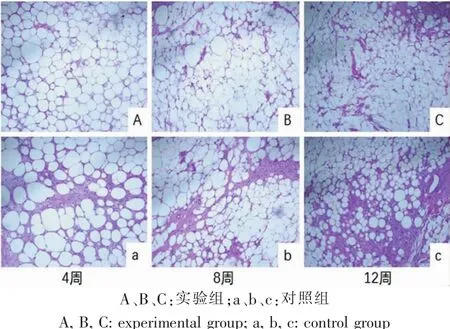
图4 不同时间点取材脂肪组织HE染色(100×)Fig.4 Histological observation of adipose tissue at different time point by HE staining(100×)
2.6 免疫组化观察
移植术后第4周,实验组即可观察到少量CD31蛋白被染成棕色,对照组棕色显色不明显。术后第8周和12周,实验组棕色染色逐渐增多。对照组也可观察到少量棕色显色。Image J软件测定CD31光密度,术后各时间点实验组脂肪组织的CD31平均光密度值均高于对照组(P<0.05),且随时间推移CD31的光密度值逐渐增高,说明移植术后各取材时间点的实验组脂肪组织的新生血管密度均高于对照组(图 5、6)。
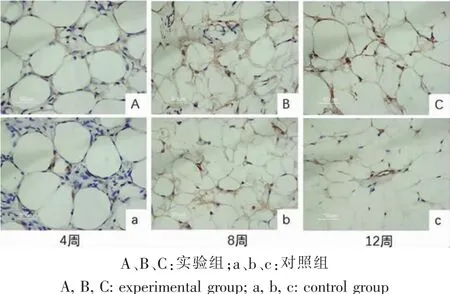
图5 不同时间点取材脂肪组织免疫组织化学染色分析(200×)Fig.5 Histological and immunohistochemical analysis of adipose tissue at different time point by IHC(200×)

图6 不同时间点取材脂肪组织CD31平均光密度值分析Fig.6 The average optical density of CD31of adipose tissue at different time point
3 讨论
脂肪移植已成为整形外科的重要部分,但脂肪移植后难以维持其移植时的初体积。Kolle等[4]研究表明,移植后的高吸收率从25%~80%不等。由于脂肪细胞对缺血的耐受性较低,导致部分颗粒脂肪无菌性坏死吸收。脂肪组织的缓慢血运化导致早期细胞凋亡和成熟移植脂肪细胞坏死。即使移植后再血管化,移植物体积缩小过程仍然存在。
bFGF可促进脂肪干细胞成脂分化和成血管分化,被广泛用于促进脂肪移植存活率的研究[1]。但外源性生物蛋白制剂在进入体内环境后易被组织中的酶代谢降解,无法长期发挥作用[1]。壳聚糖作为一种天然、低毒性的基因转染材料被广泛应用[5]。本课题组前期成功制备了可作为基因载体的巯基烷基化壳聚糖(TACS),在TACS的量与基因的量比例为20∶1时转染效率最高,可达38.99%。我们还制备了具有温度敏感效应的羟丁基壳聚糖 (HBC)包裹基因载体,达到缓释基因载体的功效。与传统的基因载体(如Lip2000等)相比,改性后的壳聚糖作为转染载体能完整包裹基因,具有良好的生物相容性和低细胞毒性[3]。
有研究利用巯基烷基化壳聚糖(TACS)和羟丁基壳聚糖 (HBC)依次包裹 BMP4基因,制成HBC@TACS-pBMP4核壳缓释转染载体,用于修复骨缺损,结果提示在骨缺损修复过程中,BMP4蛋白持续表达,促进了骨缺损的修复,并且新生骨具有一定的生物力学特性[6]。说明该核壳缓释基因载体适用于长期治疗过程。
本实验同样证实了HBC@TACS-pFGF2-EGFP在体外可缓慢降解释放pFGF2-EGFP基因,而且在转染细胞后可成功表达FGF2蛋白。在脂肪移植实验中,实验组加入了HBC@TACS-pFGF2-EGFP缓释转染微球。在术后取材进行脂肪移植存活率计算中发现,实验组脂肪移植存活率在各时间点均大于对照组。HE染色观察发现,实验组脂肪结构与正常脂肪相似,对照组脂肪吸收率较高,且被部分纤维组织取代。免疫组织化学分析显示,实验组可见较多被染成棕色的CD31。由此可见,在颗粒脂肪移植过程中添加含有一定量的缓释FGF2基因的微球,可长时间持续表达FGF2蛋白,并且促进新生血管的形成,降低颗粒脂肪移植过程中的吸收率,提高颗粒脂肪移植存活率。
本实验在脂肪移植过程中加入pFGF2-EGFP质粒,结果提示脂肪组织存活率较对照组有所提高,CD31的表达也显著增加,由于加入的基因是融合基因,使得所加入的pFGF2基因的量不明确。需要进一步实验将EGPF基因切除后探索在移植过程中加入质粒进行辅助,以提高脂肪存活率的最佳的脂肪体积与基因的比值。基因转染载体TACS外包被了HBC后可延缓基因作用时间,如何确定外层HBC的量,使得基因载体释放速度与脂肪组织移植后所需蛋白的时效进行匹配仍需进一步研究。此外,本研究中移植物最长取材时间为12周,移植后脂肪组织的远期转归及生物学效应仍需探索。能否使用该方法进一步研究大体脂肪组织的构建也需要进一步的实验论证。
