大鼠毛囊干细胞体外无血清培养体系的建立
2018-11-06夏肖雪吕正梅张守兵
夏肖雪 ,吕正梅,张守兵
毛囊干细胞在烧伤、烫伤和脱发等的临床治疗方面有很好的应用前景[1]。目前,其体外培养体系均需添加胎牛血清(fetal bovine serum, FBS),以维持干细胞的生长[2]。但是,血清的具体成分极其复杂,将含FBS的培养基用于以临床治疗为目的的毛囊干细胞培养,很可能带来许多不可控的风险和问题,如病毒等微生物污染、FBS的批次差异及伦理学问题等[3]。因此,建立一种不含血清、化学成分确定的毛囊干细胞体外培养体系就成为了必需。
课题组在之前的研究中成功建立了大鼠毛囊干细胞的培养体系,该培养体系甚至能够从一根大鼠触须毛囊中获取大量毛囊干细胞并重建功能性皮肤[4-6]。但是,该培养体系仍然是含FBS的。因此,该实验尝试在此基础上用KnockOutTM血清替代物 (KnockOutTMserum replacement, KSR)代替FBS,建立毛囊干细胞无血清培养体系并重建有毛皮肤,为毛囊干细胞的临床研究和应用提供前期资料和实验基础。
1 材料与方法
1.1材料
1.1.1动物及细胞来源 7周龄成年雌性裸鼠(nu/nu)购自北京维通利华实验动物技术有限公司,置于安徽省实验动物中心SPF级饲养室常规饲养1周后待用;新生SD大鼠由安徽省实验动物中心提供。大鼠毛囊干细胞及绿色荧光蛋白标记的毛囊干细胞(green fluorescence-expressing hair follicle stem cell, GFP-HFSC)[4]由中国科学院动物研究所段恩奎研究组赠送,本实验室传代保存。
1.1.2主要试剂 澳洲胎牛血清购自香港MRC公司;William’E生长培养基、KSR、Ⅳ型胶原酶、Dispase酶和胰酶消化液购自美国Invitrogen公司;Matrigel基质胶(Corning Matrigel Basement Membrane Matrix) 购自美国BD biosciences公司;硅胶贴(Epi-Derm® Silicone Gel Sheeting)购自美国Biodermis公司;兔抗大鼠P63单克隆抗体购自英国abcam公司;小鼠抗大鼠α6-整合素抗体购自英国Serotec公司;兔抗大鼠角蛋白K14单克隆抗体、FITC标记山羊抗小鼠IgG二抗及FITC标记山羊抗兔IgG二抗均购自北京中杉金桥公司;其余试剂均为国产,分析纯级。
1.2方法
1.2.1无血清培养体系的构建 将第5代大鼠毛囊干细胞复苏,进行分组培养。一组继续用含血清培养基(添加15%胎牛血清的生长培养基)培养,标记为FBS组;另一组将胎牛血清逐渐替换为KSR,标记为KSR组,血清浓度按每天5%的梯度从15%递减至0,同时KSR的浓度按5%的梯度从0递增至15%,维持生长培养基中FBS和KSR的总浓度在15%,直至生长培养基含15%的KSR。KSR组用无血清培养基(含15%KSR的生长培养基)传代培养至第10代,FBS组同步培养至第10代。倒置显微镜下观察不同培养条件下两组毛囊干细胞的生长状态。GFP-HFSC分别用无血清培养基和含血清培养基从第7代培养至第12代。
1.2.2毛囊干细胞在两种培养条件下的生长曲线比较 各取1×104个用无血清培养基和含血清培养基培养的第10代毛囊干细胞,接种到100 mm培养皿并分别用无血清培养基(KSR组)和含血清培养基(FBS组)同步培养,分别在第2、4、6、8、10、12天收集细胞并计数,每个时间点做3次重复,取细胞数平均值,绘制生长曲线。
1.2.3毛囊重建 毛囊重建实验根据课题组已建立的方法完成[5]。简而言之,用酶(0.25%的胰酶和6.25 mg/ml的Dispase酶体积比3 ∶2)消化法将新生大鼠背部皮肤的表皮和真皮分离,用3 mg/ml的Ⅳ型胶原酶将真皮消化为单细胞悬液,收集真皮细胞备用。
为方便移植后追踪毛囊干细胞的去向,使用GFP-HFSC进行移植。将GFP-HFSC与收集的真皮细胞以1 ∶5的比例混合,即3.5×106个毛囊干细胞和1.8×107个真皮细胞混合,用于一只裸鼠的移植;用William’E生长培养基将混合细胞重悬,与Matrigel基质胶混匀,置于硅胶贴上,制成直径为1.5 cm的细胞凝胶,用于移植;实验组(KSR组)中的毛囊干细胞为无血清培养基培养的第12代GFP-HFSC,阳性对照组(FBS组)中的毛囊干细胞为含血清培养基培养的第12代GFP-HFSC,阴性对照组不含毛囊干细胞,仅含真皮细胞。
15只裸鼠分为3批,每批5只,含实验组2只、阳性对照组1只和阴性对照组2只,每隔1天手术一批。裸鼠麻醉后,手术去除其背部局部全层皮肤,大小与细胞凝胶一致;将硅胶贴覆盖在伤口上,小心使黏附其上的细胞凝胶填充于伤口内,用医用纱布和绷带固定包扎;术后4周颈椎脱臼法处死裸鼠,取背部新生皮肤,冰冻切片,厚度10 μm,于荧光显微镜下观察。
1.2.4免疫荧光检测毛囊干细胞中高表达的蛋白 分别将含血清培养基及无血清培养基培养的第10代毛囊干细胞黏附到盖玻片上;4%多聚甲醛固定,5%BSA封闭后,分别加入小鼠抗大鼠α6-整合素抗体(1 ∶200)、兔抗大鼠角蛋白K14抗体(1 ∶200)及兔抗大鼠P63抗体(1 ∶300),于4 ℃孵育过夜;次日分别加入FITC标记的山羊抗兔、山羊抗小鼠二抗(1 ∶100),37 ℃孵育1 h;室温条件下,用PI染核10 min,DABCO封片,于荧光显微镜下观察并拍照。
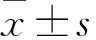
2 结果
2.1毛囊干细胞无血清培养体系的建立为尝试建立毛囊干细胞的无血清培养体系,用KSR逐渐替换培养基中的FBS,结果显示,毛囊干细胞可以正常生长并最终长满整个培养皿。使用无血清培养基进行常规传代,结果显示该干细胞可以产生新的克隆,并且FBS组和KSR组毛囊干细胞之间在形态上未发现明显差异(图1)。此外,用KSR替代FBS进行冻存液的配制,显示KSR组毛囊干细胞在冻存后可以正常传代并继续生长。
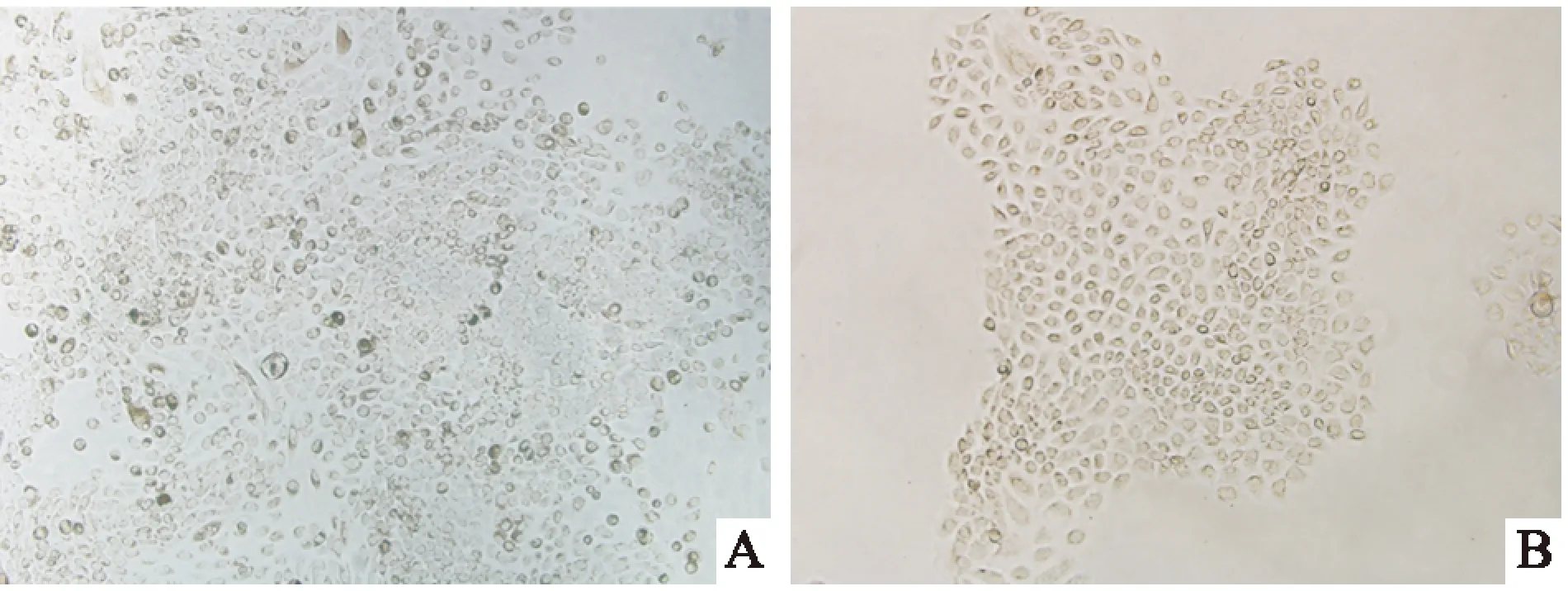
图1 两种培养条件下毛囊干细胞形态的比较 ×200
A: 无血清培养基培养的第10代大鼠毛囊干细胞(KSR组);B: 含血清培养基培养的第10代大鼠毛囊干细胞(FBS组)
2.2不同培养基对毛囊干细胞生长的影响为检测无血清培养基中毛囊干细胞的生长情况,用含血清培养基和无血清培养基分别接种相同数量的毛囊干细胞(分别为FBS组和KSR组)进行同步培养,在不同时间点收集细胞,计数并绘制生长曲线。计数结果表明,KSR组毛囊干细胞在接种初期即细胞数目较少时生长速度较为缓慢,但随着细胞生长细胞数目逐渐增加,其生长速度也在加快,最后与FBS组细胞数目相接近。总的来看,两组毛囊干细胞生长曲线的趋势基本一致(图2)。
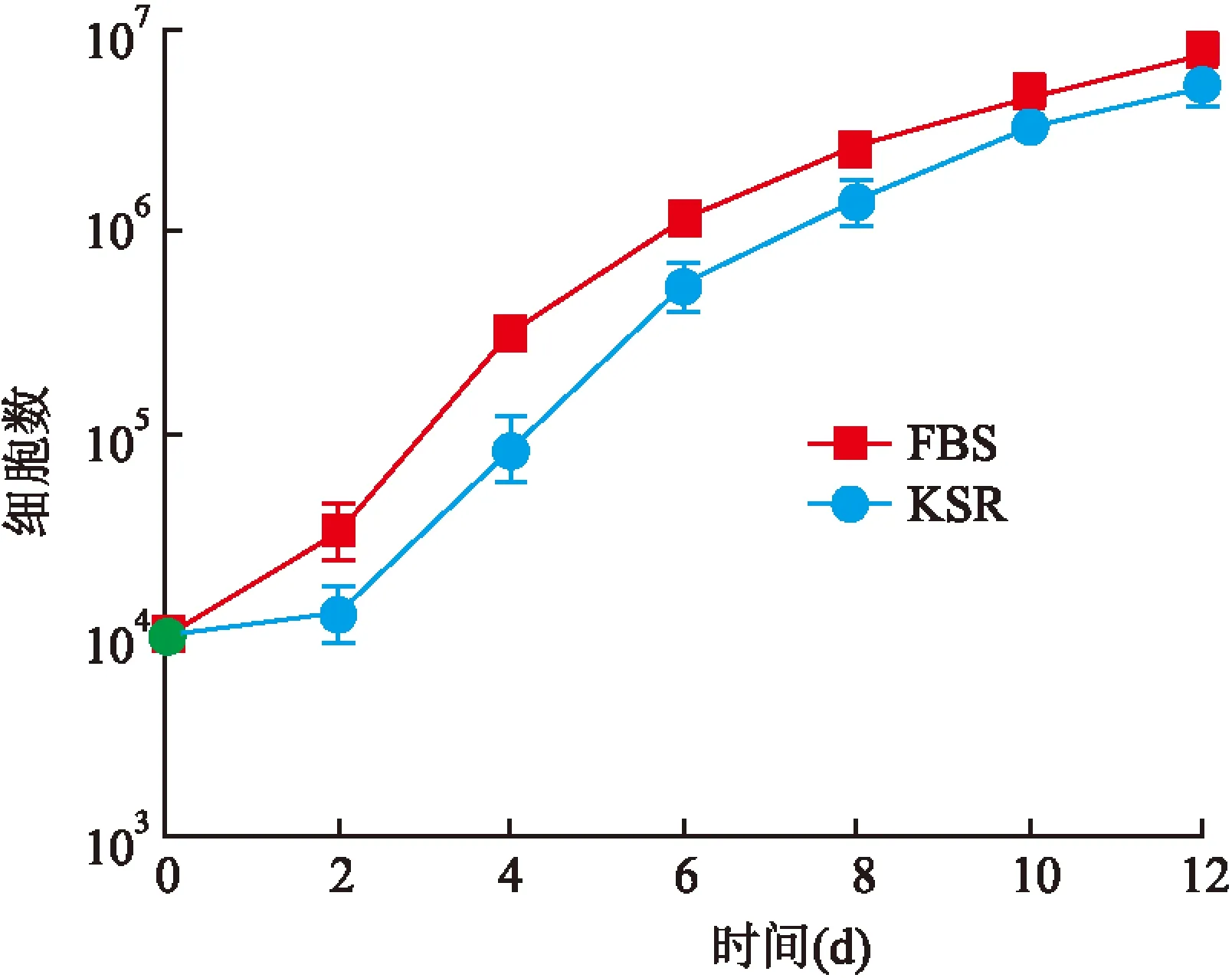
图2 毛囊干细胞在不同培养条件下的生长曲线
2.3毛囊重建为证明该无血清培养基能够在体外维持毛囊干细胞的“干性”,将KSR组毛囊干细胞与真皮细胞混合,移植到裸鼠背部,检测其重建毛囊的能力。为便于追踪毛囊干细胞的去向,使用表达绿色荧光蛋白的毛囊干细胞GFP-HFSC进行移植(图3A)。结果显示,FBS阳性对照组(图3B)与KSR实验组(图3C、3D)裸鼠背部均形成了新的皮肤,并且皮肤中均含有绿色荧光蛋白标记的毛囊及表皮,表明KSR组的GFP-HFSC重建了新的毛囊和表皮;而在阴性对照组的切片未发现毛囊,且表皮部分也未观察到绿色荧光(图3E)。
图3 毛囊重建实验
A:毛囊重建简要流程 ×200;B:阳性对照(FBS组)形成新的含毛囊皮肤 ×400;C、D:KSR实验组形成新的含毛囊皮肤 ×400;E:阴性对照组未形成新的毛囊 ×200;Der:真皮(dermis);Epi:表皮 (epidermis);HF:毛囊(hair follicle);HS:毛干(hair shaft);★:气泡
2.4免疫荧光检测毛囊干细胞高表达膜蛋白α6-整合素、角蛋白K14和核蛋白P63[4]。为验证上述蛋白在KSR组毛囊干细胞中仍然表达,用免疫荧光染色方法进行检测,结果显示在无血清培养基中培养的毛囊干细胞仍然表达α6-整合素、角蛋白K14和P63(图4),表明该无血清培养基不会改变毛囊干细胞的性质。
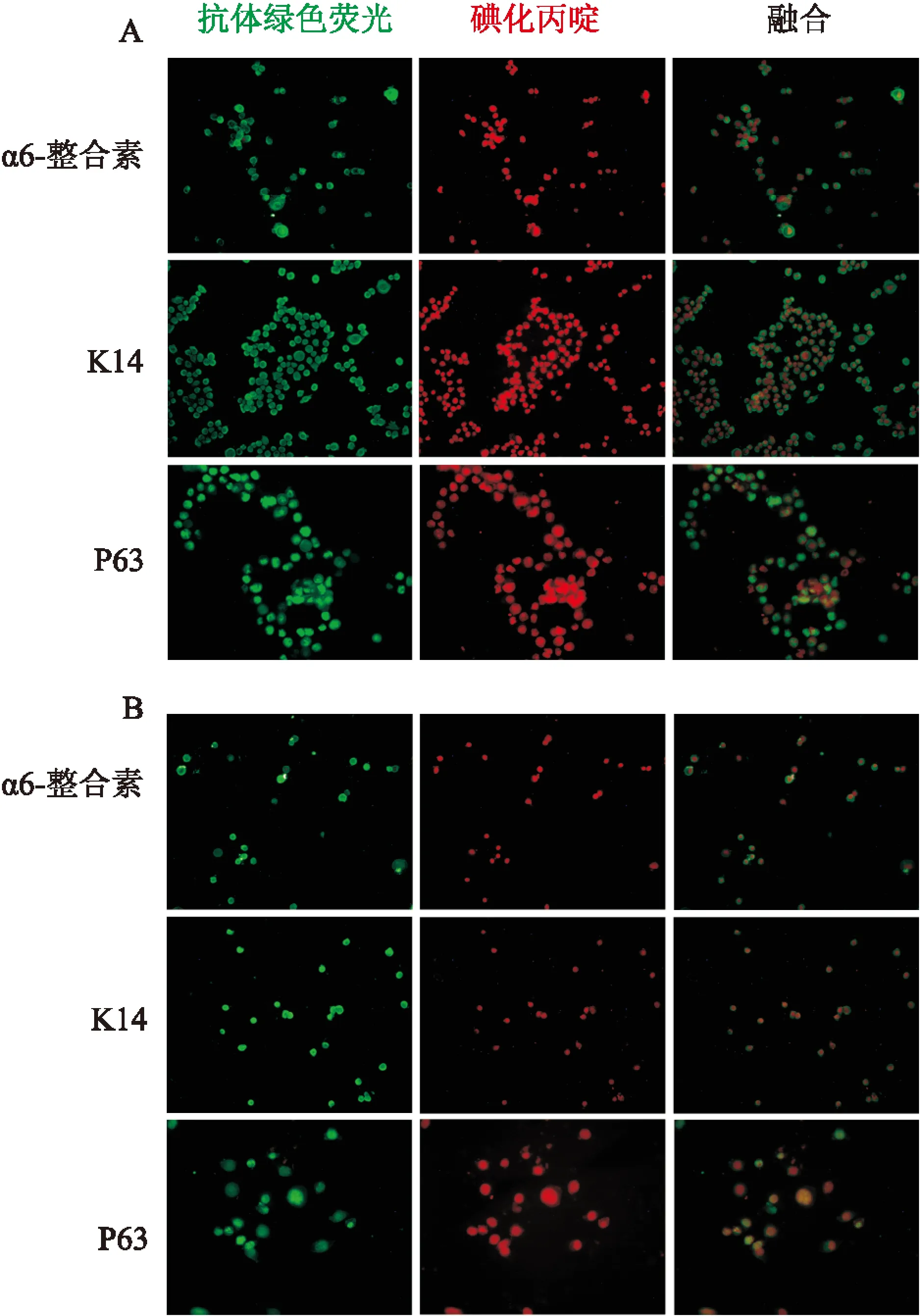
图4 大鼠毛囊干细胞的高表达蛋白免疫荧光染色
A:无血清培养基培养的毛囊干细胞(KSR组);B:含血清培养基培养的毛囊干细胞(FBS组);α6-整合素、K14:×200 ; P63:×400
3 讨论
皮肤具有阻止微生物入侵、防止脱水、调节体温和感觉等重要功能[7]。毛囊是重要的皮肤附属器,位于其隆突部的毛囊干细胞具有很强的增殖能力[8],体外培养的毛囊干细胞在大面积烧伤、烫伤和秃顶的治疗方面有良好的应用前景[9-10]。
然而,为了维持体外培养的毛囊干细胞的“干性”,目前的培养体系均含有胎牛血清。这种培养体系很可能会导致动物源性疾病的传播如牛海绵状脑炎等,甚至其他致病源的感染[11]。因此,毛囊干细胞在用于临床研究和应用之前,必须建立一种不含血清的培养体系。KSR是一种化学成分确定的培养基添加试剂,已被证实可代替血清,用于未分化胚胎干细胞的生长和维持[12]。虽然之前有研究尝试用KSR建立毛囊干细胞的无血清培养基,但由于培养条件的限制,毛囊干细胞的增殖能力呈下降趋势,因此其干细胞特性很可能发生了改变[13]。
本实验在先前建立的含胎牛血清的毛囊干细胞培养体系基础上,用KSR代替胎牛血清,初步尝试建立毛囊干细胞的无血清稳定培养体系。从结果来看,分别用添加KSR和胎牛血清的培养基进行培养后,毛囊干细胞的形态没有发生明显变化,结果表明以KSR代替胎牛血清用于毛囊干细胞培养是可行的,没有导致毛囊干细胞明显分化或死亡等情况发生;从生长曲线来看,毛囊干细胞在无血清培养基中的增殖速率比在含胎牛血清培养基中稍慢,表明在不同培养体系中,毛囊干细胞的增殖存在差异,这主要体现在细胞数量较少时,无血清培养基中的毛囊干细胞增殖稍慢。然而,从增殖的总趋势来看,两者是基本一致的。此外,在细胞冻存的过程中也可用KSR代替胎牛血清,这就使得从毛囊干细胞的培养到冻存,均可以避免胎牛血清的使用。
判断是否为毛囊干细胞最直接、最有力的证据就是检验其重建毛囊的能力[14]。该无血清培养基培养的毛囊干细胞移植到裸鼠背部,4周后重建了有毛囊皮肤,证明该培养基能够在体外维持毛囊干细胞的“干性”。此外,免疫荧光染色结果表明,在表皮系干细胞中高表达的K14、α6-整合素和P63在该无血清培养基培养的毛囊干细胞中仍然表达。
综上所述,本研究初步建立了含KSR的毛囊干细胞无血清培养体系,该体系能维持毛囊干细胞特性,能够重建含毛囊皮肤。本研究为毛囊干细胞的临床研究和应用提供了理论基础和技术支持。
