钙调磷酸酶在阿萨希毛孢子菌氟康唑获得性耐药中的作用研究
2018-11-04敖俊红彭卓颖郎德休杨蓉娅
廖 勇,丛 林,敖俊红,彭卓颖,郎德休,杨蓉娅
毛孢子菌属是重要的病原酵母菌,其可引起人类深部组织(器官)的感染,导致侵袭性毛孢子菌病[1],最常见的感染类型是毛孢子菌菌血症;虽然发病率较低,但其病死率可高达50%~80%[2]。阿萨希毛孢子菌(Trichosporonasahii,T. asahii)是该属内临床最常见分离的病原菌(占比达到75%)[2]。侵袭性毛孢子菌病常见于免疫功能缺陷的宿主,如血液系统肿瘤、人免疫缺陷病毒(HIV)感染、长期接受免疫抑制剂治疗等[1,3];随着免疫缺陷宿主的数量逐年增加,该病近40年的全球报道数量逐渐增加,但患者预后未见明显改善[2]。2014年欧洲指南和相关临床研究推荐三唑类抗真菌药作为侵袭性毛孢子菌病的治疗方案[4],该类药物属于抑菌药,其他病原真菌的研究发现,长期应用有耐药的风险。体外实验证明,通过氟康唑梯度诱导可获得阿萨希毛孢子菌耐药株[5];同时,临床报道发现阿萨希毛孢子菌唑类抗真菌药耐药株,甚至分离到多药耐药临床株[6,7],耐药可最终导致侵袭性毛孢子菌病患者对抗真菌治疗反应不佳[7]。由于侵袭性毛孢子菌病的首选治疗仅限于三唑类抗真菌药,且临床应用较多的为氟康唑;因此,认识阿萨希毛孢子菌的氟康唑耐药机制以及探索针对性预防策略具有重要的临床意义[8]。
钙调磷酸酶是 Ca2+/钙调蛋白调节的蛋白磷酸酶,从单细胞到多细胞生物都具有高度的保守性,其是热休克蛋白(heat shock protein,HSP)90的一种客户蛋白[9];目前认为,病原真菌可通过钙调磷酸酶通路,产生对三唑类抗真菌药的耐药[10]。研究发现,钙调磷酸酯酶抑制剂联合常用抗真菌药对念珠菌和酿酒酵母的抑制具有协同作用,且钙调磷酸酯酶抑制剂联合抗真菌药可抑制耐药菌株的生长[11]。研究发现,钙调磷酸酶抑制剂(他克莫司)可增强两性霉素B和卡泊芬净对阿萨希毛孢子菌的体外抗真菌活性[12]。本团队既往研究同样发现,钙调磷酸酶抑制剂(环孢素)单独使用对阿萨希毛孢子菌虽无明显抑制作用,但联合常用抗真菌药显示出良好的协同作用,提示钙调磷酸酶在阿萨希毛孢子菌的耐药中可能发挥一定作用[13]。本研究通过化学阻断的方法探讨阿钙调磷酸酶在萨希毛孢子菌的氟康唑获得性耐药中的潜在作用。
1 材料和方法
1.1 菌株、试剂和培养基
阿萨希毛孢子菌临床标准株CBS 2479购自荷兰CBS真菌生物多样性中心,近平滑念珠菌ATCC 22019由北京大学第一医院真菌研究中心馈赠。环孢素、氟康唑、伊曲康唑、伏立康唑和RPMI 1640培养购自美国Sigma-Aldrich公司。YPD液体培养基(1%酵母提取物、2%蛋白胨和2%葡萄糖)自行配制。
1.2 氟康唑诱导耐药及抗真菌药物敏感性实验
标准株CBS2479分别进行氟康唑梯度浓度联合环孢素固定浓度(1 μg/ml)诱导(A组)、氟康唑梯度浓度诱导(B组)、环孢素固定浓度(1 μg/ml)诱导(C组),每组3个重复;氟康唑梯度浓度为初始0.25 μg/ml逐渐翻倍增加直至 128 μg/ml(每次接种后当菌液浓度达到0.5麦氏单位时进行转种),同时设置空白对照组(培养基中无氟康唑及环孢素)(D组);诱导阶段每代菌株均检测氟康唑最小抑菌浓度(MIC)值,诱导终点检测诱导耐药株对3种常用唑类抗真菌药的敏感性。之后,在无药YPD培养基中对获得的氟康唑耐药株进行20次传代(每四代检测1次菌株氟康唑MIC值),观察耐药表型的稳定性。根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的标准M27-A3肉汤稀释法,使用96孔板(costar)检测上述菌株的体外抗真菌活性(MIC值)。35℃下孵育48 h后读取结果。
2 结果
2.1 诱导耐药

表1 4组诱导阶段菌株对氟康唑的敏感性
经过氟康唑梯度浓度诱导培养,A组(氟康唑梯度浓度联合环孢素固定浓度诱导)获得3株氟康唑耐药株,氟康唑MIC值上升了8~16倍(16~32 μg/ml); B组(氟康唑梯度浓度诱导)也获得3株氟康唑耐药株,氟康唑MIC值上升了32倍(均为64 μg/ml); C组(环孢素固定浓度诱导)和D组(空白对照)未获得耐药株,氟康唑MIC值与初始菌株一致(表1)。诱导终点对6株耐药株进行3种唑类抗真菌药敏感性检测发现,A组耐药株与初始相比,伊曲康唑MIC值上升了4~8倍(1~2 μg/ml),伏立康唑MIC值上升了2倍(0.25 μg/ml);B组耐药株与初始相比,伊曲康唑MIC值上升了8~16倍(2~4 μg/ml),伏立康唑MIC值上升了2~4倍(0.25~0.5 μg/ml)(表 2)。
2.2 耐药表型稳定性
获得的氟康唑耐药株分别在无药培养基中进行20次连续传代,并对氟康唑敏感性进行检测;研究发现,随着传代次数的增多,A组耐药株对氟康唑的耐药表型不稳定,经过20次传代后最终氟康唑MIC值恢复或接近初始状态,且终点时菌株对伊曲康唑和伏立康唑的MIC值也恢复或接近初始状态;而B组耐药株对氟康唑的耐药表现稳定,经过20次传代后最终氟康唑、伊曲康唑及伏立康唑MIC值均未见明显变化(表2、3)。
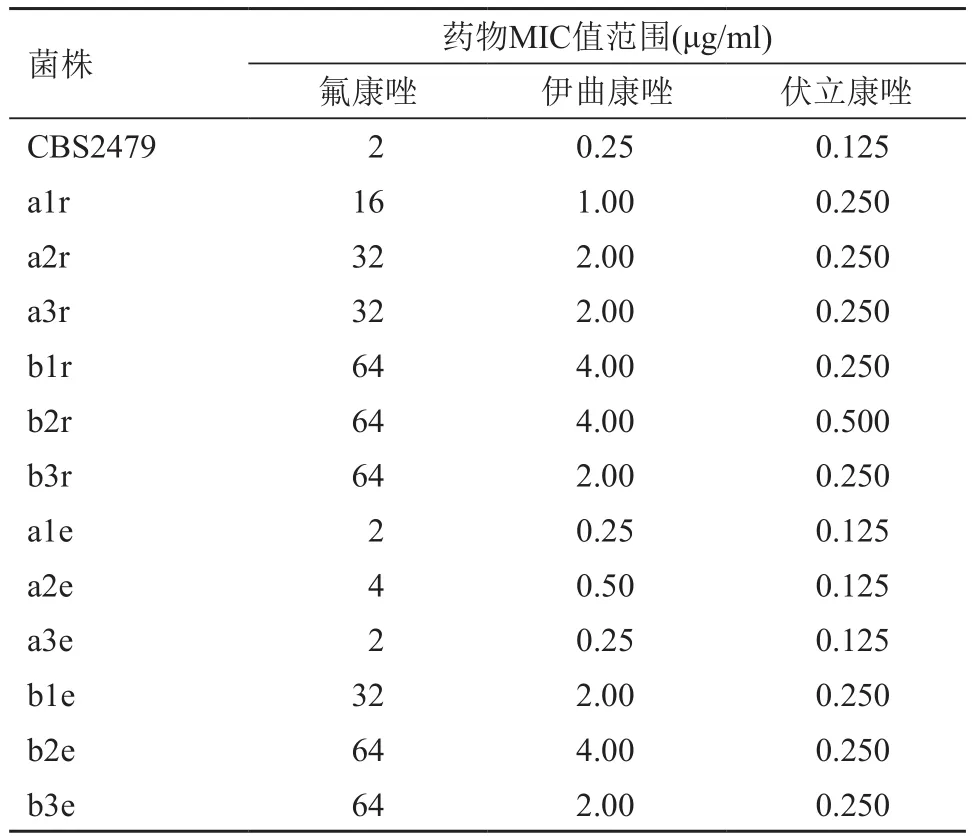
表2 诱导后及无药传代后菌株对3种唑类药敏敏感性
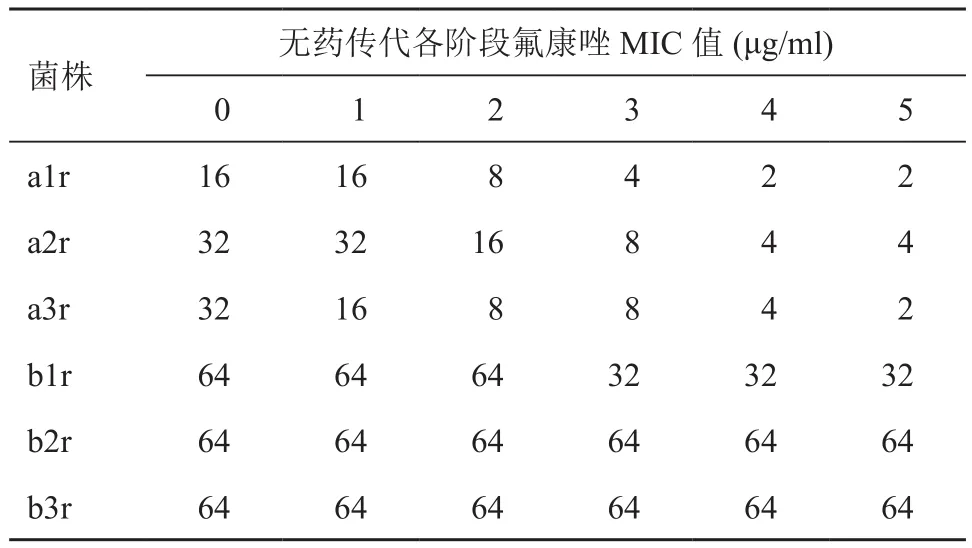
表3 诱导耐药株氟康唑耐药表型稳定性
3 讨论
近年来随着免疫抑制人群的不断增多,深部真菌感染的发病率也有上升趋势;对全球近40年毛孢子菌菌血症报道文献的流行病学分析发现,毛孢子菌菌血症的报道也逐年增多[2]。侵袭性毛孢子菌病虽然目前发病率仍较低,但病死率高[1],且2014年指南仅推荐三唑类抗真菌药作为首选方案[4];三唑类抗真菌药属于抑菌药,临床长期使用可能出现诱导耐药的现象,既往已在其他病原真菌(念珠菌属和曲霉属)中被报道[14]。近年来临床也有分离到阿萨希毛孢子菌唑类耐药株的报道[6,7,15];日本的一项体外实验也验证了在氟康唑梯度浓度诱导下,阿萨希毛孢子菌出现敏感性降低的现象,且认为该耐药表型与该菌ERG11基因突变相关,但出现突变的机制尚不明确[5]。
钙调磷酸酶作为Hsp90的一种客户蛋白,已被证实是病原真菌细胞内稳态重要的调节因子,唑类抗真菌药抑制病原真菌的麦角固醇合成,影响细胞膜完整性,导致在应激压力下出现适应性应答反应;研究发现钙调磷酸酶信号通路与其抗真菌药耐药密切相关[16]。既往研究发现,当钙调磷酸酶催化亚基Cna1p基因突变、调节亚基Cnb1p突变或钙调磷酸酶抑制剂存在时,念珠菌的钙调磷酸酶的活性会被减弱,进而降低了念珠菌对常见唑类药物(氟康唑和伏立康唑)以及棘白菌素类药物的耐受性[16]。同时,钙调磷酸酶的减少以及游离细胞中Mkc1基因表达的减少可影响病原真菌的非特异性耐药[9]。
体外药敏研究发现,钙调磷酸酶抑制剂(环孢素或他克莫司)联合唑类抗真菌药后,念珠菌属、曲霉属和隐球菌属的临床敏感或耐药分离株对唑类抗真菌药的敏感性增加,显示出不同程度的协同效应[17]。一项念珠菌性心内膜炎的小鼠模型研究发现,接受氟康唑联合环孢素治疗方案的小鼠预后明显优于其他单药治疗组,包括氟康唑、两性霉素B或环孢素[18]。笔者既往的研究也发现,对于阿萨希毛孢子菌临床分离株,环孢素显示出与5种常用抗真菌药(氟康唑、伊曲康唑、伏立康唑、两性霉素B和卡泊芬净)不同程度的协同效应[13];另一项研究也同样发现,联合他克莫司可明显提高阿萨希毛孢子菌临床株对两性霉素B和卡泊芬净的体外敏感性[12]。本研究发现,梯度浓度诱导可获得阿萨希毛孢子菌耐药株(氟康唑MIC值为64 μg/ml),且诱导耐药株对伊曲康唑和伏立康唑的MIC值也出现一定程度升高,说明出现了一定程度的交叉耐药现象;但如果在梯度浓度诱导的全程给予固定浓度的钙调磷酸酶抑制剂(环孢素),诱导株的MIC值升高相对较慢,且最终不超过32 μg/ml,该组诱导耐药株对伊曲康唑和伏立康唑的MIC值虽然也出现升高,但低于单药诱导组;上述结果说明阻断钙调磷酸酶可部分阻断氟康唑应激压力引起的适应性耐药表型,但未能完全阻断,说明环孢素阻断的钙调磷酸酶通路应答反应可能被其应激反应通路有所代偿[19],既往针对白念珠菌的体外外诱导耐药研究也获得了类似的结果[10]。
同时,在脱离药物应激压力环境(无药培养基传代)后,单独氟康唑梯度浓度诱导获得的耐药株对氟康唑的耐药表型稳定,且与其他2种唑类抗真菌药的表型也较为稳定;但给予固定浓度的环孢素联合氟康唑梯度浓度诱导所获得的耐药株,在无药物压力反复传代后,原有耐药表型基本转复,对于氟康唑、伊曲康唑和伏立康唑的MIC值基本恢复到诱导前的初始值;上述现象说明,钙调磷酸酶抑制剂可部分阻断阿萨希毛孢子菌的适应性耐药表型,其他通路调控的耐药表型相对不稳定(如ERG11和外排泵适应性表达上调)[19],脱离抗真菌药应激压力后可出现转复。因此,钙调磷酸酶在阿萨希毛孢子菌对氟康唑的适应性耐药中发挥了一定作用。同时,应用钙调磷酸酶可以抑制获得性耐药现象的发生,且即使出现一定的适应耐药表型,该表型在去除药物应激压力后可出现转复,所以该方式可能是减少长期应用氟康唑出现阿萨希毛孢子菌耐药的潜在策略。
综上所述,本研究的结果证明抑制钙调磷酸酶活性可阻断长期应用氟康唑所诱导出现的阿萨希毛孢子菌耐药现象。然而,需要进一步研发出选择性更高,对宿主免疫功能无影响的钙调磷酸酶抑制剂进行体内和相关机制研究,使得将来临床应用成为可能。
