MSN4基因的过表达对酿酒酵母耐受性的影响研究
2018-11-03董胜胜王鹏飞付肖蒙肖冬光
董胜胜,李 潇,王鹏飞,付肖蒙,肖冬光,董 健*
(天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457)
酵母多数普遍存在于富含糖类的环境(如水果、蔬菜、花蜜和植物分泌物中,以及果园和部分富含石油的土壤)中。目前最常见且应用最为广泛的酵母菌种当属酿酒酵母(Saccharomyces cerevisiae)。酿酒酵母是一种单细胞真核微生物,形态多为球形、椭圆形、卵圆形及腊肠形,其个体大小也会随菌种的不同而有所差异[1],但比细菌的单细胞个体要大的多,一般为1~5 μm或5~20 μm,其细胞的长宽比例为1~2左右。而温度是酵母细胞代谢活动重要的影响因素,一般来说,28~30℃是其最适生长温度,30~33℃是其最适发酵温度[2]。不但酵母细胞的生长繁殖会受温度的影响,而且酵母细胞细胞膜的组成成分也受温度的影响[3]。如麦角固醇[4]、饱和及不饱和脂肪酸[5]、磷脂酰胆碱[6]等细胞膜成分会发生改变,这些成分的改变共同使酵母细胞在高温状态下保持膜的流动性。ASKWITH C等[7]研究表明,铜离子环境中SOD1酶能让酵母细胞具有高温耐受性,在39℃条件下SOD1酶缺失菌株不能生长,过量添加铜离子也不能使其回复生长。这种情况说明超氧化歧化酶(superoxide dismutase,SOD)在酵母细胞高温耐受性方面起着重要的作用。HASLBECK M等[8]研究发现,热休克蛋白(heatshock protein,Hsp)与细胞的耐热性也有联系。研究表明,热休克蛋白是组成型和诱导型的高温响应蛋白的统称。热休克蛋白充当分子伴侣的角色,起促进蛋白质的重新折叠、修复受损蛋白、降解多余基质的作用。
在转录水平上,热休克蛋白调控酵母的应答机制,提高细胞的高温耐受性。SANCHEZY等[9]过量表达基因HSP104,提高了酵母细胞的高温耐受性。另外,研究发现主要因为热休克蛋白修复蛋白时,海藻糖起到了协助作用[10-11],才使其能够保护细胞。越来越多的研究表明环腺苷酸(cyclic adenosine monophosphate,cAMP)信号通路中的CYR1基因、蛋白激酶A(protein kinase A,PKA)[12]等活性的改变也能提高细胞的高温耐受性。cAMP信号通路在调控酵母细胞代谢、增殖、分化及压力抗性的获得过程中具有重要的作用[13-15]。而cAMP信号通路对酵母细胞的胁迫抗性具有很大的调节作用,MSN4基因属于cAMP信号通路中的压力调控因子,cAMP信号通路活性的提高就会抑制一些与压力响应元件相关基因的表达,其中转录因子Msn4对压力响应元件相关的一些基因的表达是必须的,是cAMP信号通路抑制压力响应相关基因表达的靶标[16-18]。Msn4是锌指蛋白,在对温度敏感型snf1突变株多拷贝抑制物进行分离的过程中得到MSN4基因,它可直接或间接的影响胞内cAMP水平,进而影响蛋白激酶A(PKA)的活性。有大量文献表明,蛋白激酶A活性的高低与菌株的耐温性呈现负相关,蛋白激酶A活性高的菌株具有较低的胁迫耐受性。这些基因的过表达还可能与酵母细胞的其他耐受性有关,如细胞的耐高渗透压、高乙醇及高乙酸等。Msn4这个反式作用元件在压力反应元件(stress response element,STRE)介导的基因表达方面发挥作用。当MSN4过量表达时可以抑制突变snf1基因的热敏性[19]。
本研究以实验室菌株AY12a为出发菌株,通过胞内同源重组法,利用基因工程操作手段将PGK1p启动子插入MSN4基因的N端,接着进一步筛选验证得到改造后的菌株AY12a-msn4,从生长性能,高温、15%乙醇的耐受性、6%NaCl和5%乙酸等指标考察突变株的综合耐受性的改变,同时将突变株与出发菌株进行玉米高温浓醪发酵实验,并测定发酵完成后的酒度、残糖、48 h细胞存活率、CO2失重和发酵时间。比较突变株及亲本菌株的发酵性能,研究过表达基因对酿酒酵母浓醪发酵性能的影响。构建出一株高耐性菌株AY12a-msn4,不仅可以提高人们对酿酒酵母耐受性的认识,而且可用于工业生产中,增加原料的利用率,可获取更大的效益。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
本研究所使用的酿酒酵母菌株及获得的突变株见表1。

表1 实验所使用的菌株Table 1 Strains used in this experiment
1.1.2 酶和试剂
r Taq DNA聚合酶:大连TaKaRa公司;尿嘧啶:北京泛基诺科技有限公司;α-淀粉酶(150 000 U/mL)、糖化酶(290 000 U/mL)、酸性蛋白酶(100 000 U/mL):诺维信(中国)投资有限公司。
葡萄糖(分析纯):天津市永大化学试剂开发中心;酵母浸粉(生化试剂):北京奥博星生物技术有限公司;胰蛋白胨(生化试剂):天津市英博生化试剂有限公司;琼脂粉(生化试剂):北京索莱宝科技有限公司。其余试剂均为进口或国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:20g/L葡萄糖,20g/L蛋白胨,10g/L酵母浸粉。
合成缺陷(synthetic dropout,SD)培养基:20g/L葡萄糖,6.7 g/L无氨基酵母氮源(yeast nitrogen base,YNB),1.3 g/L尿嘧啶。
耐盐培养基:20 g/L葡萄糖,20 g/L蛋白胨,10 g/L酵母浸粉,NaCl 60 g/L。
耐乙醇培养基:20 g/L葡萄糖,20 g/L蛋白胨,10 g/L酵母浸粉,加入15 mL/L的无水乙醇。
耐乙酸培养基:20 g/L葡萄糖,20 g/L蛋白胨,10 g/L酵母浸粉,5 mL/L的乙酸。
醋酸钾(potassium acetate,KAC)生孢培养基:20 g/L的醋酸钾,用蒸馏水定容至100 mL。
上述培养基pH自然,用蒸馏水定容至100 mL,在1.0×105Pa条件下115℃灭菌15~20 min,另外固体培养基额外添加20 g/L的琼脂。
1.2 仪器与设备
TGL-16C台式离心机:上海安亭科技仪器厂;UVmini-1240岛津紫外分光光度计:岛津仪器(苏州)有限公司;GL20A型高速冷冻离心机:中科院生物物理所技术服务公司;PCT-200型聚合酶连反应(polymerase chain reaction,PCR)基因扩增仪:美国BIO-RAD公司;Gel Logic212全自动凝胶成像仪:美国SYN gENE公司;AB204-S型分析天平:梅特勒-托利多仪器上海公司;LRH-250A型生化培养箱:上海博迅实业有限公司;BX43奥林巴斯生物显微镜:日本OLYMPUS会社;博欧特血球计数板:上海求精生化试剂有限责任公司。
1.3 方法
1.3.1 引物的设计与合成

表2 PCR引物设计Table 2 Design of PCR primer
1.3.2 基因过表达组件的构建

图1 过表达MSN4基因的构建过程Fig.1 Construction process of overexpression of MSN4 gene
本实验以MSN4基因作为靶基因,野生型酿酒酵母工业菌株AY12a为亲本菌株,URA3基因为筛选标记,在MSN4基因的N端加入强启动子PGK1p,以实现MSN4基因的过表达。同时设计4对引物,PCR扩增获得带有同源臂的4个片段,即MSN4上同源臂片段(其3'端含有URA3序列5'端同源序列)、URA3片段(其5'端含有MSN4序列3'端同源序列、其3'端含有PGK1序列5'端同源序列)、PGK1片段(其5'端含有URA3序列3'端同源序列、其3'端含有MSN4下同源臂片段5'端同源序列)、MSN4下同源臂片段(其5'端含有PGK1序列3'端同源序列)。将4个扩增片段进行PCR纯化回收,利用醋酸锂转化法将纯化后的片段导入到受体菌株AY12aΔU(URA3基因突变菌株)完成同源序列之间的同源重组,转化产物涂布于省却尿嘧啶的SD培养基上,生长2~3d后得转化子,单菌落进行纯化,精提基因组并以此为模板进行PCR。由于受体菌株AY12aΔU含有突变的URA3基因,经醋酸锂化转后同源重组正确的转化子在SD培养基上可以生长,以此筛选正确转化子。AY12a-msn4突变株的构建过程见图1。
1.3.3 酿酒酵母细胞生长曲线的测定
本实验采用全自动生长曲线测定仪测定OD600nm值,操作步骤如下:挑取斜面菌种1环接至5 mL YEPD液体培养基中,30℃、180 r/min培养12 h;吸取上述培养好的菌液40 μL接入装有360 μL液体YEPD培养基的100孔板的孔中,将100孔板置于设定的温度下培养,以YEPD液体培养基为空白对照,每隔0.5 h测定波长600 nm处的OD600nm值,以时间为横坐标,OD600nm值为纵坐标,绘制生长曲线。
1.3.4 酿酒酵母细胞耐受性的测定
从斜面挑取一环酵母菌泥,接入5 mL YEPD液体培养基中,30℃、180 r/min条件下培养过夜。测OD600nm值,取适量菌液转接入5 mL新鲜YEPD液体培养基中,使其初始OD600nm值为0.15。将上述细胞培养4~6 h至生长对数期,测量OD600nm值,用YEPD液体培养基调整所有细胞OD600nm值为1.0,以保证所有细胞初始菌体浓度一致。移液枪分别移取100 μL的菌液于1.5 mL离心管中,实验组用55℃水浴4 min热击处理,对照组不做任何处理。
将实验组和对照组分别用无菌水稀释相同的浓度梯度,按照浓度递减的顺序,每个稀释度分别取2 μL的菌液整齐的滴于YEPD固体培养基、耐盐培养基、耐乙醇的培养基、耐乙酸培养基平板上,超净台晾干后,封口膜封好倒置于30℃条件下恒温培养箱中培养1~3 d,观察菌体的生长,比较不同菌株的耐热、耐盐、耐乙醇及耐乙酸情况。
1.3.5 玉米浓醪发酵
召开会议是部署、落实和推动党委和政府工作的惯常手段,但开会过多过滥,会导致行政效率下降,形式主义抬头,工作作风漂浮。中央的八项规定,其中明确要求精简会议活动,切实改进会风;但“文山会海”现象在一些地方和部门屡禁不绝。这其中难免有官僚主义思想作祟,觉得开会才算重视,才是部署工作应有的仪式。
(1)玉米水解液的制备
称取1 500 g的玉米粉,并向其加入4 500 mL 65~70℃的自来水放置20min,让玉米颗粒充分吸水膨胀,然后加入液化酶0.9 mL,在85~90℃水浴液化1.5 h,然后加入糖化酶3 mL于60℃水浴20 h。最后将糖化液用3层滤布过滤及可得到澄清的滤液,即为玉米水解液,煮沸灭菌后可用。
(2)种子培养基的制备
一级种子培养:调玉米水解液糖度为8°Bx,分装各5mL,同时加入酵母粉0.5%,煮沸15~20 min,冷却至室温后接10%的菌液,30℃条件下静置24 h。
二级种子培养:稀释玉米水解液糖度为12°Bx,每组取45 mL同时加入酵母粉0.5%,经过煮沸15min后,冷却后把一级种子液倒入二级培养液中,30℃条件下静置培养16 h。
(3)玉米浓醪发酵
称量60 g玉米粉于250 mL三角瓶中,加入130 mL 60~70℃的水,放置20 min糊化后加入耐高温α-淀粉酶0.03mL,混匀后升温至85~90℃液化1.5h,再降温至55~60℃,加入液化酶0.09 mL及营养盐1 mL,糖化20 min后,降温至40℃加入1.2mL的酸性蛋白酶反应20min,然后降温至30℃接菌5mL,每组需3个平行实验。从接菌后,每12 h称质量一次,直至两次称质量的差<1 g则可停止发酵,进行蒸馏。
1.3.6 分析检测
利用酒精比重计来对酒精产量进行测定;采用斐林试剂法对发酵完成后的还原糖进行测定;采用血球计数板进行细胞计数测定细胞存活率,其计算公式如下:

式中:X为酿酒酵母发酵48 h后细胞存活率,%;C1为血球计数板中经过次甲基蓝染色剂染色后着色的细胞数,个;C2为血球计数板中全部的细胞数,个。
2 结果与分析
2.1 目的片段的扩增
以亲本菌株AY12a为模板,利用引物对MSN4上同源臂U和MSN4上同源臂D、MSN4-URA3U和MSN4-URA3D、MSN4-PGK1p U和MSN4-PGK1p D、MSN4下同源臂U和MSN4下同源臂D进行PCR扩增带有部分同源的4个基因片段,其片段长度大小见图2。由图2可知,泳道1~4依次为825 bp、848 bp、1 519 bp、1 918 bp,与预期片段大小一致,可用于下一步实验。

图2 带有同源臂的MSN4片段扩增验证电泳图Fig.2 Electrophoretogram of amplification verification of MSN4 fragment with homologous arm
2.2 突变株的获得与验证
提取阴性对照AY12a基因组及验证正确的菌株基因组,分别利用验证引物进行验证。可以利用引物对验证MSN4基因上的同源臂-URA3U和验证MSN4上的同源臂-URA3D、接着可以验证PGK1p-MSN4U和验证PGK1p-MSN4D、验证URA3-PGK1p U-MSN4和验证URA3-PGK1pD-MSN4进行过表达MSN4基因菌株进行定点验证,结果见图3。由图3可知,MSN4基因扩增出大小为1 021 bp、2 921 bp、1 433 bp的特异性片段,与预期大小一致,且阴性对照PCR后无此条带,说明AY12a-msn4突变株已成功构建。
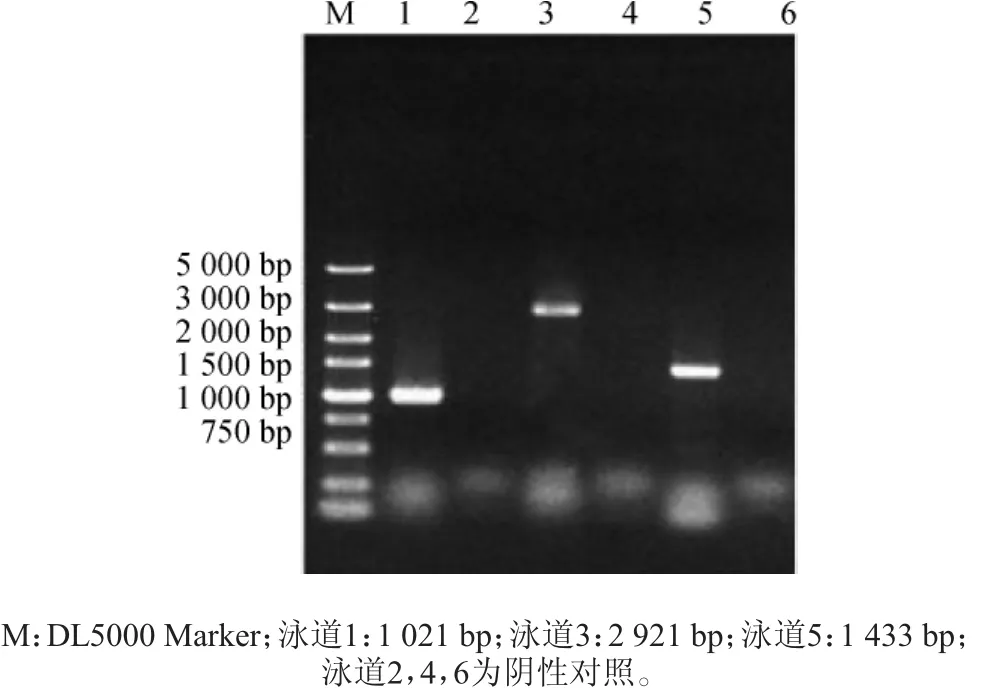
图3 定点PCR验证MSN4电泳图Fig.3 Electrophoretogram of verification of MSN4 by site-directed PCR
2.3 细胞融合生孢
采用标准AY12α型单倍体与改造后的突变菌株AY12amsn4进行杂交融合,生成二倍体,将生成的二倍体进行扩大培养,涂布在KAC生孢培养基上进行生孢,分离单倍体,对分离出来的单倍体进行三引物验证和引物对验证MSN4上同源臂-URA3U和验证MSN4上同源臂-URA3D、验证PGK1p-MSN4和验证PGK1p-MSN4D、验证URA3-PGK1pUMSN4和验证URA3-PGK1pD-MSN4,以获得α型突变株AY12α-msn4。根据以上结果,将分离出来的各个单倍体用过表达基因的验证引物对分离出来的单倍体进行PCR验证,结果见图4。由图4可知,泳道1~3是验证过表达MSN4基因的片段,片段大小分别是1 021 bp、2 921 bp和1 433 bp。PCR结果均与a型突变株的PCR结果相一致,说明成功获得α型突变株AY12α-msn4。

图4 菌株AY12α-msn4的PCR验证电泳图Fig.4 Electrophoretogram of PCR verification of strain AY12α-msn4
2.4 酿酒酵母基因突变株与亲本菌株生长性能的比较
对亲本菌株AY12a-msn4突变菌株根据1.3.3所示方法进行生长曲线的测定。挑取一环AY12a和AY12a-msn4菌泥接种于5 mL YPED液体培养基中,过夜培养后,然后对亲本菌株和突变株在30℃和40℃条件下进行生长曲线的测定,结果见图5。

图5 突变菌株和原始菌株在30℃(A)及40℃(B)条件下的生长曲线Fig.5 Growth curves of the mutant and the original strains under 30℃(A)and 40℃(B)conditions
由图5可知,在30℃的培养条件下AY12a-msn4与亲本菌株AY12a的生长速度相比,生长性能基本一致;当生长温度改为40℃时,高温对突变株AY12a-msn4的生长影响较大,较亲本菌株AY12a菌体浓度没有明显的提高,且生长对数期延长,由于所测样品菌液都稀释了10倍,故生长15 h后,理论上菌浓OD600nm值可达到1.5左右。具体的生长情况需要用玉米高温浓醪发酵验证。
2.5 酿酒酵母基因突变株与亲本菌株耐受性的比较
按照材料与方法中1.3.4中所描述的方法测定出发菌株AY12a以及突变菌株AY12a-msn4在55℃热击4 min处理,在15%(V/V)的乙醇、6%的NaCl及5%(V/V)乙酸的胁迫环境下进行耐受性分析,结果见图6。
由图6可知,在没有生长压力的YEPD平板上,出发菌株AY12a和突变株AY12a-msn4的生长情况基本上是一致的,可见用做耐受性实验的出发菌株以及突变菌株的初始菌体浓度基本上保持是一致的。在55℃热击4 min处理造成的环境压力下,出发菌株AY12a和突变菌株的生长都受到了很大程度的抑制。但相比出发菌株,在相同的稀释倍数下,AY12a-msn4的菌落数较多,说明其热击抗性强于出发菌株并且优于出发菌株AY12a;在15%(V/V)的乙醇和6%的NaCl造成的环境压力下,相同的稀释倍数下,AY12a-msn4和突变株的菌落数均低于原菌;在5%(V/V)乙酸造成的环境压力下,相比出发菌株AY12a,突变菌株AY12a-msn4没有较大的变化,说明5%(V/V)的乙酸对这些突变株的生长没有协迫性。

图6 突变菌株和原始菌株的耐受性Fig.6 Tolerance of the mutant and the original strains
2.6 酿酒酵母基因突变株与亲本菌株的玉米原料高温浓醪酒精发酵

表3 突变菌株的发酵性能和细胞存活率Table 3 Fermentation performance and cell survival rate of the mutant strain
将改造后的菌株AY12a-msn4和出发菌株AY12a进行玉米高温浓醪发酵。待发酵进行48 h后,将发酵液摇匀,取样液,用3层纱布滤去玉米渣,用无菌水稀释至合适倍数,进行次甲基蓝染色后,放大倍数×400显微镜下检测48 h细胞存活率。待发酵完成后,测定发酵液中乙醇含量,按照方法测定发酵液中残糖的含量,结果见表3。
由表3可知,在38℃浓醪发酵中,突变株AY12a-msn4酒精度相比出发菌株AY12a提高了3.85%,表明其出酒率得到提升;残糖含量下降14.5%,说明改造菌的发酵性能较好,对原料的利用率高;48 h主发酵完成后的细胞存活率提高了72%。正常酿酒酵母的发酵时间为72 h[20],而改造菌AY12a-msn4发酵时间延长了12 h,与生长曲线测定的结果一致。酵母细胞发酵时间的延长,常伴随着细胞耐受性的增加,比如高乙醇、高温、高渗透压等,但AY12a-msn4突变株没有取得预期的效果,可能是由于菌株自身的遗传背景和特异性所导致的。
3 结论
本研究以实验室现有菌种AY12a为出发菌株,URA3基因为筛选标记,通过基因操作来实现MSN4基因的过表达,即提高该基因的表达活性,从而可成功构建过表达MSN4基因的突变菌株AY12a-msn4。然后对突变株AY12a-msn4进行耐受性的测定,发现突变株AY12a-msn4对高温有一定的耐受性。同时将突变株与出发菌株AY12a进行玉米原料高温浓醪发酵实验,并测定发酵完成后的各个参数。突变株AY12a-msn4的乙醇含量较出发菌株AY12a提高了3.85%,48 h细胞存活率提高,残糖含量下降。因此构建的菌株AY12a-msn4可以作为工程菌株,运用于发酵行业。
