基因重组毕赤酵母产蛋清溶菌酶发酵工艺及表达条件的优化
2018-11-03宋增健王向东
宋增健,薛 松,王向东,林 剑*
(1.烟台大学 生命科学学院,山东 烟台 264000;2.山东大学 应用生命科学研究院,山东 济南 250000)
自从1907年Nicolle发现枯草芽孢杆菌(Bacillus subtilis)中含有溶解因子开始,溶菌酶渐渐进入人们的视野[1]。作为一种抗菌剂,它可以切断细胞壁肽聚糖中的N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键,破坏肽聚糖结构,使菌体在渗透压作用下裂解死亡[2]。由于溶菌酶特殊的抑菌机理,不会使细菌产生抗药性,从而可以缓解日益严重的抗生素滥用问题[3];作为一种天然、安全的抗菌剂,溶菌酶广泛的应用于食品和药品行业[4],市场前景广阔。联合国粮食及农业组织(Food and Agriculture Organization,FAO)/世界卫生组织(World Health Organization,WHO)食品添加剂协会在1992年公布:溶菌酶应用在食品工业中是安全、无害的;2010年,我国卫生部第23号公告中,批准溶菌酶可以作为添加剂应用在食品中[5]。目前,国内市场上应用的溶菌酶主要是从鸡蛋清中分离提取,原料成本高,限制了蛋清溶菌酶的广泛应用[6]。因此,采用其他方法提高蛋清溶菌酶表达量非常具有研究价值。
巴斯德毕赤氏酵母(Pichia pastoris)作为一种高效、稳定的外源蛋白表达系统,具有操作简易、遗传稳定性高、胞外蛋白表达量相对较高等优点,在外源基因表达领域得到了广泛的应用[7-10]。巴斯德毕赤氏酵母作为外源基因表达的载体,自身分泌的杂蛋白较少,分离纯化成本降低[11]。目前,国内关于基因重组溶菌酶发酵条件的研究还处于探索阶段,朱德伟[12]利用毕赤氏酵母(P.pastoris)表达基因重组溶菌酶,最高产量仅有166.9 mg/L,与国外MASUDA T等[13]报道的最高表达量400 mg/L相差巨大。除了菌种构建的问题,培养基和发酵条件的优化对最终的表达结果也有很大的影响[14]。因此,优化蛋清溶菌酶的表达条件,对提高目的蛋白的表达量有重要的意义。
本研究采用山东大学构建的一株甲醇诱导型蛋清溶菌酶基因重组毕赤酵母NCY-2为研究对象。孙玮遥等[15]曾在摇床水平对其进行了较为系统的研究。研究结果表明,在最佳表达条件下,摇床水平最高酶表达量为775 U/mL。虽然比优化之前提高了2.2倍,取得了一定的研究成果,但是该发酵水平尚达不到工业化生产的要求。因此,本研究在孙玮遥等[15]的基础上,采用廉价且营养丰富的麦芽汁为培养基[16]。在摇瓶水平上优化菌株NCY-2生长和表达条件,以期进一步提高摇床水平发酵液中蛋清溶菌酶酶活力。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
甲醇诱导型蛋清溶菌酶基因重组毕赤氏酵母(Pichia pastoris)NCY-2:山东大学应用生命科学研究中心构建,本实验室保存。
1.1.2 材料
麦芽:澳大利亚大麦芽。
原麦芽汁:本实验室制备,麦芽汁制备工艺见1.3.2。主要成分为还原糖(80±2)g/L、α-氨基酸态氮(500±5)mg/L。
1.1.3 培养基
斜面培养基:酵母浸粉10 g/L、胰蛋白胨20 g/L、葡萄糖20 g/L、琼脂20 g/L。pH自然,121℃灭菌20 min。
种子培养基:将原麦芽汁与水按体积比1∶1稀释,制成种子培养基。
生长培养基:同种子培养基。
1.1.4 试剂
溶菌酶测试盒(30T/28样):南京建成生物工程研究所;其余试剂均为分析纯。
1.2 仪器与设备
100 L四器糖化设备:山东中德啤酒设备有限公司;G180TW全自动高压灭菌器:致微(厦门)仪器有限公司;LRH-250生化培养箱:上海一恒科学仪器有限公司;SW-CJ-2FD超净工作台:苏洁净化设备有限公司;SPH-2102B恒温振荡培养箱:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 种子液制备
配制种子培养基于500 mL锥形瓶中,装液量为20%,115℃灭菌30 min,冷却至室温接种,在30℃、200 r/mim的恒温振荡培养器中摇瓶培养24 h。
1.3.2 麦芽汁糖化工艺
糖化:全麦芽糖化,不添加任何辅料,料液比1∶4(g∶mL),采用两段浸出糖化法[17]。

1.3.3 普通锥形瓶与挡板锥形瓶对比
将原麦芽汁∶水=1∶1稀释后,分装于500 mL普通锥形瓶和500 mL挡板锥形瓶(内含挡板,混合效果更好,更有利于氧气的传递)中,115℃灭菌30 min冷却至室温接种,摇瓶培养24 h。
培养条件:温度30℃,pH值5.0,转速200 r/mim,装液量20%。
1.3.4 原麦芽汁稀释度的确定
将原麦芽汁与水的体积比分别按1∶0、1∶1、1∶2、1∶3、1∶4进行稀释,制成麦芽汁培养基,培养条件同1.3.3所述,在恒温振荡器中摇瓶培养24 h,检测菌体生长情况,确定原麦芽汁的最优稀释度。
1.3.5 外加氮源对菌株NCY-2的影响
以(NH4)2SO4和尿素为外加氮源,含量分别为:0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L,原麦芽汁与水的体积比为1∶1,培养条件按1.3.3所述,在恒温振荡器中摇瓶培养24 h,检测菌体生长情况,确定合适的外加氮源及其含量。
1.3.6 菌株NCY-2培养条件优化
根据上述优化结果,结合大量的文献资料[18-21]确定了温度、pH值、转速以及接种量的优化范围,以菌体浓度(Y)为考察指标,设计了U5(54)的均匀设计试验,设计方案如表1所示。
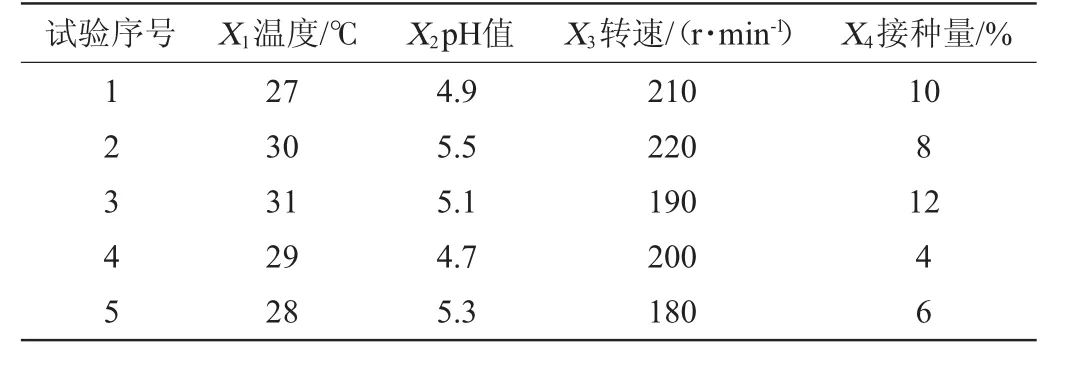
表1 菌株NCY-2发酵工艺优化均匀设计试验方案Table 1 Design of uniform experiments for strain NCY-2 fermentation technology optimization
1.3.7 甲醇添加方式对菌株NCY-2的影响
结合孙玮遥等[15]甲醇单因素试验以及参考大量文献[22-25]确定了甲醇的添加方式为定量添加、递增添加、倒序添加。菌株NCY-2按照1.3.6最优条件,于恒温振荡培养器中培养24h进行表达,表达条件:温度20℃,pH 4.0,转速200 r/mim,甲醇添加方式及添加量按表2所示。

表2 甲醇添加方式试验方案Table 2 Experimental scheme of methanol addition mode
1.3.8 菌株NCY-2表达条件优化
根据菌株NCY-2在麦芽汁培养基的培养情况,结合孙玮遥等[15]的研究数据,按照1.3.6最优条件进行恒温振荡培养24 h进行表达,甲醇添加方式按照1.3.7最优结果,以发酵液中蛋清溶菌酶酶活力(E)为考察指标,设计了U5(54)均匀设计试验,设计方案如表3所示。
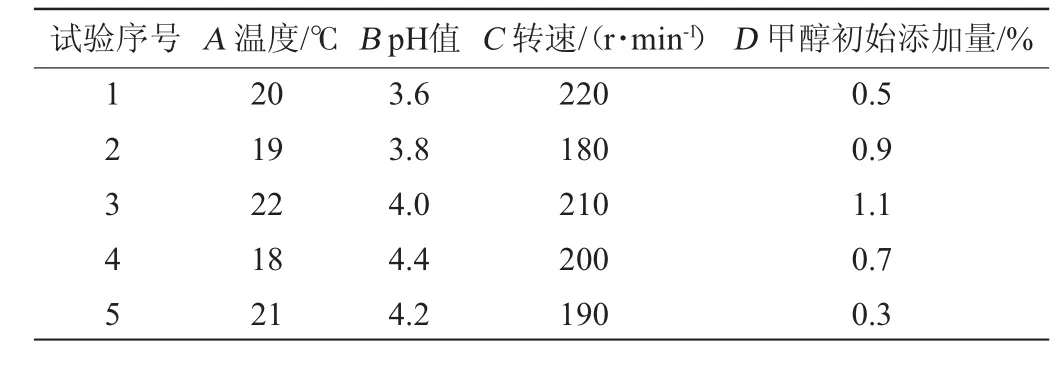
表3 菌株NCY-2表达条件优化均匀试验因素与水平Table 3 Factors and levels of uniform experiments for strain NCY-2 expression condition optimization
1.3.9 检测及数据处理方法
麦芽汁中还原糖的检测:廉爱农法[26]。
麦芽汁中α-氨基氮的检测:茚三酮显色法[27]。
发酵液中溶菌酶酶活力检测:发酵液离心,取上清液,以溶壁微球菌为底物,37℃水浴中反应15 min,于波长530 nm处测定吸光度值的变化值,以蒸馏水为空白对照,以溶菌酶标准品(200 U/mL)为参考,溶菌酶酶活力计算公式如下:

每组实验重复3次,数据采用DPS、Microsoft Excel分析,采用Origin 8.5.1软件绘图。
2 结果与分析
2.1 普通锥形瓶与挡板锥形瓶对比
菌株NCY-2在其生长和诱导过程中强烈需氧,发酵液中的溶氧浓度是影响菌体生长和产物表达的一个重要因素[28]。普通锥形瓶与挡板锥形瓶对菌株NCY-2菌体浓度的影响结果如图1所示。
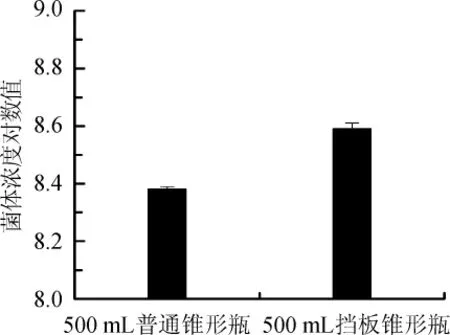
图1 普通锥形瓶与挡板锥形瓶发酵结果对比Fig.1 Comparison of fermentation results by conical bottle and baffle cone bottle
由图1可知,挡板锥形瓶的菌体浓度是普通锥形瓶的1.67倍,前者菌体浓度最高可达4.0×108个/mL,比普通锥形瓶更适合菌体生长。因此,选用挡板锥形瓶进行试验。
2.2 原麦芽汁稀释度对菌株NCY-2的影响
培养基的营养成分及其含量对菌株生长至关重要。为避免稀释度过低造成原料浪费,增加发酵成本;稀释度过高,菌体的生长得不到满足,本研究针对原麦芽汁的稀释度进行了探索。原麦芽汁稀释度对菌株NCY-2菌体浓度的影响结果如图2所示。
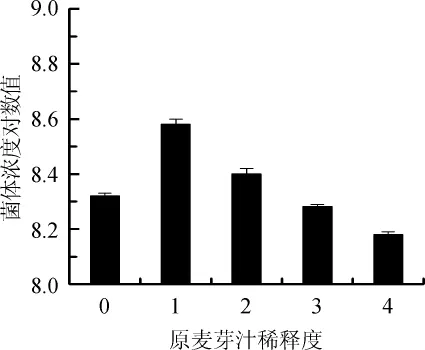
图2 原麦芽汁稀释度对菌株NCY-2生长的影响Fig.2 Effect of the dilution of original wort on strain NCY-2 growth
由图2可知,原麦芽汁∶水=1∶1时,菌体长势最好,菌体浓度最高可达4.01×108个/mL,是原麦芽汁∶水=1∶2的1.60倍,随着稀释倍数的增大,发酵液中的菌体浓度对数值减小,所以菌体浓度降低。全麦芽培养基培养时,菌体浓度只有2.14×108个/mL,是最高值的53%。因为此时发酵液中还原糖含量较高,发酵过程中次级代谢产物较多,抑制了菌体的生长。在保证菌株NCY-2生长的前提下,最大程度的节省发酵成本,因此确定原麦芽汁稀释度为1。
2.3 外加氮源对菌株NCY-2的影响
外加氮源的种类及其含量对菌株NCY-2菌体浓度的影响结果如图3所示。
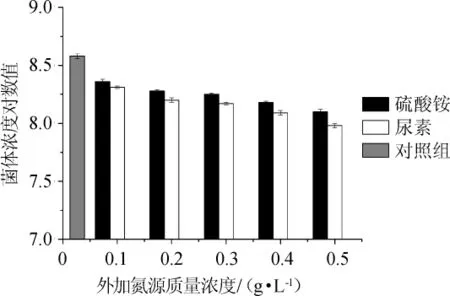
图3 外加氮源浓度对菌株NCY-2生长的影响Fig.3 Effect of additional nitrogen sources concentration on strain NCY-2 growth
由图3可知,随着(NH4)2SO4和尿素含量的增加,菌株NCY-2的菌体浓度呈明显的下降趋势,当(NH4)2SO4的质量浓度为0.1 g/L时,菌体浓度最高为2.32×108个/mL,仅为图2最优结果的58%。研究结果表明,外加氮源(NH4)2SO4和尿素不能改善NCY-2的菌体生长情况,过高的氮源含量反而限制了菌体的生长。因此确定麦芽汁培养基自身氮源能够满足菌株NCY-2的生长,不需要外加氮源。
2.4 菌株NCY-2生长条件优化结果
大量的研究结果表明[29-30],发酵温度、培养基pH、以及菌种接种量对菌体生长有重要影响,菌株NCY-2生长条件优化结果如表4所示。
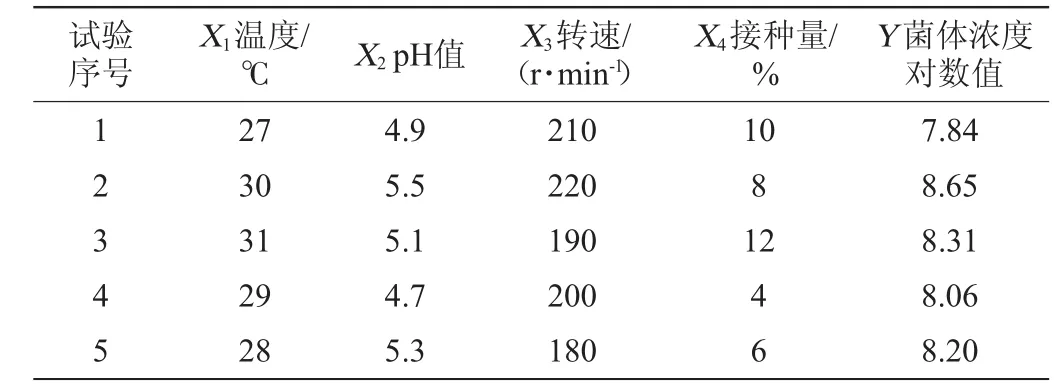
表4 菌株NCY-2发酵工艺优化均匀试验结果与分析Table 4 Results and analysis of U 5(54)uniform experiments for fermentation technology optimization of strain NCY-2
利用DPS软件,采用多因子及互作项逐步回归方法建立了菌体浓度对数值与各因素交互作用的回归方程:Y=4.693 11+0.021 10X1X2+0.000 10X1X3-0.000 86X1X4。多因子及互作项逐步回归分析的相关统计学结果如表5所示。

表5 菌体浓度对数值回归方程的统计学分析Table 5 Statistical analysis of bacterial concentration on numerical regression equation
相关系数R2=0.999 9,调整后的相关系数R2adj=0.999 5,总体显著性检验值F=1369.1369,显著水平P=0.0199<0.05,表示该模型具有显著的统计学意义;剩余标准差S=0.0094。由回归方程得到的最优发酵工艺条件:温度31.2℃、pH5.5、转速221 r/min、接种量4%,菌体浓度预测值Y=8.88。为便于实际操作,修正最优发酵工艺条件为温度31℃、pH5.5、转速220 r/min、接种量4%。在此优化条件下,摇瓶培养后发酵液中的实际菌体浓度可达4.79×108个/mL(即Y=8.68),高于试验组中的任何一组样本值,并且与预测值基本吻合。进一步验证了试验的合理性。
2.5 甲醇添加方式对菌株NCY-2的影响
由图4可知,不同的甲醇添加方式对菌株NCY-2的影响较大。甲醇定量添加方式中,蛋清溶菌酶酶活力随着甲醇浓度的升高先增加后减少,定量添加3(即甲醇添加量1.5%)时,酶活力最高为488.1U/mL,是定量添加4(即甲醇添加量2%)的1.33倍。递增添加时蛋清溶菌酶酶活力为646.6U/mL,是定量添加3(即甲醇添加量1.5%)的1.32倍。倒序添加仅为定量添加3(即甲醇添加量1.5%)的76%。研究结果显示,递增添加对菌株NCY-2影响最大,倒序添加抑制了菌株NCY-2的表达,蛋清溶菌酶酶活力最低。

图4 甲醇添加方式对菌株NCY-2的影响Fig.4 Effect of methanol addition modes on strain NCY-2
2.6 菌株NCY-2表达条件优化结果
菌株NCY-2表达条件优化结果见表6。
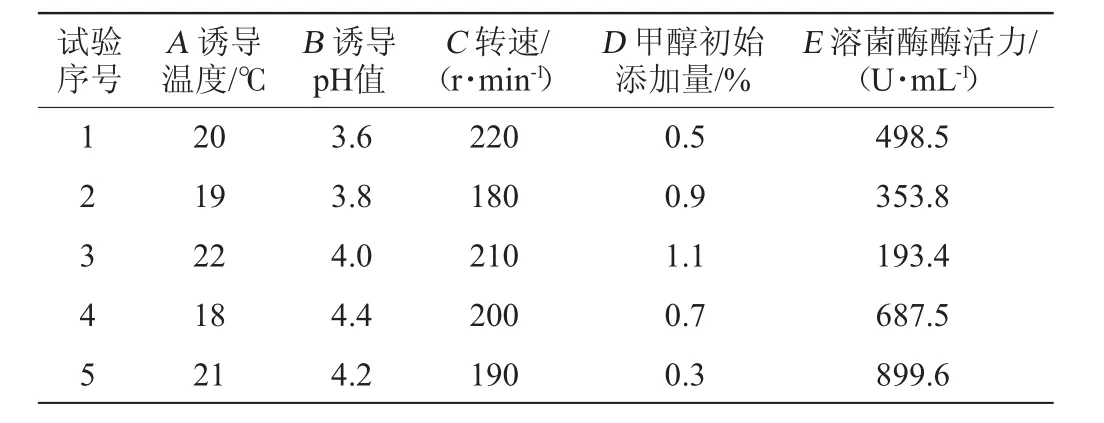
表6 表达条件优化均匀设计U5(54)试验方案及结果Table 6 Design and results of uniform experiments for expression conditions optimization
利用DPS软件,采用多因子及互作项逐步回归方法建立了溶菌酶活力与各因素交互作用的回归方程:E=858.62398+352.963 21B-733.581 82D-0.069 09AC。
多因子及互作项逐步回归分析的相关统计学结果如表7所示:
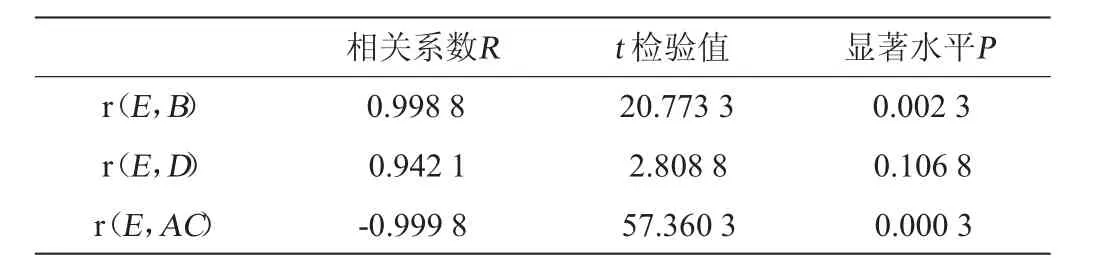
表7 溶菌酶酶活力回归方程的统计学分析Table 7 Statistical analysis of regression equation of lysozyme activity
相关系数R2=0.999 9,调整后的相关系数R2adj=0.999 6,总体显著性检验值F=1511.6115,显著水平P=0.0187<0.05,表示该模型具有显著的统计学意义;剩余标准差S=8.1162。由回归方程得到的最优表达条件为:温度18.3℃、pH 4.4、转速188.1 r/min、甲醇初始添加量0.3%,蛋清溶菌酶酶活力预测值Y=981.1。为便于实际操作,修正最优表达条件为温度18℃、pH 4.4、转速190r/min、甲醇初始添加量0.3%。在此优化条件,摇瓶培养后发酵液中蛋清溶菌酶酶活力实际值为962.4 U/mL,即Y=962.4,高于任何一组样本值,并且与预测值基本吻合。为实验的可靠性提供了理论依据。
菌株NCY-2利用甲醇作为唯一诱导剂来进行诱导表达。一方面,在诱导表达期间,甲醇可以作为碳源为菌体的生长代谢提供营养来源;另一方面,作为启动子在醇氧化酶的作用下,进行目的蛋白的分泌表达[31]。大量资料显示,利用甲醇诱导型重组毕赤酵母来进行诱导表达时,发酵液中的甲醇含量>3%时,会对菌体产生毒害作用[32]。本研究中,菌株NCY-2的最佳甲醇初始添加量为0.3%,之后每隔24 h分别添加体积分数1.0%、1.5%、2.0%,诱导72 h至酶活最高时结束,整个诱导过程甲醇含量始终低于3.0%,与上述资料研究结果相符合。
3 结论
本研究完善了前者试验中存在的一些不足。与BMMY/BMGY培养基相比,采用价格低廉、营养丰富的麦芽汁作为培养基,不仅解决了前者营养单一,高温灭菌容易产生沉淀等问题,而且极大地降低了发酵成本。麦芽汁培养基具有进一步放大培养的研究价值。
菌株NCY-2在生长阶段的最佳发酵工艺条件为发酵温度31℃、pH 5.5、转速220r/min、接种量4%,菌体浓度为4.79×108个/mL,是优化前的2.08倍;酶表达阶段的最佳表达条件为温度18℃、pH 4.4、转速190 r/min、甲醇初始添加量0.3%(之后每隔24 h分别添加体积分数1.0%、1.5%、2.0%,诱导72 h结束),蛋清溶菌酶酶活力为962.4 U/mL。
