化学反应速率和化学平衡易错题归纳
2018-11-03河南省郸城县第一高级中学
■河南省郸城县第一高级中学 刘 银
化学反应速率和化学平衡理论是重要的理论基础之一,它贯穿于整个中学化学之中。任何一个化学反应都要涉及两个方面的问题:一是化学反应的快慢,也就是化学反应速率的问题;二是化学反应进行的程度,也就是化学平衡问题。因此,在历年的高考命题中,化学反应速率和化学平衡测试的范围比较广,且重要的知识点在高考中出现的频率较高。
一、化学反应速率的影响因素
例1一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图1所示。下列判断正确的是( )。

图1
A.在0~50min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25min之间,pH=10时R的平均降解速率为0.04mol·L-1·min-1
错因分析:审题时忽略酸性溶液对化学反应速率的影响,因此错选C。
解析:本题考查化学反应速率的影响因素及反应速率的计算。从图中看,在0~50min之间,pH=2和pH=7时,反应物R都能完全反应,降解百分率都是100%,A项正确;从图中看,pH越小c(R)变化的斜率越大,即酸性越强,单位时间内降解速率越快,B项错误;一般来说,反应物的浓度越大,反应速率越大,R的起始浓度小,其降解的速率小,C项错误;20~25min之间,pH=10时R的平均降解速率为10-6mol·L-1·min-1,D项错误。
答案:A
纠错巩固1:溶液中的反应X+Y⇌2Z分别在①②③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol·L-1及c(Z)=0mol·L-1,反应物X的浓度随时间变化如图2所示。②③与①比较只有一个实验条件不同,下列说法不正确的是( )。

图2
A.反应进行到5min时实验③的反应速率最快
B.条件②的反应最先达到平衡
C.②与①比较可能是压强更大
D.该反应的正反应是吸热反应
解析:由图像看出条件②的反应最先达到平衡,故其反应速率最快,B项正确;②与①比较,只有反应速率不同,达到的平衡状态相同,可能为加入催化剂,在溶液中进行的反应,压强对反应速率没有影响,C项错误;条件③比条件①先达到平衡,说明条件③反应速率比条件①反应速率快,但反应的限度要大于条件①,可能为升温所致,且该反应为吸热反应,D项正确。
答案:C
二、化学平衡状态的判断
例2对于可逆反应H2(g)+I2(g)⇌2HI(g),在温度一定时由H2(g)和I2(g)开始反应,下列说法正确的是( )。
A.H2(g)的消耗速率与HI(g)的生成速率之比为2∶1
B.反应进行的净速率是正、逆反应速率之差
C.正、逆反应速率的比值是恒定的
D.达到平衡时,正、逆反应速率相等
错因分析:判断化学平衡状态时一定要注意以下问题:(1)反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。(2)恒温、恒容条件下体积不变的反应,体系的压强或总物质的量不再随时间而变化,如2HI(g)⇌H2(g)+I2(g)。(3)反应物、生成物全是气体,且反应前后气体的总体积不变的反应,体系的平衡相对分子质量不再随时间而变化,如2HI(g)⇌H2(g)+I2(g)。(4)反应物、生成物全是气体的反应,恒容条件下体系的密度保持不变。
解析:H2(g)的消耗速率与HI(g)的生成速率比决定于该反应的化学计量数之比,应为1∶2,A项错;正、逆反应速率的比值是随反应时间的变化而变化的,不是恒定的,C项错。对于一个可逆反应的净速率就是正、逆反应速率之差,B项正确;可逆反应达到平衡的标志就是正、逆反应速率相等,D项正确。
答案:BD
方法点拨:化学平衡状态的根本标志是:(1)v正=v逆;(2)各组分的物质的量分数不变。解题时要紧紧抓住两个根本特征,并明确气体的颜色、密度、压强、平均相对分子质量的变化与标志间的关系,才能全面分析,顺利解答。
纠错巩固2:在容积不同的密闭容器内,分别充有等量的N2和H2,在不同温度下,任其发生反应N2+3H2⇌2NH3,并分别在ts时测定其中NH3的体积分数,绘图如图3所示。

图3
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的是____。
(2)此可逆反应的正反应是____反应。(填“吸热”或“放热”)
(3)AC段的曲线是增函数,CE段的曲线是减函数,试从反应速率和平衡的角度说明理由:___。
解析:由图3判断,C点是第一个平衡点,则A、B两点尚未达到平衡状态。C点以后,随温度升高,NH3的百分含量降低,说明平衡向逆反应方向移动,所以正反应是放热反应。
答案:(1)AB (2)放热 (3)AC:反应开始v正>v逆,反应向右进行生成NH3;CE:已达平衡,升温使平衡左移,NH3的体积分数变小
三、化学反应速率和化学平衡图像
例3三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。对于反应2SiHCl3(g)==SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图4所示。

图4
(1)343K时反应的平衡转化率α=____%。平衡常数K343K=____(保留2位小数)。
(2)在343K下:要提高SiHCl3转化率,可采取的措施是____;要缩短反应达到平衡的时间,可采取的措施有____、____。
错因分析:在读图时,要理清图像中的关键点、曲线变化趋势及曲线的不同涉及的化学反应原理,该题中温度不同对应曲线的判定,反应在343K时SiHCl3的转化率为22%及计算出反应在343K的平衡常数K=0.112÷0.782=0.02,是解题的突破口。
解析:(1)温度越高反应速率越快,达到平衡用的时间就越少,所以曲线a代表343K时的反应。从图中读出,平衡以后反应转化率为22%。设初始加入的三氯氢硅的浓度为1mol·L-1,得到:

起始: 1 0 0
反应: 0.22 0.11 0.11(转化率为22%)
平衡: 0.78 0.11 0.11
所以平衡常数K=0.112÷0.782=0.02。
(2)温度不变,提高三氯氢硅转化率的方法可以是将产物从体系分离(两边物质的量相等,压强不影响平衡)。缩短达到平衡的时间,就是加快反应速率,所以可以采取的措施是增大压强(增大反应物浓度)、加入更高效的催化剂(改进催化剂)。
(3)a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即va>vb。根据题目表述得到,当

起始: 1 0 0
反 应: 0.2 0.1 0.1(转化率为20%)
平衡: 0.8 0.1 0.1
答案:(1)22 0.02 (2)及时移去产物改进催化剂 提高反应物压强(浓度)(3)大于 1.3
方法点拨:解答化学平衡图像题的技巧:(1)先拐先平。先出现拐点的反应先达到平衡,可能是该反应的温度高,压强大,浓度大。(2)定一议二。图像中有三个变量时,先固定一个量,再讨论另外两个量的关系。
纠错巩固3:炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)⇌2CO(g) ΔH=QkJ·mol-1。图5为CO2、CO的物质的量n随时间t的变化关系图。
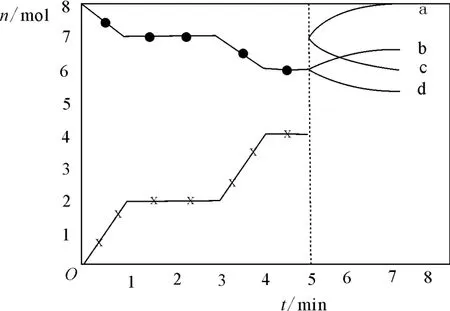
图5
下列说法正确的是( )。
A.0 ~ 1min,v(CO)=1mol·L-1·min-1);1~3min时,v(CO)=v(CO2)
C.3min时温度由T1升高到T2,则Q>O,重新平衡时
D.5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化
解析:A项,根据图像知,0~1min时,1~3min达到平衡状态,CO的正逆反应速率相等,CO、CO2的反应速率与化学计量数成正比例,,A项错误;B项,正反应是气体分子数增大的反应,在恒温恒容密闭容器中反应,气体压强由小到大,当压强保持不变时,达到平衡状态,平衡时压强大于开始压强,其比值大于1,B项错误;C项,从图像看,平衡后,升高温度,CO物质的量增大,CO2的物质的量减小,故平衡向正方向移动,所以,正反应是吸热反应,4min时达到新平衡:c(CO)=2mol·L-1,温度(T1)平衡:c(CO)=1mol·L-1,c(CO2)=,C项正确;D项,增加CO物质的量,CO总物质的量增大随后逐渐减小,而二氧化碳的物质的量在原来基础上逐渐增大,过一段时间,又达到新平衡,c曲线、b曲线分别表示CO、CO2的物质的量变化,D项错误。
答案:C
