尼帕病毒病的流行现状与防治研究进展
2018-11-02李国华王化磊杨松涛夏咸柱
李国华,王化磊,张 颖,冯 娜,杨松涛,夏咸柱
副粘病毒科病毒能引起人和多种动物发病,其中感染人的主要有麻疹病毒、腮腺炎病毒和风疹病毒;感染动物的病毒主要有新城疫病毒、犬瘟热病毒和牛瘟病毒;人兽共患病病毒有亨德拉病毒(Hendra virus, HeV)和尼帕病毒(Nipah virus,NiV)。尼帕病毒病(Nipah virus disease, NVD)于1998年9月底在马来西亚霹雳州怡保市附近暴发,之后又在森美兰州的两个地区暴发。该病的临床表现为高热、头痛、脑炎和呼吸系统症状,起初被认为是乙型脑炎,但采取灭蚊和免疫等措施后,疫情并没有得到控制。持续到1999年7月中旬,该国确诊病例至少有265例,其中105例死亡,病死率达到40%[1]。1999年3月份分离出病毒,电镜观察发现该病毒呈副粘病毒特征。测序结果显示,病毒与HeV同源性高。确诊病原后,马来西亚政府采取措施,扑杀110万头猪后未出现新发病例,成功控制了该病在人群中的流行。2001年NVD分别在印度和孟加拉国暴发。截至到目前印度共暴发3次NVD疫情,分别在2001,2007和2018年。2018年的这次疫情暴发于5月17日,截止到7月2日,共有19例报告病例(其中18例为实验室确诊病例),17例死亡(WHO统计数据),病死率约94%。而在孟加拉国,自2001年首次暴发后,NVD几乎每年都有暴发,这可能与该病毒的遗传特性发生了变化或居民生活习俗差异有关。我国与印度接壤,并和孟加拉国邻近,虽然还没有病例报道,但该病具有传入我国的风险。为此,及早了解NVD的流行现状和防治研究进展,为我们以后成功应对突发传染病具有重要意义。
1 病原学
NiV是单股负链RNA病毒,属于副粘病毒科亨尼帕病毒属,另一个同属的病毒是1994年在澳大利亚布里斯班发现的HeV[2]。NiV粒子为多形性、球形、丝状,有囊膜,尺寸在40~1900 nm之间,基因组18 246 nt,比HeV多12个碱基,编码至少N、P(C/V)、M、F、G、L 6种蛋白(图1)。其中N、P、L蛋白结合在病毒RNA上,与病毒基因组的转录和复制有关,M蛋白参与维持病毒囊膜形态,F、G蛋白参与蛋白的融合和吸附,与病毒入侵有关[4]。N基因高度保守,可作为PCR诊断的靶片段[1]。NiV主要有2个遗传谱系:NiV马来西亚株(NiV Malaysia, NiV-MY)和NiV孟加拉株(NiV Bangladesh, NiV-BD)。其中NiV-MY株基因组18 246 nt,而NiV-BD株基因组18 252 nt[5]。
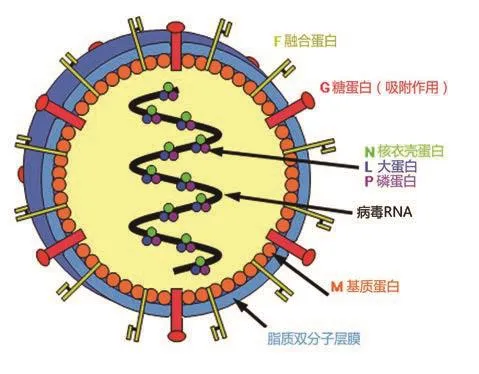
图1 亨尼帕病毒结构图[3]Figure 1 Structure of Henipa virus[3]
2 流行病学
NVD病死率高,在40%~75%之间。在1998年9月底—1999年7月中旬马来西亚暴发的NVD疫情中,病死率达到40%[1]。1999年3月,新加坡确诊病例11例,死亡1例[6]。之后,印度在2001年、2007年和2018年均暴发了NVD疫情,孟加拉国从2001—2012年,几乎每年均发生NVD疫情,两国2001—2012年疫情病例总数为280例,死亡 211例,病死率高达75%[5]。亨尼帕病毒暴发和果蝠活动范围分布见图2。
据调查NiV的传染源是果蝠,主要通过两种方式传播:一种是传给中间宿主猪,猪再通过接触传染给人;另一种是通过污染椰枣树的椰枣汁传染给人[8-9]。另外,健康人与患者密切接触也可能感染[10]。
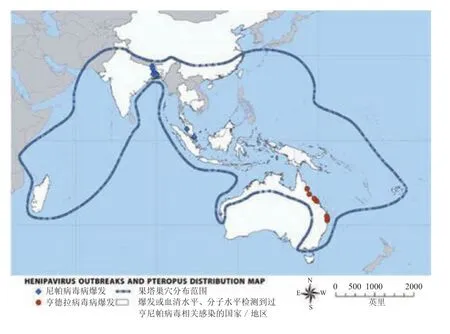
图2 亨尼帕病毒暴发和果蝠活动范围分布图[7]Figure 2 Henipa virus outbreaks and Pteropus distribution map[7]
在马来西亚,NiV主要通过中间宿主传播。暴发地居民将猪舍建在果树旁。果蝠是NiV的主要贮存宿主,感染NiV的果蝠采食树上的果子时,其唾液、尿液污染的未吃完的果子和残渣掉入猪舍后被猪采食,而后猪感染病毒。发病期的猪的粪便、尿液等分泌物又通过直接接触感染其他宿主。然而猪的发病率并不高,在5%左右[1]。人在处理病死猪时,接触到病死猪的粪便、分泌物等,经过6~21 d的潜伏期后出现高热、头痛等脑炎症状,有部分患者出现咳嗽等呼吸系统症状。临床上,NVD容易和流行性乙型脑炎混淆,但NiV感染的人不分年龄,婴幼儿和成年人均可发病,且病死率高,而流行性乙型脑炎主要感染儿童,感染后病死率低,这是两者的区别[4]。感染者与猪密切相关,马来西亚的感染者主要是养殖场工人,新加坡的感染者全都是屠宰场工人。
孟加拉国和印度疫情暴发主要是居民饮用了被NiV污染的椰枣汁。该地区的居民具有饮用椰枣汁的传统,常在秋冬季采集新鲜椰枣汁直接饮用或发酵后饮用。为了收集椰枣汁,居民先将椰枣树削皮,然后插入引流管过夜收集汁液。椰枣汁口感甜美,果蝠夜间常来舔食树干上的汁液,当NiV阳性果蝠的分泌物如唾液、尿液、粪便等落入椰枣汁中,人饮用后会导致感染发病[12],疫情暴发多集中在9月到来年3月间。
人际间传播是NVD在孟加拉国和印度流行的又一大特征。2001年印度西里古里暴发的NVD疫情显示,先后感染的病例集中在患者去过的医院,该次疫情死亡45例(确诊66例)[12]。2004年孟加拉国福里德布尔的疫情中,当地一个知名的宗教领袖感染NiV后,探望者众多,导致22人感染[9]。Luby等[13]统计了2001—2007年间孟加拉国的病例,其中51%(62例)的病例是密切接触其他患者后感染了NiV。调查发现呼吸道分泌物是人际传播病毒的主要载体,而且呼吸困难的患者更容易传播病毒[11,13-14]。
副粘病毒大多数成员感染动物有特异性,一般不跨物种感染。但NiV能感染多种动物,如猪、马、猫、狗等均可感染。NiV宿主范围广是因为它以肝配蛋白B2/B3(ephrin B2/B3)作为进入细胞的受体,肝配蛋白B2/B3参与调节神经系统和红细胞的发育,广泛分布在内皮细胞和神经细胞表面,而且在哺乳动物中高度保守[5,15-16]。
孟加拉国频繁发生NVD疫情,可能跟病毒遗传特性和发生改变的传播方式有关。Mire等[17]用非洲绿猴攻毒实验显示NiV-BD株致病力强于NiV-MY株。这提示我们在接触到疑似病例时要注意做好个人防护。Harcourt等[18]分析了NiVMY和NiV-BD株病毒,两者全基因序列同源性为91.8%,编码蛋白区的序列同源性比非编码区高。4株孟加拉国分离株的N基因开放阅读框序列同源性为99.1%,而马来西亚分离株不同株之间的同源性几乎完全一致,基因上的这些差异可能反映了疫病在两个国家传播模式的不同。
3 临床症状
马来西亚和新加坡患者主要表现为发热、头痛、头晕和呕吐,52例(55%)患者意识水平下降,明显表现出脑干功能障碍。典型临床症状有节段性肌阵挛、反射消失、张力减退、高血压和心动过速等。脑电图检查,有弥漫性慢波伴随双侧尖波[19]。MRI扫描后可见急性期大脑皮层下和白质广泛局灶性损伤[20]。而孟加拉国和印度患者呼吸系统症状比例较高,占总病例数的50%~66%,马来西亚患者中约占29%[5]。
4 病理变化
病理学检查发现,NVD的病变主要发生在患者的神经系统和呼吸系统。其病理学基础是病毒感染血管内皮细胞导致多器官血管炎。受感染血管的内皮细胞逐渐融合成多核巨细胞,其他内皮细胞则被溶解脱落进入血管内。血管内皮细胞损伤,形成血栓,堵塞毛细血管,导致脏器缺血。受影响的器官由于被堵塞而出现点状皮下出血。血管炎会通过内皮细胞损伤、血管壁的纤维化坏死、出血或血栓影响小动脉、小叶和毛细血管的正常功能。在大脑、肺和肾小球等脏器血管的内皮细胞中能看到巨细胞合胞体。病变血管内皮细胞周围的神经元也出现退行性病变、胞质嗜酸性和核内包涵体。免疫组织化学(免疫组化)染色显示病变内皮细胞周围的神经元、神经胶质细胞、支气管上皮细胞和肺泡里也有NiV[1]。
NVD导致一系列临床症状和病理变化,与NiV进入细胞的方式和逃避机体免疫防御系统有关。NiV进入细胞包括吸附和膜融合2个主要过程,首先参与吸附的糖蛋白NiV-G结合到细胞表面受体肝配蛋白 B2/B3上,触发F(融合)蛋白构象发生改变,发挥膜融合功能,从而使NiV核酸进入细胞内。经Liu等[21]研究表明,NiV-G触发膜融合的机制主要分3步,即受体介导的NiV-G糖蛋白按时空性依次发生构象变化,其中2个构象变化在NiV-G蛋白头部,1个在NiV-G颈部。实验表明,无头部突变株也能激发NiV-F发生膜融合,2个头部的构象改变可暴露颈部特异性结构域。而且,NiV-G头部只有与特异受体结合后,才会触发膜融合,正常情况下NiV-G头部通过隐藏颈部结构域避免过早触发NiV-F的膜融合。
病毒能在宿主细胞成功复制,一般均有相应的逃避宿主免疫系统的策略。已证实NiV的P蛋白(NiV-P)、V蛋白(NiV-V)和W蛋白(NiV-W)能阻断I型IFN信号传导并结合信号传导及转录激活因子1(signal transducers and activators of transcription 1,STAT1)蛋白。NiV-W蛋白通过阻碍核内STAT1,阻断Toll样受体3依赖的IFN刺激基因诱导、TANK结合激酶1/NF-κB抑制因子ε介导的干扰素调节因子3活化来抑制宿主IFN应答。突变NiV-P及其基因表达产物不能去除病毒对IFN的抑制作用,说明还有其他蛋白或通路在调控。Bharaj等[22]研究发现,NiV基质蛋白M通过结合E3-泛素连接酶TRIM6,能抑制NF-κB抑制因子ε介导的I型IFN抗病毒作用,从而导致病毒增殖传播。
5 实验室诊断
因NiV属于生物安全4级病毒,相关病原操作均要在相应安全级别的实验室中进行或者对病原灭活后再进行操作。有多种诊断NiV感染的方法,包括RT-PCR法、ELISA法、中和试验、免疫组化、分离病毒法及电镜观察法等。RT-PCR法检测快速,可以根据美国国家生物技术信息中心中公布的NiV全基因组序列,选择NiV高度保守的N基因设计引物,进行扩增鉴定。
ELISA法简便准确,也常用于检测血清或脑脊液中的抗体。Danids等[23]2000年用捕获ELISA法检测患者脑脊液中的IgM抗体为阳性。CDC也用ELISA法和捕获ELISA法检测IgG和IgM,并成为马来西亚NiV检测的有效方法。中和试验是公认的检测方法,可在RT-PCR和ELISA法筛查为阳性时,用血清中和试验做进一步确诊。
病毒分离和电镜观察是最直观的检测方法。Chua等[19]1999年将2例疑似感染患者脑脊液接种Vero细胞,5 d后细胞出现合胞体现象,分离出NiV。之后又对NiV进行了一系列观察鉴定,电镜负染法观察NiV核衣壳形态呈丝状“鲱鱼骨”形(图3A),有NiV从细胞膜上出芽(图3B),细胞外完整病毒粒子多形性,直径约500 nm(图3C)。采集人脑组织进行免疫组化观察鉴定,并对NiV进行了基因测序和遗传进化分析[1]。
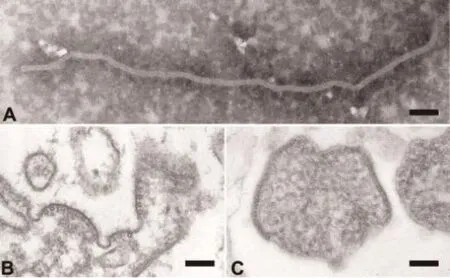
图3 NiV细胞分离株电镜负染超微结构图[1]A.NiV核衣壳(鲱鱼骨形);B.NiV出芽;C.细胞外病毒形态;标尺.100 nmFigure 3 Ultrastructural structure of Nipah virus isolated strain in cell culture by negative stain electron microscope[1]
6 防 治
NVD作为危害人类和动物健康的烈性传染病,目前还没有可供使用的特效药。特异性抗体实验在非人灵长类动物中效果良好,但还未上市。以多种病毒为载体构建的重组NiV疫苗也在试验中,除针对马HeV的亚单位疫苗上市外,其他均无上市疫苗[24]。
小动物实验研究发现抗体疗法效果不错,但大多数实验均在动物出现临床症状前就给予抗体治疗,不能反映出现临床症状后给予抗体疗法的效果。Geisbert等[25]评估了人源单克隆抗体m102.4的治疗效果。将16只非洲绿猴随机分成4组,每组4只,第4组为对照组。对这16只非洲绿猴全部气管内攻致死剂量的NiV-MY株,然后前3组分2次注射m102.4抗体治疗(15 mg/kg),第1组在攻毒后的第1 d和第3 d,第2组在攻毒后的第3 d和第5 d,第3组在攻毒后的第5 d和第7 d分别注射抗体治疗,第4组作为对照不注射抗体。8~10 d后,未注射抗体的猴均发病,注射了抗体的12只猴均存活。第5 d才首次注射抗体的第3组非洲绿猴虽然发病,但在第16 d均恢复了健康。结果表明m102.4抗体疗法在非人灵长类动物体内具有良好的治疗效果,具备用于人NiV感染治疗的潜力。该研究显示抗体对NiV-MY株有明显疗效,但是否能够成功控制强毒NiV-BD株还不清楚,须要进一步实验确定。
许多在研疫苗在小动物和非人灵长类动物模型上的实验表明,可完全预防NiV感染。这些候选疫苗利用痘苗病毒、金丝雀痘病毒、腺病毒、麻疹病毒及水疱性口炎病毒作为载体,将NiV-G基因插入其中,获得的重组毒免疫仓鼠、猪、水貂等动物,然后攻毒保护,获得了较理想的保护效果。其中用水疱性口炎病毒做载体构建的重组疫苗效果更为明显,目前已证明能给仓鼠、水貂及非洲绿猴提供保护[26-29]。
上市的马用亚单位疫苗Equivac® HeV具有交叉保护非洲绿猴免受NiV感染的能力。用可溶性HeV G蛋白亚单位加氢氧化铝胶佐剂(Alhydrogel®)和CpG寡聚脱氧核苷酸2006(CpG ODN 2006,即含有非甲基化CpG基序的寡聚脱氧核苷酸)佐剂作为疫苗,0 d和21 d分别通过肌肉注射免疫非洲绿猴,然后气管内接105TCID50(50%组织细胞感染量)NiV,10 d后结果显示,免疫组获得了完全保护。免疫组非洲绿猴没有表现出任何临床症状,未检测到病毒核酸;对照组则表现出食欲减退,行为异常,呼吸窘迫等一系列临床症状[30]。实验表明HeV G亚单位疫苗具有良好的交叉保护作用。遇到紧急情况时,可以考虑用该亚单位疫苗防控NVD。另外,制定免疫计划首先应当把家畜列入其中,比如NVD疫情流行地区的猪、马等[5],携带病毒的动物减少了,人类才能更安全。以HeV G蛋白制备的亚单位疫苗Equivac® HeV已于2012年12月在澳大利亚上市,用于防控马匹HeV感染,目前已用于12万匹马的免疫,效果良好。目前构建的候选疫苗主要是DNA疫苗、重组活载体疫苗,实验显示具有良好的保护力。这些候选疫苗以特异性体液免疫为主,刺激机体产生特异抗体,而非特异性先天免疫可能存在不足。上述候选疫苗和七肽重复区(heptad repeat region, HR)衍生多肽联合使用,或许可以增强疫苗的非特异免疫效果。NiV-F蛋白裂解后活化的F1蛋白通过2个七肽重复区HR1/HR2组成六螺旋束状结构(six-helix bundle, 6HB),参与膜融合。HR衍生多肽是HR1/2类似物,可以干扰6HB的形成,从而阻止病毒进入细胞。
鉴于可靠疗法还未出现,物理化学预防仍是控制该病的有效手段。在NVD威胁地区工作的人员,建议做好个人防护,如戴口罩、护目镜、手套,穿长袖工作服和长筒靴,勤洗手,常对工作物品进行消毒。在养殖场工作的人员,应避免动物采食被果蝠咬过的水果,并合理控制养殖密度。养殖场应远离易吸引蝙蝠的果园。疫区居民勿饮用被污染的椰枣汁,或收集椰枣汁时在周围加盖遮挡物,防止椰枣汁被蝙蝠分泌物、粪便污染[31]。
我国虽然还没有NVD疫情暴发,但新疆、云南、西藏毗邻印度,邻近孟加拉国,具有被传入的风险。另外随着与世界各国往来交流日益频繁,也增加了NVD传入我国的风险。因此随时关注该病的流行发展动态,提前着手准备,研制高效的疫苗和特异药物,对防控NVD传入我国,保障人们健康、维持经济繁荣等具有重要意义。
