镍包覆改性 Mg1.8M0.2Ni (M=Ti, Zr, Si, Cu)储氢合金的电化学性能
2018-11-02,,,,,
,,,,,
(河北北方学院,河北 张家口 075000)
1 引 言
在新能源领域内,储氢材料具有不可替代的作用,其在燃料电池和可充电电池中作为供氢材料被广泛应用。尤其镁基储氢材料,由于密度小、资源丰富、价格便宜、吸放氢平台好等优点而被认为是很有希望的储氢材料之一[1-4]。其中Mg2Ni吸氢量为3.6wt%,理论容量为999mAh·g-1,与纯镁相比较,反应生成的氢化物生成焓较小,吸氢后较易释放出氢,尤其受到研究者的关注[5-7]。
但Mg2Ni仍存在吸放氢条件较为苛刻,吸放氢速度慢,反应动力学性能差,充放循环稳定性较差等缺点,因此难以在电化学储氢领域作为电极得到应用。为了进一步提高Mg2Ni的电化学性能,采用其它元素部分取代Mg或Ni,利用机械合金化等方法制备出非晶态合金[8],利用非晶态合金表面高催化活性,从而达到降低Mg2Ni储氢合金的吸放氢温度,并使合金动力学性能和电化学性能得到提高[9-11]。Zhao[12]等采用机械合金化法制备Mg2Ni+10wt.%NbN储氢材料,发现其晶格应变增大,晶粒得到明显细化,氢扩散速率几乎是Mg2Ni的2倍。Zhang 等[13]采用在氦气保护下熔炼或连续球磨的方法制得Mg20-xYxNi10(x=0, 1, 2, 3, 4) 电极合金,结果表明,合金微结构、电化学性能和动力学性能与元素Y含量和球磨时间有关,Y取代Mg后,两种方法制备的合金循环稳定性能得到明显改善。Zadorozhnyy[14]将纯Mg与纯Ni用感应熔炼法合成Mg2Ni合金,然后利用机械合金化法将合金破碎制备出晶粒尺寸约30nm的Mg2Ni纳米晶,发现随着球磨时间延长出现非晶倾向,在0.1MPa、553K下有一个较宽吸附平台,经过21次吸放氢后仍有较好的耐久性。虽然对Mg2Ni基储氢电极材料研究取得了很大进展,但其循环容量衰退率很大的问题仍然没有得到有效解决,离实用化要求还有较大距离[15-16]。
本实验拟采用元素取代和包覆修饰相结合的方法,利用机械合金化法,以Cu、Zr、Ti、Si微量取代Mg2Ni合金中的Mg,通过改变Mg2Ni合金微观结构,制备出Mg1.8M0.2Ni(M=Cu、Si、Ti、Zr)储氢合金,然后用Ni进行包覆,使包覆后的Mg1.8M0.2Ni-1.0Ni(M=Ti、Zr、Si、Cu)储氢合金具有较好的电化学性能,尤其在循环稳定性方面有所突破,以期达到实用化要求,同时对它们电化学性能进行进一步的研究。
2 实验部分
2.1 样品制备
按所需物质量比称取99.9 wt%新切削镁屑、Ni粉(颗粒粒度≤74μm,纯度均在99.5wt%以上),以及取代元素Cu、Si、Ti、Zr(其纯度均在99.9wt%以上)混合均匀,装入300mL的不锈钢真空球罐中,加入一定质量比磨球,在0.12MPa氩气环境下采用间歇旋转高速球磨80h,并在无水氩气氛手套箱中将试样取出。
在上述制备Mg1.8M0.2Ni合金中,分别按质量比1∶1加入Ni粉,在0.12MPa的氩气环境中高速球磨,球磨30h后,在手套箱中将球磨好试样取出。
2.2 电极制备及电化学性能测试
将所制得不同合金粉分别与羰基Ni按质量比1∶3混合均匀,压成直径为1.0cm 的小片,制备成不同测试电极,同时计算活性物质真实含量,用于进行测试数据的换算。电化学容量是通过测试电极、烧结式NiOOH/Ni(OH)2辅助电极和Hg/HgO参比电极组成三电极体系来测量,电解液为6mol·L-1的KOH水溶液,以200mAh·g-1电流密度充电6h,静置10min,以50mAh·g-1电流密度放电,放电截止电压为-0.6V(vs.Hg/HgO)。整个测试过程由武汉蓝电电子有限公司LAND电池测试系统联机控制。
同上,制备新测试电极,将测试电极在 300mAh·g-1电流下将合金充电 6h, 静置 10min 后,采用CHI660C电化学工作站对测试电极进行高倍率测试(HRD)、电化学阻抗谱测试、阳极极化曲线测试和交换电流密度测试。
3 结果与讨论
3.1 XRD分析
Mg1.8M0.2Ni(M=Cu、Si、Ti、Zr)改性合金的XRD图谱如图1所示。
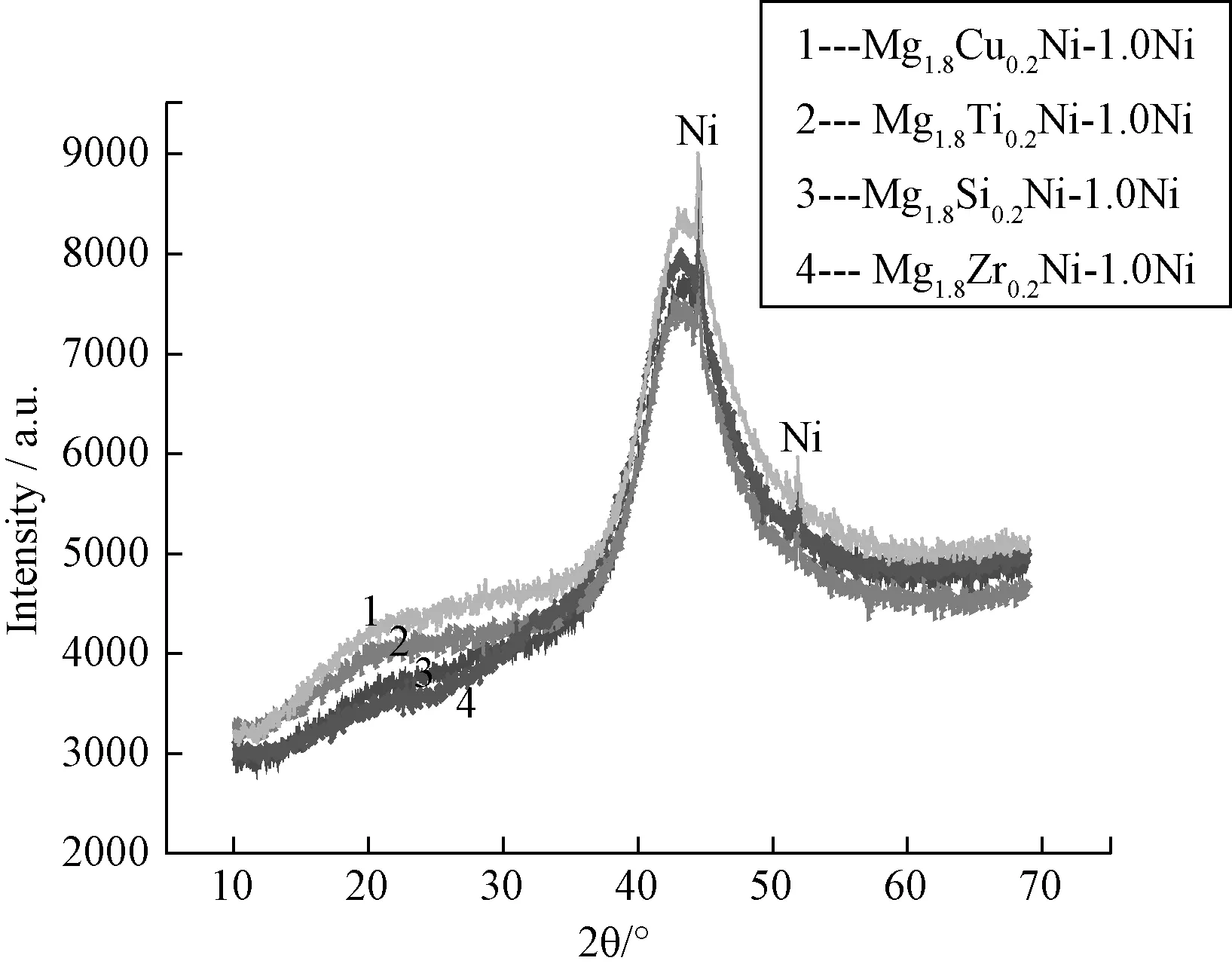
图1 系列合金的XRD图谱Fig.1 XRD spectrogram of alloys
从图1可见,在40°附近Mg2Ni衍射峰明显宽化,说明机械球磨可以显著提高合金的非晶化程度,44°和51°附近是镍的衍射峰,较尖锐,可能在球磨中,起包覆作用的镍含量较多,没有完全非晶化。利用机械合金化法,不仅可以得到纳米晶或非晶化合金颗粒,使合金界面产生高催化活性,同时不同合金在界面复合、变形、产生大量新界面,有利于氢原子向晶格内部扩散,改善其储氢性能,同时用镍对活泼含镁合金进行包覆,可以有效改善储氢合金稳定性。
3.2 放电容量和高倍放电性能
图2是Mg1.8M0.2Ni(M=Cu、Si、Ti、Zr)改性合金以及Mg2Ni合金分别与Ni粉按质量比1∶1、球磨包覆修饰后进行电化学测试得到的循环特性曲线。
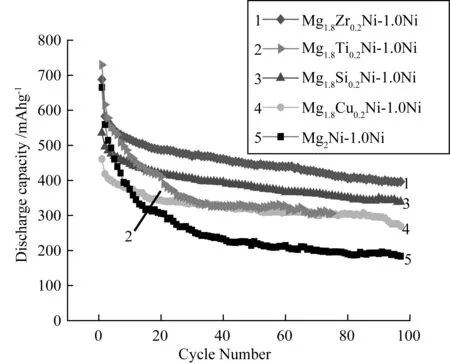
图2 系列合金的循环特性曲线Fig.2 Curves of cycle stability of alloys
如图2所示,Mg2Ni-1.0Ni合金初始放电比容量为665.5mAh·g-1,经Zr、Ti、Si、Cu部分取代Mg改性并包覆修饰后,合金Mg1.8M0.2Ni-1.0Ni(M=Ti、 Zr、Si、Cu)初始放电比容量分别为729.9mAh·g-1,689.0mAh·g-1,535.4mAh·g-1,460.1mAh·g-1。含有Ti、Zr改性合金比未改性合金初始放电比容量增大,而含有Si、Cu改性合金比未改性合金初始放电比容量减小。改性合金循环稳定性均有所改善,其中,Mg1.8Zr0.2Ni-1.0Ni表现出更好的循环稳定,100个循环后,放电比容量仍保持400mAh·g-1左右。少量的Zr、Ti、Si、Cu与Mg2Ni球磨时,它们不是简单混合,在高能球磨下会有新结构生成,同时合金内部会产生大量空隙、缺陷。由于改性合金形成不同微结构,所以它们有不同的初始放电比容量。改性合金由于结构改变可以有效抑制合金电极氧化与粉化作用,从而也可以提高改性合金的循环稳定性。
图3是系列合金高倍率放电性能测试结果。从图3中可以看出,合金电极高倍率放电性能均随放电电流密度增加而降低,这主要是由于放电电流的增加引起过电位升高所致。储氢合金Mg1.8M0.2Ni-1.0Ni(M=Zr、Ti、Si、Cu)中,含Zr、Ti、Si、Cu合金高倍放电率相对比未改性合金要好些,在放电电流为400mA·g-1和800mA·g-1时,高倍放电率分别为78%和70%以上,而在放电电流为1200mA·g-1它们高倍放电率仍达到60%以上,改性后合金具有良好的充放电动力学性能。

图3 系列合金高倍率放电性能Fig.3 High-rate discharge ability of alloys
3.3 线性极化曲线和极限电流密度
图4是系列改性并包覆修饰合金的线性极化曲线,由斜率可以求得合金电极交换电流密度, 交换电流密度是表征合金电极表面电化学反应难易程度的参数。
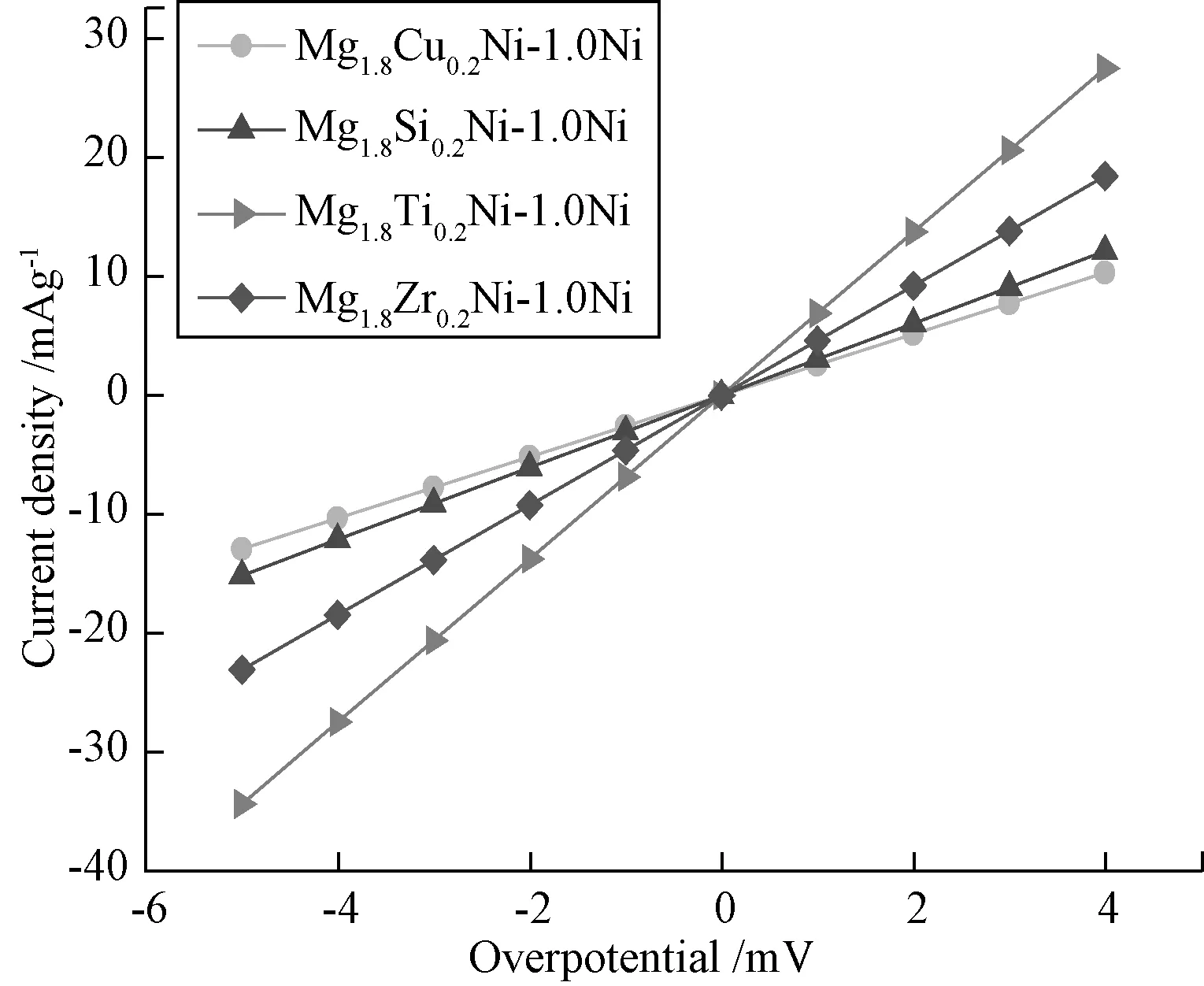
图4 系列合金电极的线性极化曲线Fig.4 Curves of linear polarization of alloys
由图4可以看出,添加Ti、Zr、Si、Cu后储氢合金的斜率由大到小的顺序排列,且含Ti、Zr储氢合金斜率又明显大于含Si、Cu储氢合金斜率,说明Ti、Zr对合金电化学反应活性的贡献大于Si、Cu,其中Ti的添加使合金具有较好的电化学反应活性。
图5是系列合金阳极极化曲线,其峰值为极限电流密度。通常认为,合金极限电流密度同时受到电极表面电荷转移过程和氢在合金中扩散过程的共同影响。从图5中可以看出,添加Zr、Ti、Si、Cu后,储氢合金Mg1.8M0.2Ni-1.0Ni极限电流密度值总趋势是逐渐减小,且峰值向左偏移,表明合金抗氧化能力降低。说明在含Zr合金中,球磨产生的活性点不易氧化,四种合金中含Zr合金电流密度最大,可能的原因是通过球磨制备合金产生的相结构缺陷、空隙比其它合金多,这有利于氢在合金中扩散,所以含Zr合金极限电流密度值大于其它合金,且循环稳定性也较好。含Ti、Si合金抗氧化性相差不大,但非金属Si可能不利于电极电荷转移,因此,含Si合金其极限电流密度小于含Ti合金极限电流密度。而较活泼的Cu可能由于更易被氧化,在合金界面形成氧化物保护膜,反而不利于电荷转移和氢在合金中扩散,其极限电流密度较低,电化学反应活性和初始放电容量也较低。
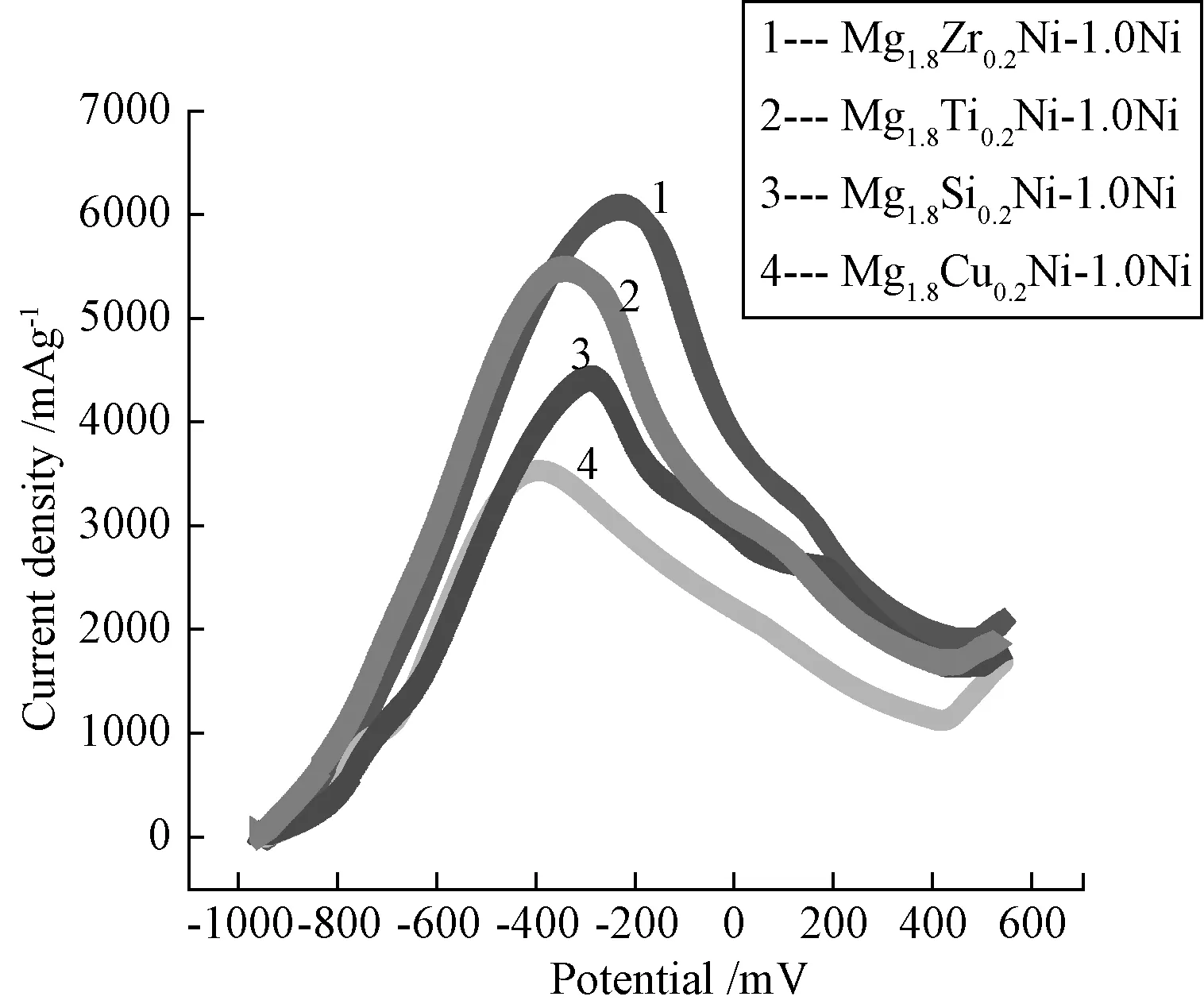
图5 系列合金的阳极极化曲线Fig.5 Curves of Anodic polarization of alloys
3.4 交流阻抗
图6是样品交流阻抗(Electrochemical impedance spectra,EIS)谱图。
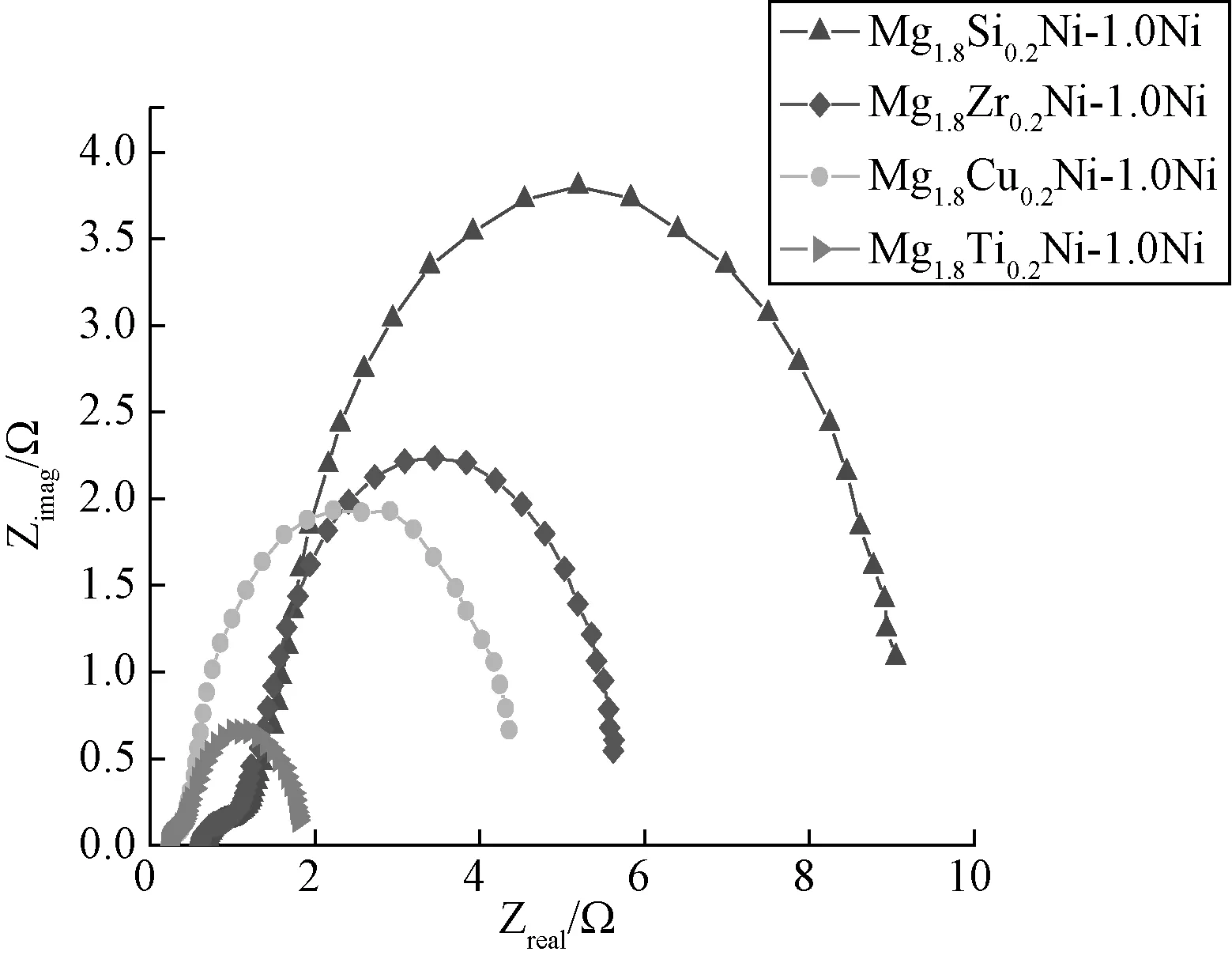
图6 系列合金电极交流阻抗谱(EIS)Fig.6 Electrochemical impedance spectra of alloys
从图6可以看出,该系列改性并包覆修饰合金电极EIS谱中,由一个小圆弧和一个大半圆构成,低频区大半圆对应于储氢合金中氢在合金体相内吸附或扩散的阻抗(吸附电阻),高频区小圆弧代表合金界面电荷转移电阻(电化学电阻),电化学半圆和吸附半圆部分重叠,使电化学半圆成为一段小圆弧[17]。
交流阻抗测试结果表明,该系列合金电极反应的速率控制步骤是由合金/电解液界面间的电荷迁移和氢在合金体相内吸附或扩散联合控制,但吸附半圆直径远大于电化学半圆直径,所以其速度控制步骤主要由合金体相内吸附或扩散来决定。因此,利用元素部分取代Mg2Ni中Mg,然后进行包覆修饰,通过改变合金微结构,形成非晶活性点和许多微通道结构,是改善Mg2Ni的电化学性能的一个行之有效的方法。
用ZVIEW软件对图6中阻抗图进行拟合,得到图7的等效电路图,拟合数据结果见表1。其中,R1为溶液电阻,R2为电荷转移电阻,R3为合金体内吸附或扩散时电阻,C1为工作电极与电解质之间电容(双电层电容), C2为合金体内界面电容。
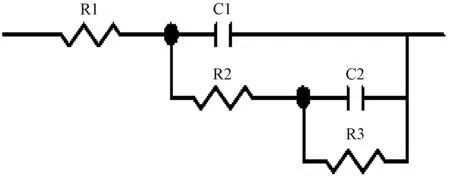
图7 合金电极交流阻抗拟合等效电路图Fig.7 EIS equivalent circuit diagrams of alloys
在系列合金Mg1.8M0.2Ni-1.0Ni(M=Cu、Si、Ti、Zr)中,R2和 R3值具有比较重要的意义,因为一般氢电极是在电极表面产生吸附和反应,而储氢合金电极放电时,与储氢合金结合的氢,从合金体相内向金属表面扩散再进行反应,充电时则相反。R3值大于R2,说明储氢合金中速率控制步骤主要由氢在合金体相内吸附或扩散来决定,而这一过程是决定储氢合金电极电化学性能好坏的关键环节。较小R2和 R3值一般可以认为其具有较好电化学动力学性能,即在较短时间内完成充放电,具有较好高倍率放电性能。R3/R2比值具有一定意义,该值越接近1,说明氢在合金中扩散或吸附速率和在界面处电极反应速率一致,充电时,在电极处生成的氢尽可能储存在合金中,逸出氢就越少。数值大于1,说明氢在合金中吸附结合的速率小于在界面处的电极反应速率,数值越大,二者之间速率相差越大,储氢合金在充电时逸出的氢就越多,在相同充电条件下,合金中储存的氢就少。由表1中可知,含Ti、Zr、Si、Cu四种元素的合金中,R3/R2比值逐渐减小,说明在四种合金电极含Ti合金电极中,储存氢最多,其初始放电容量也最大,而含Cu合金电极的储存氢最少,其初始放电容量也最小,这与图1系列合金的循环特性曲线给出的初始放电容量数据一致。
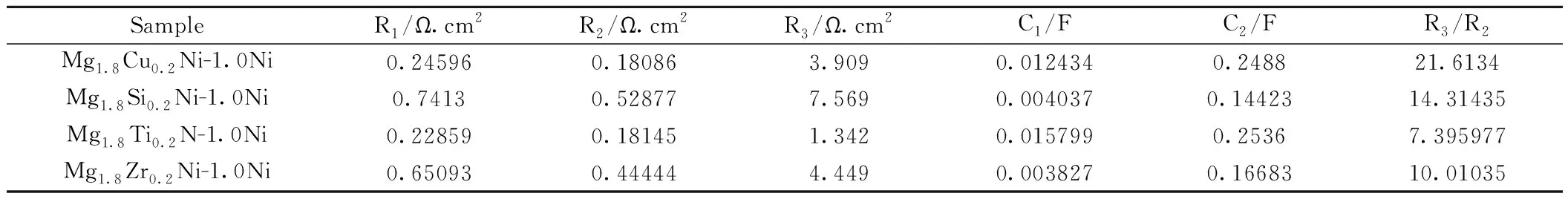
表1 系列合金交流阻抗参数Table 1 EIS parameters of alloy electrodes
4 结 论
改性储氢合金电极Mg1.8M0.2Ni-1.0Ni(M=Ti、Zr、Si、Cu)在球磨过程中由于非晶化程度提高,产生大量多相结构缺陷、空隙,以及活性点,故有较强电化学反应活性和有利于氢在合金中的扩散通道,其电化学性能都得到不同程度改善。该改性合金可以有效抑制合金电极氧化与粉化,与未改性合金相比,可以明显提高合金循环稳定性和高倍放电性能。其中含Zr、Ti合金的活性点不易氧化,因此其初始放电容量大于未改性合金。非金属的Si由于不利于电极电荷转移,而较活泼的Cu由于更易被氧化,在合金界面形成氧化物保护膜,反而不利于电荷转移和氢在合金中的扩散,故含Si、Cu合金初始放电容量小于未改性合金。
