海藻酸钙/聚乙烯醇水凝胶的制备及其性能
2018-11-02,,,,,2
,, ,,,2
(1.东华大学化学化工与生物工程学院,上海 201620; 2.纺织面料技术教育部重点实验室,上海 201620)
1 引 言
水凝胶是一种通过共价键、氢键或范德华力等作用相互交联而构成的具有三维网状结构、能在水中溶胀并保持大量水分而又不溶解的聚合物[1-3]。因其具有高含水量、柔软灵活、优异的生物相容性等性质而被广泛应用于生物医学领域,如药物控释、隐形眼镜、创伤敷料和组织工程支架等[4-6]。海藻酸钠是一种提取自海藻的天然多糖,是由β-D-甘露糖醛酸(M单元)与α-L-古罗糖醛酸(G单元)依靠β-1,4-糖苷键连接形成的线性共聚物。海藻酸钠具有良好的生物相容性、可降解性,且经济环保,已经在食品工业和医药领域得到了广泛应用[7]。海藻酸钠溶液可以通过添加二价阳离子(如Ca2+、Ba2+等)形成水凝胶,而且凝胶转变条件温和[8]。
聚乙烯醇是聚醋酸乙烯酯水解得到的水溶性聚合物,安全无毒。在形成凝胶过程中,聚乙烯醇分子链间羟基的氢键作用可形成缠绕结构,使凝胶具有优异的力学性能[9]。将聚乙烯醇引入海藻酸盐水凝胶可以提高海藻酸盐水凝胶的力学性能,从而实现海藻酸钠和聚乙烯醇的性能互补。海藻酸盐/聚乙烯醇水凝胶兼具海藻酸钠良好的生物相容性、亲水性和PVA优异的机械性能,具有较广泛的应用前景[10-11]。通常,海藻酸钙/聚乙烯醇水凝胶的制备方法是先将聚乙烯醇和海藻酸钠溶液经过冷冻-解冻操作形成半互穿网络结构,然后再通过浸泡CaCl2的方式进行离子交联形成海藻酸钙/聚乙烯醇互穿网络水凝胶[12]。这种方法在实际操作中,由于Ca2+与海藻酸的结合速度非常快,容易形成局部凝胶,而且凝胶表面的致密层限制了Ca2+的渗透,导致凝胶内部交联程度的差别,最终难以得到均匀规整的水凝胶。
本文通过钙离子原位释放交联的海藻酸钠与冻融循环交联的聚乙烯醇形成互穿网络结构来制备海藻酸钙/聚乙烯醇水凝胶。首先将Ca2+与乙二胺四乙酸二钠(EDTA-2Na·2H2O)螯合,并均匀分布于海藻酸钠和聚乙烯醇的混合溶液中,然后通过D-葡萄糖酸内酯(GDL)的水解,从螯合体系中释放出来的Ca2+与海藻酸钠形成离子交联。海藻酸钠离子交联的同时,对混合溶液进行冻融循环操作从而得到海藻酸钙/聚乙烯醇水凝胶。该制备方法克服了浸泡CaCl2法交联不均匀的缺点,得到的水凝胶交联更加均匀,具有均一规整且孔隙率较高的多孔结构,为水凝胶优异的吸水保湿性提供了结构基础,也能够保持水凝胶良好的力学弹性。
2 实验部分
2.1 实验试剂
聚乙烯醇(含量≥99%)、海藻酸钠(CP)、乙二胺四乙酸二钠(AR);D-葡萄糖酸内酯(AR);氯化钙(AR);氢氧化钠(AR)。
2.2 水凝胶的制备
2.2.1Ca-EDTA缓冲溶液的配制 将3.73g EDTA-2Na·2H2O分散于一定体积的蒸馏水中,搅拌使其充分溶解后再缓慢加入1.11g CaCl2固体,超声使其完全溶解,Ca2+与EDTA摩尔比为1∶1。最后采用1M NaOH将混合溶液的pH调至7.0,制成100mL 0.1 M的Ca-EDTA溶液备用[3]。
2.2.2CA/PVA水凝胶的制备 准确称取海藻酸钠粉末溶于蒸馏水中,配制一定浓度的海藻酸钠溶液,放置过夜使其完全溶解后备用。准确称取聚乙烯醇,并加入蒸馏水,95℃以上水浴加热溶解均匀后备用。室温下,将上述海藻酸钠溶液和聚乙烯醇溶液混合均匀后,加入一定体积的Ca-EDTA溶液和现配的GDL溶液,Ca-EDTA和GDL的摩尔比为1∶2,搅拌均匀后将混合溶液倒入模具内。然后将模具放入冰箱冷冻12h,室温下解冻。重复冻融过程,使得PVA 能够充分交联得到CA/PVA水凝胶。CA水凝胶为海藻酸钠含量为2wt%的纯海藻酸钠水凝胶,不经过冻融循环操作;PVA水凝胶含有7wt%的PVA,只进行冻融循环操作。
2.3 凝胶分数的测定
取定量的水凝胶样品干燥至恒重,称取其质量(W0),将其放入去离子水中,室温下浸泡3天以除去未反应的单体。然后再将其干燥至恒重,称取质量(W1),计算凝胶分数。每个系列样品至少测试3次,结果取平均值。凝胶分数(GF)按式(1)计算[13]:
(1)
2.4 形貌观察
将冷冻干燥后的水凝胶样品,在液氮中淬断,对其横断面进行喷金处理,采用TM-1000型扫描电子显微镜(SEM)观察水凝胶的微观形貌。
2.5 性能测试
2.5.1热稳定性测试 采用TG209 F1型热重分析仪对冷冻干燥后的水凝胶样品进行热稳定性分析。将3.0mg左右待测样品放置于开放的铝盘里,在氮气氛围中,气体流速设定为20mL/min,将样品在50~700℃范围内匀速升温,升温速度为10℃/min,记录热失重变化曲线。
2.5.2吸水保湿性测试 将制备的水凝胶样品干燥至恒重(Wd)放入去离子水中,室温下保持一定时间后取出,用滤纸擦干表面的水分,记录下此时水凝胶的质量(Wt),水凝胶的吸水溶胀比(SR)按式(2)计算[13]:
(2)
将溶胀平衡的水凝胶样品放在25℃,湿度为60%的恒温恒湿箱中,每隔一段时间取出称重,记为Wt,通过含水量的动态变化来表征水凝胶的保水性能。含水量(WC)按式(3)计算[14]:
(3)
2.5.3动态流变性测试 将制备的水凝胶使用裁刀切割成直径25mm,厚度2mm的圆片,于ARES-RFS型旋转流变仪上测定其流变性能。选用直径为25mm的平行板测量系统在25℃下进行测试。首先测试水凝胶在6.28Hz时的应变扫描曲线,然后在应变线性区内对凝胶进行动态频率(0.1~100Hz)扫描。
2.5.4拉伸性能测试 将水凝胶切成长条状(40×10mm)在H5K-S型万能材料试验机上进行拉伸测试,拉伸速率为50mm/min,至样品断裂时停止。每个系列样品至少测试3次,结果取平均值。水凝胶的拉伸强度为凝胶最大拉伸应力与样品截面面积的比值;断裂伸长率为拉伸断裂时样品形变长度与初始长度的比值。
2.5.5CKK-8细胞毒性测试 采用猪髋内皮细胞(PIEC)测试水凝胶浸提液的细胞毒性,测试时长24 h。将冷冻干燥后的水凝胶样品,切成10×10mm大小,放入含有10%胎牛血清、青霉素100U/mL及链霉素100U/mL的DMEM培养基中,37℃下浸提24h。同时,在96孔板中接种100μL细胞密度为5×103/mL的细胞悬液,将培养板放于37℃,5% CO2培养箱中预培养24h。然后更换新的培养基,并向实验组中加入30μL浸提液,将培养板放在培养箱中孵育1天。最后,向每孔加入含10% CKK-8的无血清DMEM培养基,放于培养箱中孵育1小时后,用酶标仪测定在450nm处的吸光度。以DMEM培养基作为对照组(Control)。
3 结果与讨论
3.1 水凝胶的制备条件对凝胶分数的影响
水凝胶的结构与性能一方面取决于高分子材料的种类及性质,另一方面取决于水凝胶的制备条件。本研究采用钙离子原位释放法和冻融循环法相结合制备海藻酸钙/聚乙烯醇(CA/PVA)互穿网络水凝胶,机理如图1所示。首先将Ca2+与EDTA-2Na螯合,并均匀分布于海藻酸钠与聚乙烯醇的混合溶液中,然后通过GDL的水解,Ca2+逐渐从螯合体系中释放出来并与海藻酸钠形成离子交联。同时,对混合溶液进行冻融循环操作从而得到海藻酸钙/聚乙烯醇水凝胶。Ca2+含量和冻融循环次数等都会影响水凝胶网络结构的形成,最终影响水凝胶的各项性能。水凝胶制备条件对其结构的影响反映在网络交联程度及均匀性上,本文采用凝胶分数(Gel fraction)来表征制备条件对水凝胶交联程度的影响。
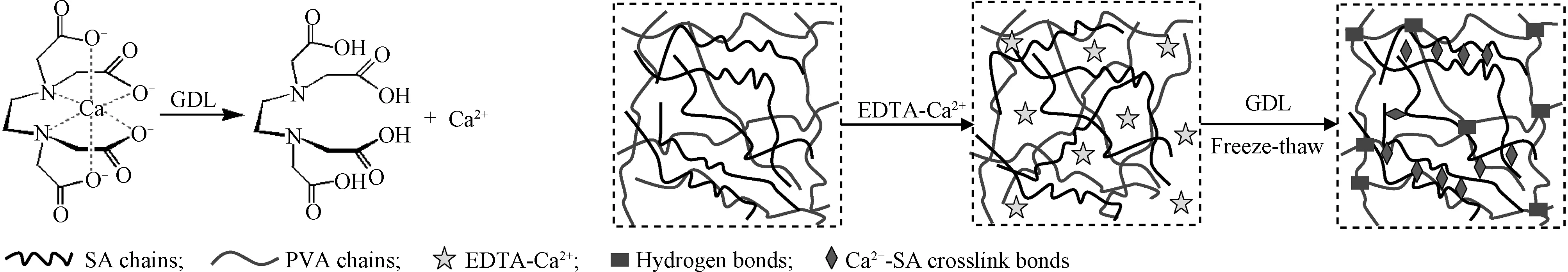
图1 CA/PVA水凝胶制备机理Fig.1 Schematic illustration of CA/PVA hydrogels
固定海藻酸钠用量为2wt%,PVA为7wt%,Ca-EDTA与GDL摩尔比为1∶2,冻融循环3次,通过改变Ca2+的用量(5、10、15、20 mM),来探究Ca2+用量对凝胶分数的影响。图2为不同Ca2+制备水凝胶的凝胶分数变化曲线,可以看出水凝胶的凝胶分数随着Ca2+用量的增加呈现先增加后减少的趋势。Ca2+可对海藻酸钠进行离子交联,使得海藻酸钠在水凝胶中起到很好的支架作用,与PVA形成完善的三维网络结构。采用Ca2+原位释放法可以保证Ca2+在凝胶混合溶液中均匀分布,从而使得所制备的水凝胶具有均匀分散的交联点,网络结构规整一致。随着Ca2+用量的增加,海藻酸链的有效交联越多,形成的网络结构越完善规整,所以凝胶分数增加。但是在海藻酸钠含量一定的情况下,继续增加Ca2+用量,离子交联迅速增加,交联点增多,一定程度上限制PVA分子链的移动,从而阻碍PVA分子链间氢键的形成,所以凝胶分数减小。
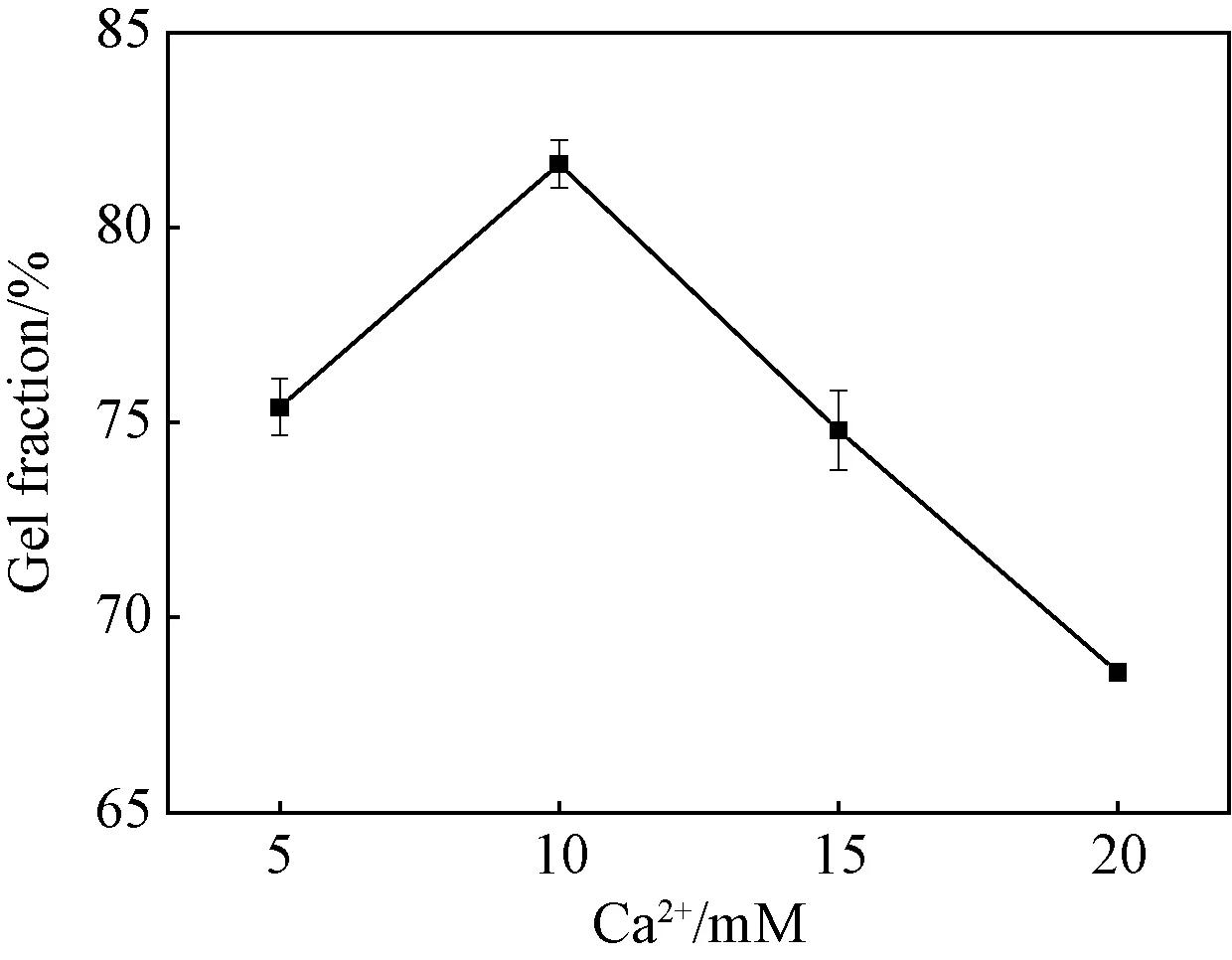
图2 Ca2+含量对CA/PVA水凝胶凝胶分数的影响Fig.2 Effect of Ca2+concentration on the gel fraction of CA/PVA hydrogels
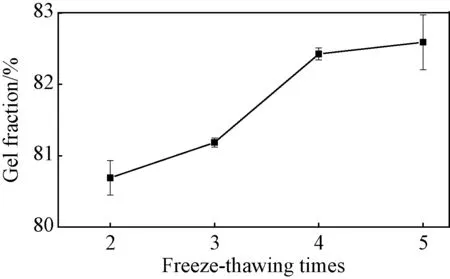
图3 冻融循环次数对CA/PVA水凝胶凝胶分数的影响Fig.3 Effect of freeze-thawing times on the gel fraction of CA/PVA hydrogels
固定海藻酸钠用量为2wt%,PVA为7wt%,Ca-EDTA与GDL摩尔比为1∶2,Ca2+的用量为10mM,通过改变冻融循环次数(2、3、4、5),来探究冻融循环次数对凝胶分数的影响。图3为不同冻融循环次数下水凝胶的凝胶分数变化曲线。可以看出,随着冻融循环次数的增加,水凝胶的凝胶分数逐渐增大,冻融4次后凝胶分数增势趋缓,说明水凝胶已形成完善的网络结构。PVA分子链经冷冻后,分子链内和分子链间的羟基接触,形成交联节点。而未发生交联的PVA分子链在解冻后仍具有一定的运动能力,这使得相互接触的羟基经再次冷冻后形成新的交联节点[15]。因此,随着冻融循环次数的增加,PVA的交联密度增大,PVA分子链和海藻酸钠分子链共同形成致密的三维网格,水凝胶的凝胶分数增加。多次冻融循环后,PVA分子链交联点基本固定,活动性减弱,所以继续增加冻融循环,凝胶分数增大趋势不明显。
3.2 形貌分析
图4是CA水凝胶,PVA水凝胶和CA/PVA水凝胶的SEM图。由图4a可见,CA水凝胶具有疏松均匀的开孔结构,孔隙相互贯通,孔径分布范围为100~200μm,孔壁规整。PVA水凝胶(图4b)也具有多孔结构,但多孔结构更加紧凑,孔径尺寸明显减小,孔密度较高。CA/PVA水凝胶(图4c)的多孔结构兼具前两者的优势,具有规则均匀的多孔结构,孔洞相互贯通,孔隙率较高,孔径尺寸居中,没有明显的微相分离,这表明海藻酸钠和PVA大分子链具有很好的相容性。Ca2+原位释放和多次冻融循环的结合使得水凝胶具有均一的网络结构,从而使得多孔结构均匀规整。海藻酸钠分子链通过Ca2+离子交联作用后,在水凝胶中起到很好的支架作用,使得水凝胶的孔洞变大,同时又兼具PVA紧密缠绕的网络结构。CA/PVA水凝胶均匀多孔的骨架结构不仅提供了水分子进出水凝胶的通道,为水凝胶优异的吸水保湿性能提供了一定的结构基础,也使得水凝胶保持良好的力学弹性。

图4 水凝胶的扫描电镜照片 (a) CA水凝胶; (b) PVA水凝胶; (c) CA/PVA水凝胶Fig.4 SEM images of hydrogels: (a) CA; (b) PVA; (c) CA/PVA
3.3 水凝胶性能研究
3.3.1热稳定性 图5为三种水凝胶的热失重曲线,三种水凝胶具有不同的热分解曲线,其热稳定性各不相同。热分解第一阶段发生在30~100℃之间,CA水凝胶对应于热重曲线上有10%的失重,即为分子内结合水的丢失,而CA/PVA水凝胶,PVA水凝胶在这一阶段的失重依次减少,这说明水凝胶内部所含结合水依次减少。在快速分解阶段,CA/PVA水凝胶的起始分解温度居中,PVA水凝胶结晶结构最多,热稳定性最好,这说明PVA的加入能有效提高海藻酸钠水凝胶的热稳定性。
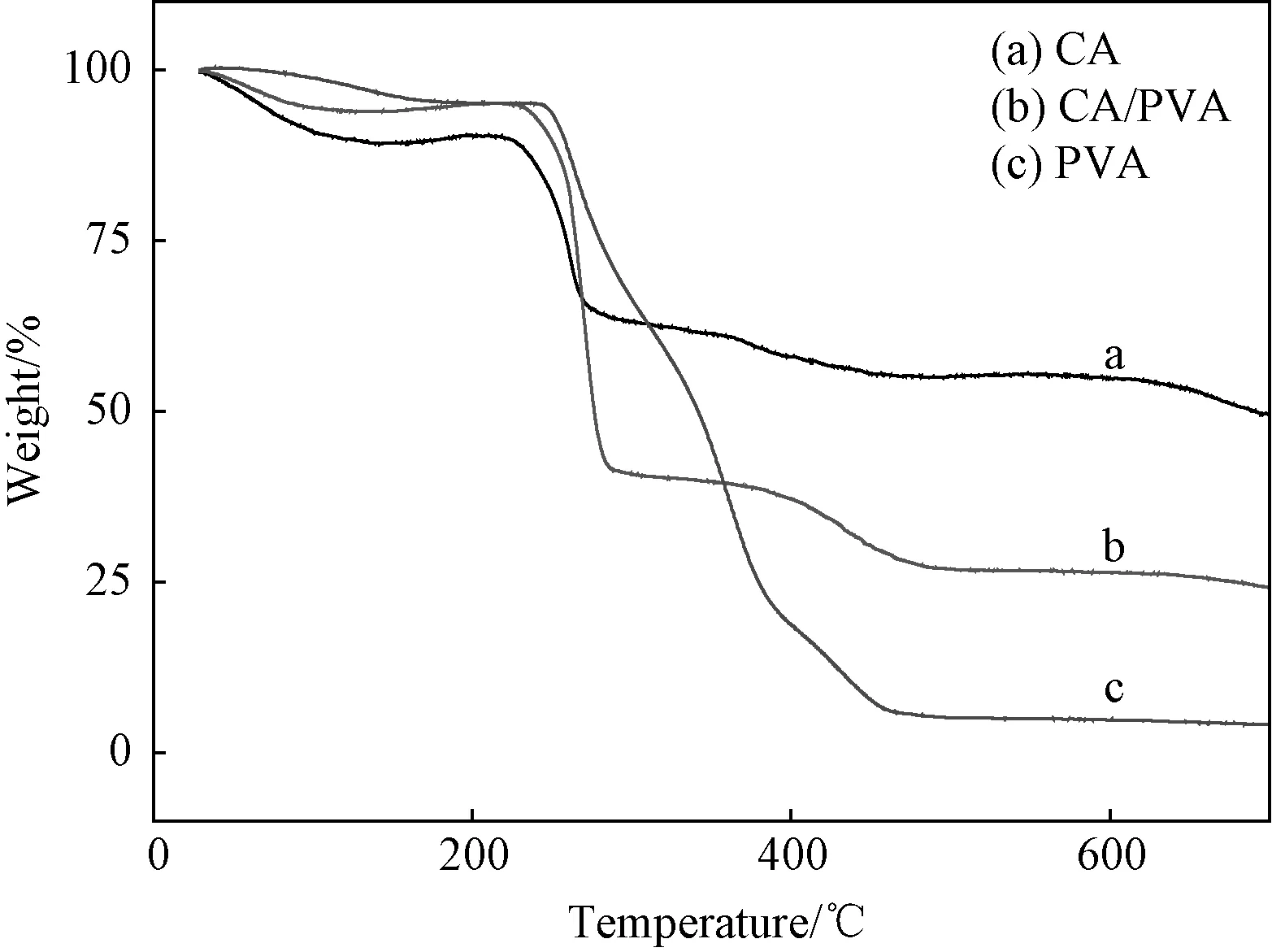
图5 水凝胶的热失重分析 (a) CA水凝胶; (b) CA/PVA水凝胶; (c) PVA水凝胶Fig.5 TGA curves of hydrogels (a) CA; (b) CA/PVA; (c) PVA
3.3.2吸水保湿性 图6为不同PVA含量的CA/PVA水凝胶的动态吸水与保湿性能。由图6(a)可看出,在吸水溶胀开始的前3h内,凝胶快速吸水,吸水溶胀率增加较快,随着溶胀时间的延长,溶胀率增加缓慢,最终趋于平衡。同时可得出结论,随着PVA含量的增加,水凝胶的溶胀性逐渐减弱,所以可以通过控制水凝胶中PVA的含量来控制水凝胶的溶胀性。由图6(b)可看出,在保水性测试开始后的前3h内,水凝胶保水性较好,含水量减小较少,随着时间的延长,水凝胶的吸水保湿性变差,含水量迅速减少,但在PVA含量低于9wt%时,水凝胶的8h时含水量仍保持在50%以上,这说明CA/PVA水凝胶具有较好的保湿性。
3.3.3动态流变性 图7为CA/PVA水凝胶在0.1%应变下储能模量G′随频率变化的曲线。可以看出在整个频率范围内,不同CA/PVA水凝胶的G′各不相同,并且G′不依赖于频率变化。储能模量G′是衡量材料刚度的一个重要参数,水凝胶的G′越大,其强度越高[16]。由图7a可看出,CA水凝胶储能模量较低,添加2wt%的PVA后,水凝胶的强度显著增加。而且随着水凝胶中PVA含量的增加,水凝胶的G′呈现增加趋势,即水凝胶的强度增大。由图7b可看出,随着水凝胶冻融循环次数的增加,水凝胶的强度逐渐增大。这与凝胶分数测试的结果一致,随着冻融循环次数的增加,水凝胶的网络结构更加完善,从而强度增大。

图7 CA/PVA水凝胶储能模量G′随频率变化曲线 (a) 不同PVA含量的CA/PVA水凝胶; (b) 不同冻融循环次数下CA/PVA水凝胶Fig.7 Storage modulus of hydrogels as functions of frequencys (a) CA/PVA hydrogels with different PVA content; (b) CA/PVA hydrogels with different freeze-thawing times
3.3.4拉伸性能 对所制备CA/PVA水凝胶进行拉伸性能测试,结果如图8所示。图8a为不同PVA含量的CA/PVA水凝胶的拉伸强度和断裂伸长率。当PVA含量为0时,水凝胶的强度较低,无法进行拉伸性能测试。随着PVA含量的增加,水凝胶的拉伸强度不断增强。这是由于PVA分子链经过冻融循环操作后,发生大量分子内、分子间氢键作用,从而与海藻酸钠分子链形成互穿网络结构,起到机械增强作用。随着PVA含量的增加,水凝胶的交联密度增加使得水凝胶的网络结构更加紧密,从而受到外力作用时,应力可以被均匀分散,拉伸强度和断裂伸长率均有所增加。图8b为不同冻融循环次数后的CA/PVA水凝胶的拉伸强度和断裂伸长率。可看出,随着冻融循环次数的增加,水凝胶的拉伸强度和断裂伸长率显著增大。这是由于PVA分子链间、分子内氢键作用力随着冻融循环次数的增加而增大,PVA的交联密度增大,分子链的规整性较好,水凝胶形成致密的网络结构。规整的交联结构使得水凝胶抵御外力作用的能力加强,从而拉伸强度和断裂伸长率均有所增加,这一结果与凝胶分数、流变测试结果一致。
3.3.5细胞毒性 图9为猪髋内皮细胞的细胞毒性实验结果。采用OD值的大小来表征细胞存活率的大小,OD值越高,细胞存活率越高。由图9可看出,三种水凝胶样品的浸提液均对猪髋内皮细胞的存活率没有消极影响。和对照组相比,三种水凝胶的浸提液所测得的OD值并未减少,这说明三种水凝胶均无细胞毒性,具有很好的细胞相容性。海藻酸钠是生物相容性较好的天然多糖,聚乙烯醇是安全无毒的水溶性聚合物,并且制备过程中并无使用有毒物质,所以所制备的水凝胶不仅安全无毒,而且细胞相容性较好,有利于细胞增殖。
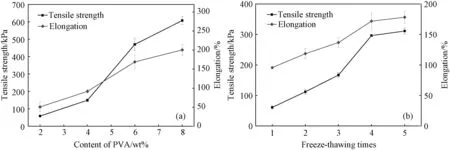
图8 CA/PVA水凝胶拉伸性能 (a) 不同PVA含量下CA/PVA水凝胶; (b) 不同冻融循环次数下CA/PVA水凝胶Fig.8 Tensile properties of CA/PVA hydrogels (a) CA/PVA hydrogels with different PVA content; (b) CA/PVA hydrogels with different freeze-thawing times
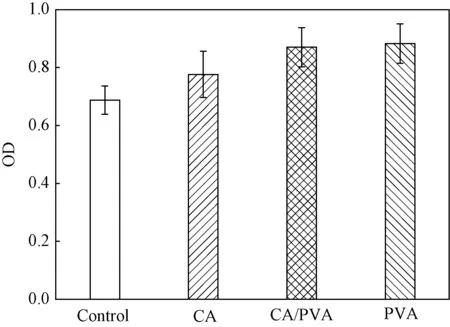
图9 水凝胶的细胞存活率Fig.9 Cell viabilities of hydrogels
4 结 论
通过在海藻酸钠水凝胶中引入聚乙烯醇组分来构建互穿网络结构,可以制备得到具有优异生物相容性、吸水保湿性和拉伸性能的海藻酸钙/聚乙烯醇水凝胶。采用Ca2+从螯合体系中缓慢释放的方法使海藻酸钠的交联更加均匀,所形成水凝胶的微孔分布更加均一,为水凝胶优异的吸水保湿性提供了结构基础,也使得水凝胶能够保持良好的力学弹性。钙离子原位释放法和冻融循环法的有效结合使得所制备水凝胶的网络结构更加均匀规整,能进一步拓宽海藻酸钙/聚乙烯醇水凝胶的应用领域。
