肺大泡伴双肺弥漫性结节一例并文献复习
2018-11-02乔一娴罗金梅赵大春
乔一娴,罗金梅,肖 毅,赵大春
中国医学科学院 北京协和医学院 北京协和医院 1呼吸内科 2病理科,北京 100730
肺癌作为肺内最常见的恶性肿瘤,影像学表现多为肺部的实性肿块,但也有极少数患者无明显肿块占位性表现,而是以双肺弥漫分布的小结节、特殊表现的肺大泡等为特征。由于此类患者早期临床表现、实验室检查及影像学表现均缺乏特异性,因此常被误诊为其他弥漫性实质性肺疾病,从而延误肿瘤本身的治疗。临床上针对双肺弥漫性结节及肺大泡的影像学特点,结合基于高分辨CT(high-resolution CT,HRCT)特征性征象的诊断流程,可为大多数患者提供特异性诊断指导,从而协助临床医生进行鉴别诊断。北京协和医院于2016年11月24日至12月19日收治了1例经病理学确诊、影像学表现为肺大泡伴双肺弥漫性小结节的肺癌患者,现报道如下。
临床资料
患者,男,36岁,因“咳嗽、咳痰、活动后气短1月余”于2016年11月24日收入我院呼吸科。患者1月半前受凉后出现咳嗽、咳灰色黏痰,此后逐渐出现活动气短,平地步行1 km或爬4层楼明显。当地胸部CT示左肺上叶可见1个直径约5.1 cm的肺大泡,内见分隔,双肺弥漫结节影,中上肺为著,双上叶肺气肿。近4月体质量下降5 kg。从事教师职业,有10年粉尘接触史。近2个月有可疑结核接触史。大量吸烟、饮酒20余年。为进一步诊治来我院。入院查体发现左上肺呼吸音稍低,余未见明显异常。动脉血气(自然状态下)检查示:pH 7.341,PaCO244.3 mmHg(1 mmHg=0.133 kPa),PaO296.0 mmHg。血尿便常规、肝肾功、凝血、血沉及超敏C反应蛋白等正常;血管紧张素转化酶正常;抗核抗体谱、抗中性粒细胞胞浆抗体谱及抗可溶性核抗原抗体谱均阴性;血清蛋白电泳、免疫固定电泳及游离轻链均正常;1,3-β-D葡聚糖检测 194.60 pg/ml,PPD试验、血T-SPOT.TB、隐球菌抗原、半乳甘露聚糖检测及诱导痰病原学检测均阴性。肿瘤抗原(cancer antigen,CA)242>150.0 U/ml,CA19- 9 215.1 U/ml,癌胚抗原(carcinoembryonic antigen,CEA)207.4 ng/ml,细胞角蛋白19的可溶性片段(proteolytic region of cytokeratin- 19,CYFRA21- 1)10.13 ng/ml,神经元特异性烯醇化酶(neuron-specific enolase,NSE)24.9 ng/ml。肺功能:第1秒用力呼气量(forced expiratory volume in one second,FEV1)/用力肺活量(forced vital capacity,FVC)80.3%,FEV1 2.33 L,占预计值61.8%,肺总量(total lung capacity,TLC)占预计值75.6%,肺一氧化碳弥散量(diffusing capacity of the lungs for carbon monoxide,DLCO)占预计值63.8%。胸部HRCT:左肺上叶囊状影伴多发轻度强化壁结节,双肺多发小结节、斑片影,上肺为著,部分伴囊状改变,纵隔多发小淋巴结;双侧胸膜增厚(图1)。PET/CT躯干显像:双肺弥漫结节代谢不同程度增高(SUV值最高3.2),考虑感染性病变可能;右锁骨上代谢轻度增高淋巴结(SUV值最高1.7)。骨扫描、头MRI大致正常。12月8日行电子支气管镜检查,镜下见左上叶、下叶背段及基底段开口处散在黏膜结节。毛刷及肺泡灌洗液(右中叶)病原学检查为阴性。肺泡灌洗液细胞分类:吞噬细胞0.64,中性粒细胞0.015,淋巴细胞0.34,嗜酸粒细胞0.005;未见瘤细胞。T细胞亚群:CD4/CD8 1.1。左上叶开口处黏膜结节活检病理:可见少许异形细胞,符合腺癌浸润;免疫组织化学检查:AE1/AE3(+),CD1a(-),CD68(-),S- 100(+)。左下肺基底段支气管肺活检病理:肺腺癌(图2);免疫组织化学检查:ALK-D5F3(+),CEA(+),P40(-),TTF- 1(+);未检测到表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变。考虑患者诊断“肺腺癌”明确,分期cT4NOM1a,IVA期。患者拒绝化疗,结合免疫组织化学结果,给予克唑替尼口服。出院半年后电话随访,患者诉偶有咳嗽,2017年2月当地复查胸部CT,自诉原双肺多发结节基本消失,因不耐受药物不良反应自行停药,此后未再复查。
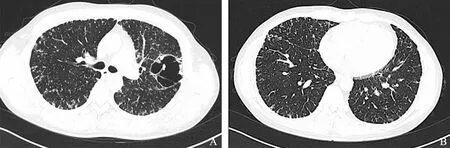
A.双上肺弥漫结节影,左上肺大泡,壁上多发结节,部分似“出芽征”;B.双下肺弥漫结节影,可见胸膜及叶间裂受累
A. multiple nodules were distributed in both upper lungs,a large bulla was seen in the left upper lung,and its wall was thickened with nodules,and some looked like tree buds;B. multiple nodules were distributed in both lower lungs,involving the pleura and interlobular fissures
图1胸部高分辨CT
Fig1High-resolution chest CT
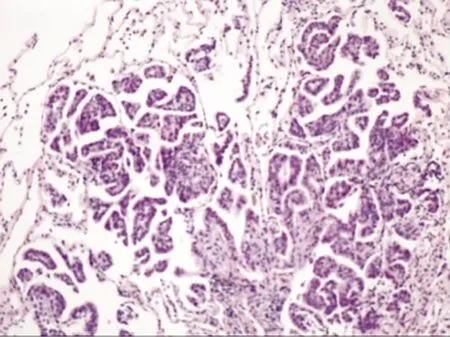
图2左下肺基底段肺组织活检病理,镜下可见肿瘤浸润性生长于肺泡及肺间质中,主要呈乳头状和腺泡状生长方式(HE,×200)
Fig2Pathology of lung biopsy in the basal segment of the left lower lung,infiltrative growth of the tumor cells can be seen in the alveoli and pulmonary interstitium,mainly in the forms of papillary and acinus growth(HE,×200)
讨 论
本例患者病史及实验室检查均无明确提示,故从影像学入手进行鉴别诊断,结果显示HRCT表现为肺大泡及双肺弥漫性结节影,部分伴有囊状改变,符合弥漫性实质性肺疾病的特点,故而考虑鉴别诊断如下:
首先,双肺弥漫性小结节,根据分布部位不同,可分为小叶中心性结节、淋巴管周围结节和随机分布的结节(又称为血行分布的结节)3大类。患者结节主要沿胸膜下及叶间裂分布,边界较清楚,考虑为淋巴管周围分布的结节。该类结节系肺部淋巴管病变所致,常见病因有:(1)癌性淋巴管炎:原发部位的肿瘤经血行转移至肺小动脉及毛细血管,穿透管壁进入血管周围的淋巴管,沿淋巴管转移的同时在淋巴管内增殖形成多发小结节。此类结节多分布于外周间质(小叶间隔及胸膜下等部位)。患者既往长期大量吸烟史,近期消瘦明显,多项肿瘤标记物升高,需考虑肿瘤引起的癌性淋巴管炎可能,但疑点在于患者较年轻,非肿瘤好发年龄,且影像学未见明确肿瘤原发病灶,结节伴囊状改变非典型癌性淋巴管炎的表现,PET-CT亦未见肿瘤性高代谢。(2)结节病:结节多分布于中轴间质(近肺门的支气管血管束周围),常伴肺门淋巴结肿大,病理表现为非干酪样肉芽肿,可相互融合。本例患者肺门淋巴结不大,血管紧张素转化酶正常,肺泡灌洗液CD4/CD8不高,肺大泡和囊样改变均不是结节病的典型改变,故结节病证据不足。(3)尘肺:吸入肺内的粉尘部分在肺泡内形成小叶中心性结节,部分突破肺泡上皮及基底膜至淋巴管内,向淋巴结引流,被巨嗜细胞吞噬,形成尘肺结节。患者无接触史,可能性不大。
其次,双肺弥漫性结节可见多发空泡、囊样变,以弥漫性结节伴多发囊性变为特征者,需警惕肺朗格汉组织细胞增多症(pulmonary Langerhans cell histiocytosis,PLCH)可能。PLCH是一种罕见的组织细胞疾病,多发生于20~40岁的年轻人,临床可表现为干咳、呼吸困难及胸痛等[1- 2],影像学以多发边界不清的小结节及囊腔为特征,后期囊腔增多增大常引起自发性气胸,多见于双肺中上区,不累及肋膈角。可通过活检确诊。其他可表现为类似影像学特征的疾病还有干燥综合征肺受累及肺淋巴管肌瘤病等,前者需有口眼干等临床表现及相应的自身免疫抗体,而后者以女性患者为主,男性患者罕见。
此外,患者左上肺有一肺大泡,可见泡壁结节及泡内血管出芽征,针对该影像学表现,笔者查阅了相关文献。1951年,Bass等[3]首次在文献中报道了1例发生于肺大泡的肺腺癌,Tsutsui等[4]则进一步提出“肺大泡相关性肺癌”这一概念,将其定义为原发于肺大泡内、肺大泡壁上或邻近肺大泡的原发性肺癌。起源于肺大泡的肺癌在原发性肺癌中仅占3.4%~4.2%[5-6],多见于中年男性,与其他类型肺癌相比,发病年龄更倾向于年轻化[7]。临床症状隐匿,偶可表现为呼吸困难、心悸、胸痛、反复的感染和咯血等[6,8]。既往多有重度吸烟史。影像学检查提示病变多见于上叶[9]。Tsutsui等[4]将该病的影像学表现总结如下:结节影位于肺大泡内或邻近肺大泡;肺大泡壁部分或弥漫性增厚;出现大泡的继发性表现,如大泡直径的改变、液体潴留及气胸等[4]。本例患者肺大泡形态特征基本符合上述表现,且PET-CT亦未见其他原发病灶可能,故推断该处为癌性结节的来源可能性大。文献报道,该类型肺癌的病理特征多表现为低分化、高增殖性的肿瘤,鳞癌明显多于腺癌,少见p53抑癌基因异常[10],合并EGFR基因突变的几率更小[9]。因其诊断时往往已处于病情进展期,故预后较其他大部分类型的原发性肺癌差。
综合上述鉴别诊断,我们在患者入院后积极为其安排了支气管镜肺活检,最终经病理证实为肺腺癌。在疾病早期仅通过影像学来鉴别由炎症或肿瘤引起的上述病变比较困难,临床医生必须对此提高警惕,熟悉肿瘤的罕见影像学表现,定期复查胸部CT,密切观察病灶的变化,避免延误诊治带来严重的后果。其中HRCT对于此类患者的检出具有更高的敏感性[11]。同时,在临床上应熟练掌握肺部影像学的鉴别诊断思路,通过影像学的特殊表现缩小诊断范围,从而更高效、更准确地开展诊治工作。
