人体水成分检测的方法学研究及临床应用
2018-11-02周胜男
周胜男,陈 伟
中国医学科学院 北京协和医学院 北京协和医院临床营养科,北京 100730
成年人体内水成分约占体质量的60%[1],人体各种生理生化活动都需在水的参与下完成和实现。正常成人每天水分的摄入和排出为动态平衡:当体内水分不足时,会造成机体脱水,影响机体发挥正常的生理功能,体内水分损失超过20%会导致死亡;体内水分过多时会使体内总液体过量,称为水中毒,严重时可造成脑细胞水肿,发展为脑疝。因此需要准确可靠的技术来测量人体水分的量和分布。但目前人体水成分的测量方法尚不统一,且细胞内水和细胞外水仍是测量的难点。同位素稀释法(isotopic dilution,ID)、生物电阻抗分析法(bioelectrical impedance analysis,BIA)、皮褶厚度测量和共振腔扰动技术(resonant cavity perturbation,RCP)是常用的人体水成分测量方法,本文通过文献分析,比较了这几种测量方法的优缺点,以期寻找适用于临床工作的人体水成分测量方法,为进一步探索人体水成分测量的临床应用及发展方向提供参考。
人体水成分检测的方法学
IDID是人体水成分测量最准确的方法,已有50年的发展历史。
总水的测量:氘(2H)作为氢的稳定同位素,以氘氧化物(2H2O)的形式口服,与体内水经过3~5 h充分混合后,使用同位素丰度测量仪器(例如流动余晖质谱仪[2])测量在尿液、唾液、汗液或人乳中的2H丰度,得到人体总水(total body water,TBW),称为重氢同位素稀释法[1]。其优点为准确性高、无放射性,缺点为测量过程繁琐、费时,且2H可与体内蛋白质中的可交换氢原子交换,也被用来合成脂肪和蛋白质,过高估计人体总水含量,误差在1%~5%左右。鉴于2H2O的优缺点,H218O形式的同位素水[3]逐渐受到关注,其测量误差较小,约0.7%~1%[4],考虑由18O与体内非水氧不可避免的交换引起。目前,该方法主要用来评估其他水成分测量方法的准确性[5]。
细胞外水的测量:细胞外水(extracellular water,ECW)的测量多用溴化物(溴化离子)[6]作为示踪剂,因其具备只分布于ECW,不进入细胞内水(intracellular water,ICW)的特点,是测量ECW最准确的方法之一[7]。可以使用本方法测量特定人群ECW的参考值范围并验证其他方法的有效性[8]。
ICW的测量:ICW的测量可以用放射性钾(42K)[9]示踪物质稀释法。然而,这种同位素的半衰期很短(t1/2=12.4 h),现在已经很少应用。目前ICW的测量一般由测得的TBW减去ECW得到。但由于测量误差(TBW为±1 L,ECW为±1.5 L)是累计的,ICW 的测量误差则会达到(±2~3)L。
BIABIA通过测得的阻抗值计算人体水成分含量。包括单频生物电阻抗分析(single frequency-BIA,SF-BIA)、节段性生物电阻抗分析和多频生物电阻抗分析(multi frequency-BIA,MF-BIA)。
SF-BIA:SF-BIA假设人体是一个具有固定横截面积、均质的圆柱形导体。因躯干横截面积较大,占全身阻抗值的10%,而质量却占全身的50%[10],因此测量手腕到脚踝生物电阻抗的方法对躯干水的变化不敏感。节段性生物电阻抗分析法的刺激电极放在指尖和足尖,感应电极放在肘部、肩峰、髂前上棘和膝盖,从而获得人体节段水成分。该方法的使用需要事先标准化,即对于特定的疾病,要有人口特定的预测等式[11]。Tagliabue等[12]发现节段性生物电阻抗的相对误差较高:手臂去脂质量(fat-free mass,FFM)的误差为13%~17%,腿部FFM的误差为10%~13%,可能与电极的类型及其放置位置有关。因此需要进一步研究来明确节段性生物电阻抗的准确性。
MF-BIA:其原理是不同频率的电流在人体内的通路不同,低频电流主要通过ECW,高频电流通过ICW和ECW[13]。多项研究以同位素稀释法作为参考标准,证实MF-BIA分析法能准确测定TBW(100 kHz,R=0.947,SEE=2.64 L)和ECW(5 kHz,R=0.930、SEE=1.94 L)含量[14- 15]。随后Boulier等[16]指出,在100 kHz的频率下测得的TBW因ICW不能被完全测量而不够准确,建议继续增加电流频率至1 MHz,可得到较准确的TBW。其缺点是测量结果的准确性和可靠性常受测量方法、姿势、人体水合状态的影响。当上述影响因素得到控制时,MF-BIA是测量身体水分的一种有效的临床研究工具。
皮褶厚度测量人体内非脂肪组织内水含量为730 g/kg[1],即TBW=0.73×(体质量-体脂质量)[17],测量人体肱二头肌、肱三头肌、肩胛下角和髂脊上方4个部位的皮褶厚度,根据公式(日本的铃木-长岭公式,美国Jackson-Pollock、Brozek公式)算得体脂含量,带入上述公式计算出TBW含量。该方法简单,方便应用于门诊,可对患者体内水含量进行粗略评估。但适用于我国人群的体脂推算公式尚未统一,准确性也有待进一步研究。
RCP是估计TBW的新方法,该方法测量与人体水相关的人体介电性能。RCP方法要求受试者仰卧于屏蔽室(共振腔)的床上。网络测试员测量房间的两个低阶空腔谐振频率,导出相对于空房间的谐振频率偏移,频率偏移与TBW相关。Oldroyd等[18]以同位素稀释法为参考标准,用该方法和BIA测量36名儿童TBW,得出等式:TBWRCP(2)(kg)=7.55+32.47×(Vm+Hm)(MHz)-0.58×BMI(kg/m2),其中,Vm为垂直共振频率偏移,Hm为水平共振频率偏移,Vm+Hm联合共振频率偏移。结果表明,TBWRCP(2)等式测量的TBW与BIA相比,准确性并没有明显提高,但此等式与性别和身体大小无关。
综上,ID测量结果准确性高,但因技术复杂,成本高昂,主要应用于实验室检测,在临床工作中则较少应用。皮褶厚度测量技术,简单快捷,可用于门诊患者人体水含量的粗略评估。RCP虽然不受性别、年龄的干扰,但因其对周围测量环境要求较高,无论是在实验室或临床中的应用均较少。BIA测量准确性较高,方法简单,对人体没有损害,成本低廉,更适用于临床工作,接下来主要探讨BIA测量人体水成分在临床中的应用(表1)。
人体水成分检测在临床的应用
体液平衡体液平衡的管理是疾病康复过程中的一个关键问题,稳定的ECW和ICW及体液张力[20](TBW和总溶质之间的关系)是人体细胞发挥正常功能的前提。通过体液监测,早期发现液体平衡异常,及时干预,为临床治疗提供帮助。
术后患者体液平衡的监测:水电解质平衡是外科术后患者顺利恢复的基础,临床中精确监测术后患者的液体平衡是一项艰巨的任务[21]。目前术后患者每日液体平衡的估计通常依赖于记录24 h出入量、体质量或临床体征,但这些指标可能不准确,造成错误评估。Meguid等[22]测量9例接受冠状动脉搭桥手术的心脏病患者术后体质量、出入量和BIA指标(电阻和电抗),发现阻抗值的变化相较于体质量和出入量,能更好地预测体液的变化。Hanaki等[23]采用BIA监测术后患者体液的变化,结果发现术后发生并发症的患者术后第1小时[(16.5±1.8)L]、第1天[(17.0±3.1)L]和第14天ECW(15.4±3.2 L)均显著高于术前[(15.0±2.3)L];无并发症的患者术后第14天ECW明显低于术前。并由此提出可以用BIA监测术后患者的TBW和ECW,若发现术后ECW超过术前水平,则应警惕术后并发症的发生。术后患者体液平衡的监测对于减少住院时间和术后并发症至关重要[24]。
淋巴水肿的评估:淋巴水肿多因淋巴管损害或阻塞引起淋巴回流障碍[25],淋巴液的皮下积聚与ECW扩张有关。早期发现是治疗淋巴水肿的有效方法之一。临床中多是通过测量患肢的周径来评估淋巴水肿,准确性较差且易延误治疗。生物电阻抗分析仪可测量乳腺癌患者患肢与健肢的阻抗值[26]。Ward等[27]采用BIA测得淋巴水肿患者患肢的ECW/ICW值为1.5∶1,无淋巴水肿的上肢ECW/ICW比值为0.85∶1至1∶1。BIA在淋巴水肿的早期诊断和监测水肿变化方面具有更好的敏感性,但在淋巴水肿的治疗方面应用较少,缺乏淋巴水肿患者治疗前后ECW/ICW值对比数据,因此BIA在淋巴水肿患者治疗疗效的评价值得进一步研究。
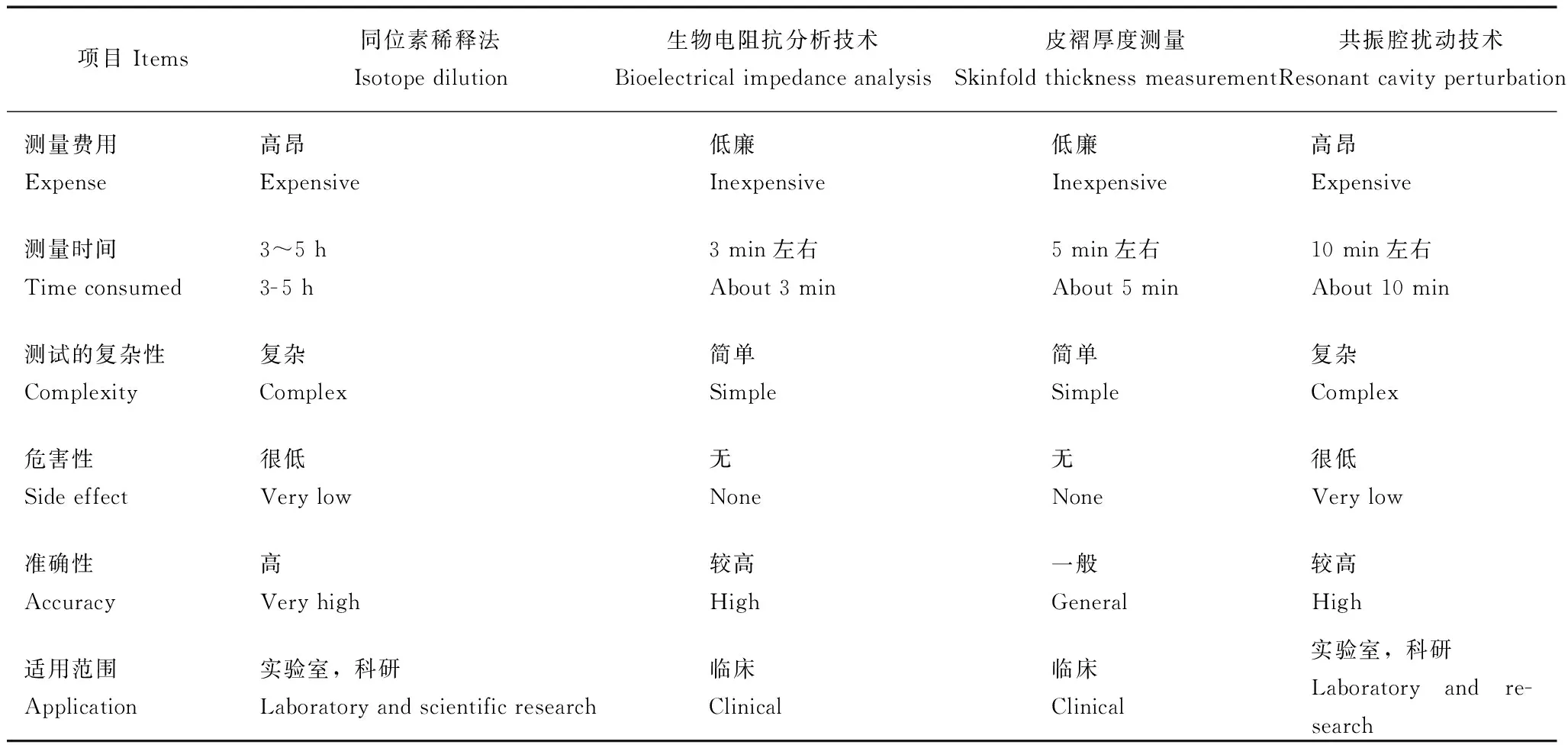
表 1 水成分测量方法学的比较[19]Table 1 Comparison of water composition measurement methods
透析患者的液体管理:主要目的是准确估计患者的干体质量(dry weight,DW),避免滤过不足或过度超滤引起相应的并发症[28]。临床工作中DW的评估多是根据患者的相对血容量、胸部X线片下测量心胸比等计算得出,这种原始方法因具有主观性,无法准确反映患者体液分布状况。因此BIA被用于监测透析患者的水合状态、指导透析治疗[29]。Asmat等[30]采用BIA测量需要进行血液透析的巴基斯坦终末期肾病患者的DW,发现BIA测量的DW与具有丰富临床经验的医生估算的DW显著相关,是巴基斯坦透析患者DW评估的有效方法。国内也有研究发现,透析过程中患者超滤脱水不仅来自于ECW,还来自于ICW,且在透析过程中,有部分ICW通过细胞膜转至ECW,随同ECW一起脱出体外[31]。这提醒临床医生要对患者的TBW、ICW和ECW进行充分评估,从而提高透析治疗的有效性,改善患者的生存时间及生存质量,减少住院率[30]。
营养状况及临床结局的评估临床中多使用体质量和身体质量指数(body mass index,BMI)粗略估计患者的营养状况,但对可能发生水肿性营养不良的患者来说是不准确的,该类患者体内瘦组织处于消耗状态,体内水逐渐增多,导致体质量和BMI增加,掩盖营养不良[32]。有研究通过测量ECW/TBW(水肿指数)作为营养状况评估的指标[33]。
ECW/TBW的正常范围是0.36~0.39[34],介于0.39~0.40之间时表示中度营养不良,而>0.40时表示重度营养不良[32]。当ICW通过细胞膜转移至细胞外时,ECW增多,预示着患者可能发生水肿性营养不良,瘦体组织减少,增加发病率和死亡率[35],临床结局较差[36]。此外,细胞膜的完整性可由相位角(phase angle,PA)反映,PA=arctan (容抗/电阻)×(180/π),可由BIA直接测得,低PA与营养风险、住院时间和死亡率之间存在显著相关性[37],而PA与ECW/TBW呈负相关[38]。因此,将ECW/TBW和PA作为评估患者营养状况的指标,能够早期发现可能发生不良临床结局的水肿性营养不良的患者[39]。
肥胖症的管理肥胖患者的脂肪组织、内脏脂肪、BMI、基础能量消耗[40- 41]、FFM、骨量、肌肉量和TBW都显著高于非肥胖患者,且肥胖患者的BMI与TBW呈负相关[42]。对于肥胖症患者,通常推荐低卡路里饮食,小于个体能量消耗(通常用双标水稀释法评估机体能量消耗[43]),减少体内脂肪组织积累,达到减重目的,但这一过程通常伴随着肌肉组织的丢失,因此找到使脂肪组织优先减少并保持肌肉量及功能的合理减肥策略尤为重要。
Gomez-Arbelaez等[44]采用MF-BIA法监测20例通过低卡饮食减重的肥胖患者减重过程中体成分变化,减少的20.2 kg体质量中包含脂肪组织16.5 kg,而丢失的去脂体质量(只占减重的5%)主要由体内TBW[(-2.3±1.1)kg]、ECW[(-1.5±0.7)kg]、ICW[(-0.8±0.5)kg]减低引起,体内水的减少可能与低卡饮食引起的糖原消耗和酮尿有关。若监测到减重患者体内水成分大量减少,提示减少的体质量中去脂体质量所占比例增加,则需调整减重方案,在一定程度上增加能量摄入,避免因低卡路里饮食导致酮尿或高酮血症。近年来,快速减重(5周内体质量减轻至少5%)一直是肥胖和超重人群关注的焦点。Ashtarylarky等[45]提出用MF-BIA测量实施快速减重和慢速减重(15周内体质量减轻至少5%)的肥胖患者体成分变化。Sagayama等[46]研究发现全身水分减少,瘦组织的丢失在快速减重中更易出现,慢速减重对维持体内水分和瘦组织的作用比快速减重更为显著。
目前已证实高盐饮食会引起体质量增加[47]。当低卡路里饮食限制盐的摄入时,体质量确实会进一步降低,但是由全身水分减少引起,而不是由体脂肪或内脏脂肪减少引起。低卡低盐组的ECW变化百分比显著高于低卡非低盐组[48]。我们可以推测高盐饮食可能是因体内水增加导致肥胖,需要研究进一步证实。肥胖症患者通常合并阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS),且严重OSAS患者的水含量比中度OSAS患者明显升高[49],当检测到肥胖患者体内水含量显著升高时,应警惕OSAS的发生。因此监测肥胖患者及减重过程中的人体水分变化,可及时调整减重方案,评估减重方案的有效性,早期预测合并症发生的可能性。
讨 论
目前国内外较常应用的人体水成分测量方法为ID和BIA,后者因其准确、简单、快捷、廉价等优点,更适用于临床。人体水成分测量在临床中的应用广泛,包括:(1)住院患者,尤其外科术后患者(消化道术后禁食水、垂体瘤术后尿崩)容易出现水电解质平衡紊乱,影响住院时间及预后,监测患者的TBW、ECW和ICW的量及变化,指导液体管理,减少并发症。(2)早期发现可能发生水肿性营养不良的患者,实施营养干预。(3)肥胖症的管理,对减重过程的管理提供参考数据。测量不同疾病患者的人体水成分的量及分布对于疾病的预防、诊治及预后都有极大的意义,相关研究也逐渐在开展并增多。
