清热化痰解毒方对卒中相关性肺炎大鼠 Akt/JNK3/Caspase-3和NF-κB信号通路的影响
2018-11-02刘宏祥闫丽静
王 涛,刘宏祥,王 颖,王 杨,刘 一,闫丽静
(河北大学附属医院中西医结合科, 保定 071000)
脑卒中属于临床常见脑血管疾病,其发病率、致死率逐年升高,而脑卒中患者中约50%死因为肺损伤[1]。目前关于脑卒中引发肺损伤机制研究较多,但尚未有统一定论。研究显示炎症反应在脑缺血再灌注损伤过程中发挥重要作用,其中Akt属于磷脂酰肌醇激酶-3(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)信号通路中重要蛋白,其激活后能够抑制炎症反应,保护脑损伤、肺损伤[2]。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)在受到炎症因子刺激后可转移至细胞核促进炎症相关基因的表达[3]。核因子κB(nuclear factor κB,NF-κB)被认为是脑缺血后最先启动的炎症因子,抑制其表达后能够减轻脑缺血引发肺损伤[4]。Akt、JNK3、NF-κB是否也参与脑缺血引发的肺损伤,目前研究不多。清热化痰解毒方要由郁金、蒲公英、丹参、杏仁、黄芩等组成,具有清热解毒效果、活血透表祛风、化痰止咳的功效,在肺部病变中应用较多。临床研究显示直肠滴注清热化痰方可治疗脑病并发肺部感染,且效果较好[5]。清热解毒中药治疗肺损伤患者后能够明显减轻肺组织病变,降低肺组织中炎症指标水平[6]。痰热清干预肺损伤大鼠后可降低肺组织中MDA水平,升高SOD水平,改善肺组织病理保护肺部功能[7]。本研究通过制备脑缺血再灌注-肺损伤大鼠,并给予清热化痰解毒方,以探究脑卒中相关性肺炎肺损伤的发病机制,为临床研究提供一定参考。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠144只,体重为220~260 g,6月龄,购自河南省实验动物中心 [SYXK(豫)2016-0002],[SCXK(豫)2016-0009]。严格遵循动物饲养规则喂养,饲养环境统一设定为温度为25℃,湿度为60%,饮用蒸馏水,喂养期间保持房间干净、通风,并定时清理鼠笼。本研究经河南省动物伦理委员会批准同意,审查编号:20160816。
1.2 主要试剂和仪器
药品与试剂:清热化痰解毒方(成分主要包括瓜蒌10 g、郁金10 g、石菖蒲10 g、蒲公英10 g、丹参10 g、桔梗10 g、杏仁10 g、射干10 g、川贝10 g、黄芩10 g,药材均购自于张仲景大药房);尼莫地平(亚宝药业集团股份有限公司;批号:20160817;规格:20 mg); p-Akt、p-JNK3、Caspase-3兔抗鼠单抗购自于英国Abcam生物公司;p65、p50、β-actin兔抗鼠单抗购自于美国SantaCruz公司;山羊抗兔IgG二抗购自于上海容创生物科技有限公司;苏木素、伊红染液购自于美国Sigma公司;BCA试剂盒购自于Thermo Fisher Scientific公司;RNA提取试剂盒、逆转录试剂盒购自于北京天根生化科技有限公司;仪器:全自动生化检测仪购自于BECKMAN公司;SOD、MDA酶联免疫检测试剂盒购自于Biovision公司;SMZ745尼康光学显微镜购于上海衡浩仪器有限公司;CFX96 PCR仪购自于美国BioRad公司;GIS-500凝胶成像仪购自于Miulab公司。
1.3 实验方法
1.3.1 脑缺血再灌注-肺损伤大鼠模型的建立
按参照文献[8]制备脑缺血再灌注大鼠,腹腔注射3 mg/g 20%水合氯醛进行麻醉,固定,消毒,分离颈总、内外动脉,用棉线于总动脉处环向绕1 cm,两侧线环交叉埋于皮下并缝合切口。随后转移大鼠至立体定位仪暴露颈椎后将注射器插入颈椎横突翼小孔内,轻柔旋转,当有血液流出时,说明椎动脉穿刺成功。24 h后打开颈部切口,采用显微镜动脉夹将双侧劲动脉夹住后阻断脑部供血,15 min后撤去动脉夹恢复脑部供血。造模后符合以下的大鼠确定为肺部感染:(1)精神萎靡、毛发光泽度差、进食量减少、饮水增多、体重降低、耳缘静脉突起加粗、鼻唇分泌液增多;(2)呼吸急促,肺部出现啰音。
1.3.2 动物分组以及给药方法
所有大鼠按照随机数字表法分为假手术组(仅暴露颈总动脉,不阻断血管)、模型组、清热化痰解毒方低、中、高剂量预处理组、阳性组(尼莫地平组),每组24只。(1)假手术组、模型组大鼠均灌胃等量生理盐水;(2)清热化痰解毒方低、中、高剂量药物剂量为7、14、28 mg/kg;(3)阳性组给药剂量为200 mg/kg尼莫地平。各组给药时间为预处理大鼠在造模前3日灌胃,每日2次,最后一次给药时间为造模前3 h,共给药7次。给药剂量参照人体表法[9]计算,成年人标准体重60 kg,大鼠给药剂量为成人的6.25倍,成人每日给药剂量为60 mg,所有大鼠平均体重220 g,则大鼠每日给药剂量为7 mg/kg。
1.3.3 动脉氧分压的测定
于大鼠右侧股动脉采集2 mL血液,采用全自动生化检测仪对动脉血氧分压(Partial pressure of oxygen,PaO2)进行测定,并计算氧合指数(oxygenation index, OI)。
1.3.4 大鼠肺泡灌洗液(bronchoalveolar lavage,BAL)中中性粒细胞(Polymorphonuclear neutrophil leukocyte,PMN)计数
各组选取12只大鼠进行支气管肺泡灌洗,利用自动血细胞分析仪对BAL中PMN进行计数。
1.3.5 大鼠肺组织湿干重变化
各组随机选取12只大鼠处死后,将右肺下叶用滤纸吸干水后置于玻璃试管中称重,所测重量为湿重,随后放置在干燥箱中,温度设为80℃,连续烘烤直至质量测定不变时此时重量为干重,计算大鼠肺组织W/D。
1.3.6 肺组织SOD、MDA以炎症因子检测
用无菌剪刀将肺组织剪碎,制作10%匀浆液,放置低温离心机中4000 r/min离心10 min,收集上清,采用酶联免疫法测定组织中SOD、MDA、TNF-α、IL-1β活性,具体参照试剂盒说明进行操作。
1.3.7 Western blot检测肺组织中Akt/JNK3/Caspase-3和NF-κB蛋白表达
肺组织剪碎后添加蛋白裂解液放置30 min,离心后收集上清液,参照蛋白提取试剂盒提取肺组织总蛋白,BCA法测定蛋白浓度,进行SDS-PAGE电泳、转膜反应,置于凝胶成像仪中观察Akt、p-Akt、JNK3、p-JNK3、Caspase-3、p65、p50蛋白表达情况。
1.3.8 免疫组化法检测肺组织中p-Akt、p-JNK3、p65、p50蛋白阳性表达
常规制备肺组织石蜡切片,免疫组组化法检测肺组织中p-Akt、p-JNK3、p65、p50蛋白,置于显微镜下进行观察统计阳性染色细胞数,计算阳性百分比=阳性数/细胞总数×100%。
1.4 统计学方法
2 结果
2.1 大鼠一般症状观察
大鼠在模型制备过程中,未出现死亡,造模成功大鼠共96只。假手术组大鼠精神状态较好,毛发光泽,饮水、摄食正常,体重逐渐增加,耳唇分泌液正常,呼吸正常。模型组大鼠出现精神萎靡、毛发光泽度差、进食量减少、饮水增多、体重降低、耳缘静脉突起加粗、鼻唇分泌液增多,呼吸急促,肺部出现啰音。经清热化痰解毒方治疗后,得到不同程度改善。
2.2 各组大鼠动脉氧分压以及PMN测定结果
与假手术组相比,模型组肺组织干湿重比值、中性粒细胞数升高,动脉氧分压、氧合指数均降低,差异有显著性(P< 0.05);与模型组相比,阳性组、清热化痰解毒方组W/D、PMN降低,PaO2、OI、PMN升高,具有剂量依赖性,差异有显著性(P< 0.05)。
2.3 肺组织光镜检测结果
假手术组肺泡结构完整,肺泡腔清晰,未出现炎性细胞浸润;与假手术组相比,模型组肺组织毛细血管扩张,弥漫性充血,出现炎性浸润,肺泡腔内有红细胞渗出以及炎性浸润,肺泡壁增厚、充血;阳性组、灯盏花素治疗组大鼠肺泡腔结构逐渐恢复、炎性细胞浸润减轻。见下图1。与假手术组相比,模型组大鼠肺组织病理评分升高,差异有显著性(P< 0.05);与模型组相比,阳性组、清热化痰解毒方组大鼠肺组织病理评分均降低,随着给药剂量的升高,肺组织病理评分逐渐降低,差异有显著性(P< 0.05)。给药后,假手术组、模型组、低剂量组、中剂量组、高剂量组和阳性组大鼠肺组织病理学评分分别为0、(3.78±0.74)、(2.87±0.52)、(2.28±0.71)、(0.97±0.28)和(0.64±0.17)分,各组组间比较差异有显著性(P< 0.05)。
2.4 各组SOD、MDA水平测定结果
与假手术组相比,模型组SOD降低,MDA、TNF-α、IL-1β升高,差异有显著性(P< 0.05);与模型组相比,阳性组、清热化痰解毒方组SOD升高,MDA、TNF-α、IL-1β降低,具有剂量依赖性,差异有显著性(P< 0.05)。见下表2。
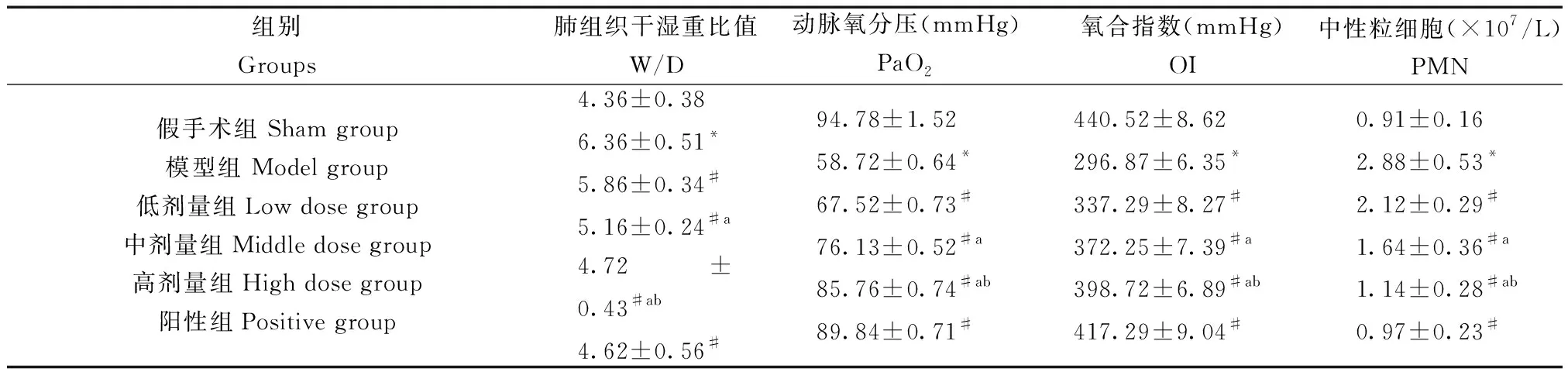
表1 各组大鼠W/D、PaO2、OI水平对比
注:与假手术组相比,*P< 0.05;与模型组相比,#P< 0.05;与低剂量组相比,aP< 0.05;与中剂量组相比,bP< 0.05。Note. Compared with the sham group,*P< 0.05. Compared with the model group,#P< 0.05. Compared with the low dose group,aP< 0.05. Compared with the middle dose group,bP< 0.05.
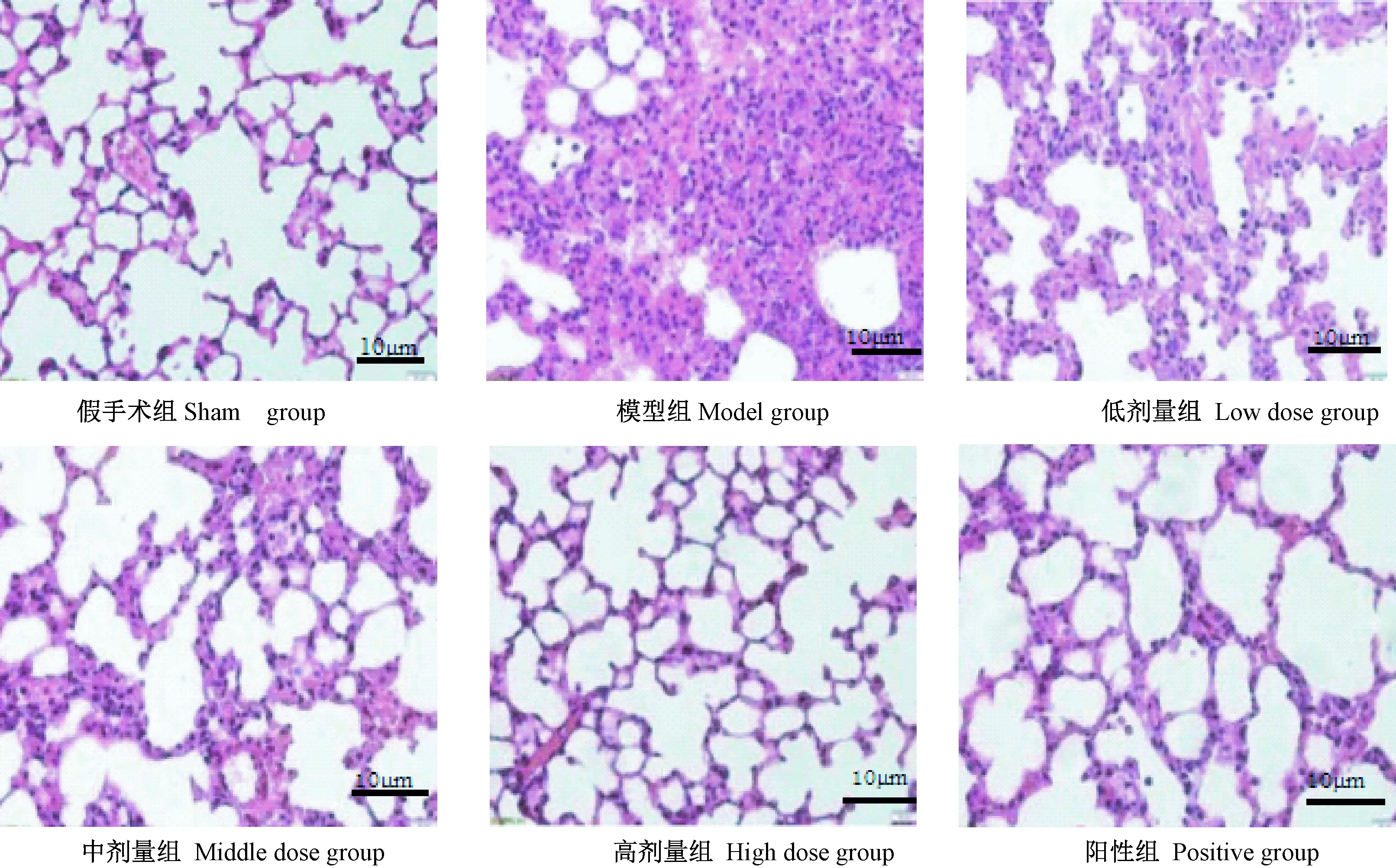
图1 肺组织病理形态学(HE染色,×400)
表2 各组大鼠SOD、MDA水平对比
Table 2 Comparison of SOD and MDA levels in rats in each group
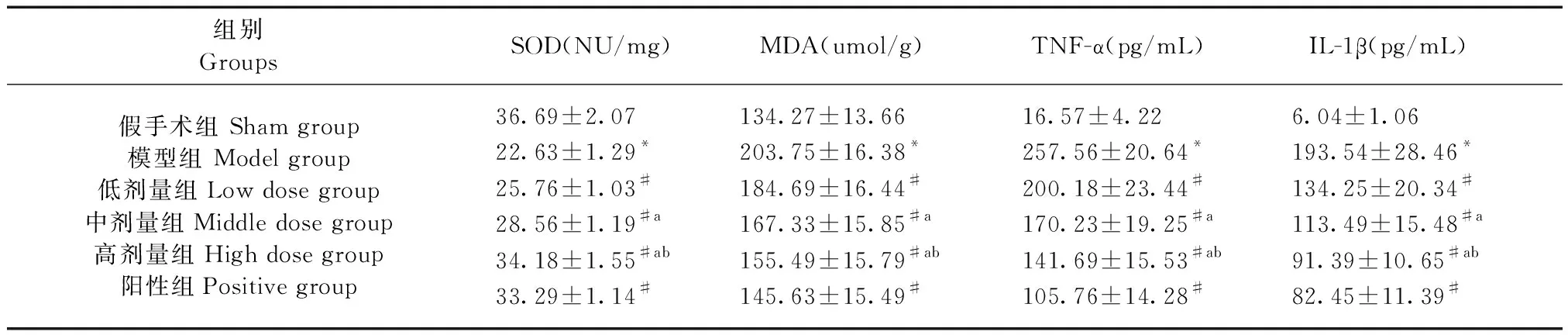
组别 GroupsSOD(NU/mg)MDA(umol/g) TNF-α(pg/mL) IL-1β(pg/mL) 假手术组 Sham group模型组 Model group低剂量组Low dose group中剂量组Middle dose group高剂量组High dose group阳性组Positive group36.69±2.0722.63±1.29*25.76±1.03#28.56±1.19#a34.18±1.55#ab33.29±1.14#134.27±13.66203.75±16.38*184.69±16.44#167.33±15.85#a155.49±15.79#ab145.63±15.49#16.57±4.22257.56±20.64*200.18±23.44#170.23±19.25#a141.69±15.53#ab105.76±14.28#6.04±1.06193.54±28.46*134.25±20.34#113.49±15.48#a91.39±10.65#ab82.45±11.39#
注:与假手术组相比,*P< 0.05;与模型组相比,#P< 0.05;与低剂量组相比,aP< 0.05;与中剂量组相比,bP< 0.05。Note. Compared with the sham group, *P< 0.05. Compared with the model group,#P< 0.05. Compared with the low dose group,aP< 0.05. Compared with the middle dose group,bP< 0.05.
2.5 Western blot检测肺组织中Akt、p-Akt、JNK3、p-JNK3、Caspase-3、p65、p50蛋白表达
与假手术组相比,模型组p-JNK3、Caspase-3、p65、p50蛋白表达升高,p-Akt蛋白表达降低,差异有显著性(P< 0.05);与模型组相比,阳性组、清热化痰解毒方组p-Akt、p-JNK3、Caspase-3、p65、p50蛋白表达降低,p-Akt蛋白表达升高,具有剂量依赖性,差异有显著性(P< 0.05)。各组Akt、JNK3蛋白表达无明显变化(P> 0.05)。见表3,图2。
2.6 免疫组化检测肺组织中p-Akt、p-JNK3、p65、p50表达
与假手术组相比,模型组p-JNK3、p65、p50蛋白阳性表达率升高,p-Akt蛋白阳性表达率降低,差异有显著性(P< 0.05);与模型组相比,阳性组、清热化痰解毒方组p-JNK3、p65、p50阳性表达率降低,p-Akt蛋白阳性表达率升高,具有剂量依赖性,差异有显著性(P< 0.05)。见表4。

注:A:假手术组;B:模型组;C:低剂量组;D:中剂量组;E:高剂量组;F:阳性组。
表3 大鼠肺组织中Akt、p-Akt、JNK3、p-JNK3、Caspase-3、p65、p50蛋白表达
Table 3 Expression of Akt, p-Akt, JNK3, p-JNK3, Caspase-3, p65, and p50 proteins in rat lung tissue

组别 GroupsAktp-AktJNK3p-JNK3Caspase-3p65p50假手术组 Sham group0.72±0.130.76±0.040.58±0.120.17±0.030.22±0.041.29±0.061.16±0.05模型组 Model group0.69±0.16*0.13±0.08*0.64±0.11*0.95±0.09*0.83±0.08*0.22±0.03*0.18±0.05*低剂量组Low dose group0.62±0.14#0.24±0.09#0.66±0.11#0.78±0.09#0.68±0.13#0.49±0.03#0.33±0.08#中剂量组Middle dose group0.67±0.12#a0.42±0.06#a0.63±0.14#a0.64±0.13#a0.52±0.06#a0.71±0.11#a0.76±0.06#a高剂量组High dose group0.70±0.16#ab0.58±0.13#ab0.61±0.13#ab0.48±0.08#ab0.38±0.09#ab0.97±0.09#ab0.92±0.07#ab阳性组Positive group0.60±0.18#0.63±0.05#0.56±0.12#0.21±0.03#0.26±0.05#1.11±0.08#1.05±0.06#
注:与正常组相比,*P< 0.05;与模型组相比,#P< 0.05;与低剂量组相比,aP< 0.05;与中剂量组相比,bP< 0.05。Note. Compared with the sham group,*P< 0.05. Compared with the model group,#P< 0.05. Compared with the low dose group,aP< 0.05. Compared with the middle dose group,bP< 0.05.

表4 肺组织中p-Akt、p-JNK3、p65、p50蛋白阳性表达
注:与正常组相比,*P< 0.05;与模型组相比,#P< 0.05;与低剂量组相比,aP< 0.05;与中剂量组相比,bP< 0.05。Note. Compared with the sham group, *P< 0.05. Compared with the model group,#P< 0.05. Compared with the low dose group,aP< 0.05. Compared with the middle dose group,bP< 0.05.
3 讨论
过往研究认为脑缺血早期容易导致肺损伤,且肺组织会出现典型病理特征,主要为肺泡结构变化、肺水肿、以及炎性浸润[10]。本研究采取脑中动脉线栓法制备脑缺血再灌注大鼠模型,结果显示模型组大鼠肺组织出现肿胀伴弥漫性肺出血,毛细血管扩张,弥漫性充血,出现炎性浸润,符合肺损伤特点[11-12]。进一步研究显示模型组W/D、PMN、TNF-α、IL-1β升高,PaO2、OI均降低,表明肺组织出现缺氧、炎症细胞浸润、氧化应激损伤,以上均提示脑缺血再灌注损伤大鼠肺损伤模型制备成功。在给予清热化痰解毒方后,大鼠肺组织炎症损伤有一定改善,W/D、MDA、TNF-α、IL-1β降低,PaO2、OI、SOD升高,提示清热化痰解毒方能够缓解肺部炎症损伤,降低氧化应激反应进而保护肺功能。
近期越来越多研究表明PI3K/AKT信号通路与肺损伤密切有关[13-15]。本研究结果显示模型组p-Akt蛋白表达降低,给予清热化痰解毒方后p-Akt蛋白表达升高,说明清热化痰解毒方缓解卒中大鼠肺部炎症损伤可能与激活Akt蛋白有关。JNK信号通路激活后使JNK蛋白中Thr位点发生磷酸化进而激活JNK,随后JNK进入细胞核内,发挥其生物学效应[16]。胰腺炎肺损伤大鼠发病初期p-JNK表达明显升高,且经干预后其表达明显降低,表明JNK蛋白参与胰腺炎肺损伤病理过程[17]。高氧肺损伤大鼠JNK信号通路激活可导致肺组织细胞大量凋亡,引发肺损伤[18]。本研究结果显示模型组p-JNK3蛋白表达降低,清热化痰解毒方组p-JNK3蛋白表达升高,提示清热化痰解毒方缓解卒中大鼠肺部炎症损伤可能与激活JNK3蛋白有关。
Caspases为细胞凋亡主要调节者,其能够激活DNA断裂因子引发细胞死亡,抑制Caspase-3表达可降低组织细胞凋亡,降低组织损伤[19]。本研究发现,清热化痰解毒方干预可使Caspase-3表达下降,提示清热化痰解毒方能够抑制Caspase-3表达进而减轻肺炎症损伤。NF-κB在机体内主要以二聚体形式存在,细胞未受到外界刺激时,NF-κB与抑制物IKBa结合,细胞受到刺激后,IKBa发生磷酸化后,使NF-κB转移至细胞核内,促进靶基因的转录[20-21]。本研究结果显示模型组肺组织中p65、p50蛋白表达明显升高,而给予清热化痰解毒方后能够明显降低p65、p50蛋白表达,提示清热化痰解毒方可能通过抑制NF-κB通路改善大鼠肺部炎症损伤。
综上所述,本研究成功制备卒中相关性肺炎大鼠模型,发现JNK3/Caspase-3和NF-κB信号通路激活,Akt通路被抑制;给予清热化痰解毒方发现其能够缓解卒中相关性肺炎大鼠肺炎症损伤,其机制可能与抑制JNK3/Caspase-3和NF-κB信号通路、激活Akt有关。然而本研究未能直接证实清热化痰解毒方缓解脑缺血再灌注肺损伤直接作用于肺,这还有待后续深入探究。
