生理性衰老小鼠的感染免疫模型建立
2018-11-02袁松华傅卫辉何涌泉徐建青张晓燕
袁松华,傅卫辉,何涌泉,徐建青,2,张晓燕,2*
(1.复旦大学附属公共卫生临床中心,上海 201508; 2.复旦大学生物医学研究院,上海 200032)
美国疾病预防控制中心发布的关于1976—2007年度全美流感病例报告显示,每年65周岁及以上的老年人群中每10万人的发病人数约为321.1,而18~64周岁的成年人群里每10万人的发病人数仅为39.9[1]。更为严重的是,因流感及流感样症状死亡的数量每年超过3.6万,其中89.1%是65周岁及以上老年感染者[2]。由此可见,老年人群是流感病毒感染风险系数最高的年龄组群。与年轻人群相比,老年感染者的症状更加严重,诱发慢性肺阻塞性疾病,充血性心力衰竭,哮喘以及心肌梗塞等慢性合并症[3]。即使体内流感病毒已经清除,一些重症的老年感染者会部分甚至全部丧失自主的日常生活能力[4-5]。因此,流感病毒感染老年人群引发的经济学和社会学问题,已经成为威胁公共卫生安全的重要挑战。
在流感病毒感染的极早期,老年感染者对体温升高重视不够,因流感样症状收治入院时间相对滞后。另外,重症流感的老年病患临床特点主要为,病程进展速度快,感染后易出现多种并发症,感染后致死率较高[6]。研究标本采集主要集中于外周血和咽拭子等。但肺内原位炎症、病理变化以及淋巴归巢应答研究等更深层次的机制研究,受标本取材、伦理等因素制约难以收集。此外,已经获批的特异性针对老年人群的有效流感抗病毒药物、流感疫苗的种类较少,现有抗病毒药物[7]或三价灭活疫苗的保护效果有限[8],一个科学的用于药物或疫苗有效性评估的动物模型是必需的。以上各种现实挑战亟待一个稳定可靠,同时具备一定拟合度的动物模型,用于研究老年流感病毒感染免疫应答。近交系小鼠模型是免疫学研究重要工具,遗憾的是,现有的研究关于老龄近交系小鼠流感感染免疫模型的报道并不明确。因此本课题组以流感病毒H9N2为模式病原,分别从体重变化、生存曲线、肺内病毒复制、肺内炎症因子表达以及肺的病理损伤情况等几个方面进行全面阐述,建立老年近交系C57小鼠的感染免疫模型。
1 材料和方法
1.1 实验动物
实验小鼠均选用SPF级别雌性C57小鼠,6~8周龄(18~19 g)和8月龄(22~24 g)各30只,购于上海西普尔-必凯实验动物有限公司[SCXK(沪)2013-0016]。8月龄小鼠在上海市公共卫生临床中心实验动物部SPF区域[SYXK(沪)2015-0008]继续饲养至18~24月龄(28~30 g)。
1.2 流感病毒
H7N9、H9N2病毒经MDCK细胞和鸡胚培养滴定后,-80℃储存备用。实验均在动物生物安全三级实验室(ABSL-3)中进行。[高致病性病原微生物实验室资格证书编号为卫BSL3-007;中国合格评定国家认可委员会实验室认可证书编号NO.CNAS BL0016],研究方法经过上海市公共卫生临床中心动物伦理委员会审查(编号为:2014伦审K007号)。
1.3 实验方法
1.3.1 老年小鼠流感病毒感染模型
受试小鼠提前24 h转入生物安全实验室适应,分为老年感染组、成年感染组、老年未感染对照组以及成年未感染对照组共计4大组,每组小鼠10只。小鼠腹腔注射100 μL 1%戊巴比妥钠溶液全身麻醉,5×106EID50H9N2或3.5×105TCID50H7N9流感病毒经鼻腔攻击,记录各组小鼠感染后连续14 d的体重变化、生存情况。
1.3.2 石蜡切片苏木精-伊红(hematoxylin-eosin, HE) 染色
将肺组织在10%的福尔马林溶液,静置固定24 h,包埋于石蜡中。蜡块制备为10 μm切片(白片)数张备用。60℃烤片1 h,依此在二甲苯,无水乙醇、95%乙醇、85%乙醇依次浸泡脱蜡3~5 min,PBS洗涤,苏木精染色5 min,自来水洗去苏木精染液,0.5%伊红染液染色1 min,自来水洗脱,85%乙醇、95%乙醇、无水乙醇、二甲苯依次脱水3 min,晾干,封片。切片由奥地利Tissue Gnostics类流式组织定量细胞分析仪拍摄分析。
1.3.3 炎症-趋化因子检测
收集感染急性期内(第1、2、3、7天)小鼠肺内灌洗液和外周血,肺灌洗液4℃,12 000 r/min离心5 min,分装上清,将外周血混入抗凝剂(3.8%枸椽酸钠溶液与全血1∶9混合)重复混匀,3000 r/min离心10 min,分装上清。分别取50 μL肺灌洗液、血浆和梯度稀释后标准品,依次加入50 μL预混多因子磁珠,50 μL PE标记的荧光染色溶液,室温避光孵育2 h。200 r/min离心5 min,用试剂盒内专用的洗涤缓冲液洗1次,最后每管标本终体积为100 μL。全部标本由美国BD公司的LSR Fortessa多色流式细胞仪分析获取数据。

注:图中黑色实线表示老年小鼠感染H7N9或H9N2流感病毒或者未感染后体重变化,图中虚线表示同等流感病毒感染条件下,成年对照小鼠体重变化。计算依据:体重变化=(时间点体重-初始体重)/初始体重×100%。
1.3.4 肺内流感病毒载量测定
分别在感染急性期内(第1、2、3、7天)小鼠肺组织,含10%FBS的1640培养液洗涤2次,每只小鼠取2 g组织,加入1 mL Trizol裂解液、直径1 mm小钢珠2粒,60 Hz超声破碎60 s,超声2次,组织悬液12 000 r/min 离心5 min,收集上清后,混入等体积的去离子水,剧烈振荡15 s,室温静置10 min。12 000 r/min离心10 min,弃去上清,加入500 mL异丙醇,室温静置10 min,12 000 r/min离心5 min,再次弃上清,500 mL75%乙醇洗涤1次,2000 r/min离心5 min,再次弃上清,RNA沉淀溶于100 μL的无RNA酶的去离子水中。RNA定量后,取1 μg RNA逆转录为cDNA后,使用SYBR试剂进行Real-time PCR扩增H9N2、GAPDH的序列。全部样品由德国Eppendorf公司的Realplex 4荧光定量PCR仪分析获取数据。扩增程序:42℃,10 min;95℃,1 min;95℃,15 s;60℃,45 s;45个循环。
1.4 统计学方法
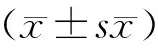
2 结果
2.1 与H7N9病毒相比,H9N2病毒感染老年小鼠体重变化和生存变化
在未感染的条件,两组小鼠体重波动在14 d内不超过5%(图1),作为环境对照可以确保研究环境是稳定安全的,影响小鼠的体重变化的单一因素是流感病毒的感染。感染H7N9流感病毒的老年小鼠体重下降速率快(图1),感染后第7天体重下降超过30%(成年对照22%,两组曲线无显著性差异),另一组老年小鼠感染H9N2流感病毒后前7天内迅速下降至25%左右,组内成年对照体重下降不超过10%,具有显著性差异(图1)。
进一步分析生存情况,感染H7N9的老年小鼠第5天死亡50%,第11天全部死亡(图2),而成年对照第8天死亡50%,第14天死亡在90%,两组小鼠的死亡速率和程度相近。H9N2感染模型生存终点显示,老年小鼠在感染死亡50%,成年对照无死亡(图2)。对比老年小鼠在H7N9和H9N2流感病毒感染过程中体重变化和生存情况,最终认定老年小鼠感染H9N2的流感感染模型更拟合临床感染实际情况。
2.2 感染H9N2流感的老年小鼠肺内病毒复制失控,肺内炎症表达变化
感染H9N2流感病毒后,老年小鼠肺内病毒复制在第2天达到峰值(每克肺内RNA病毒拷贝为3.2×104)(图3),第3天至第7天,肺内的流感病毒逐渐清除。在感染后第1、2、3和7天四个时间点,老年小鼠肺的病毒复制情况均显著高于成年对照(P< 0.001)。与成年对照相比,老年小鼠肺内流感病毒复制控制能力更弱。
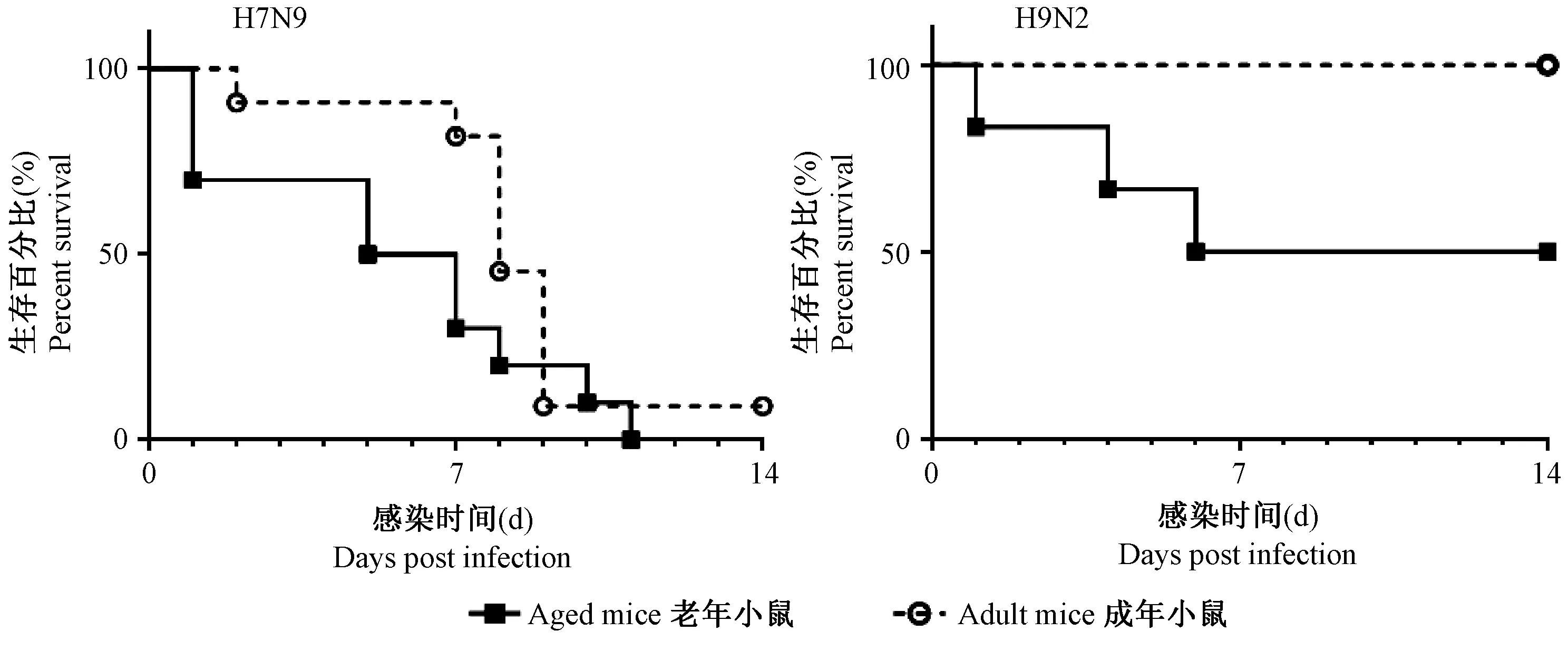
注:图中黑色实线表示老年小鼠感染H7N9或H9N2流感病毒后生存情况,虚线代表同等感染条件下成年小鼠对照。

注:图中四组bar依次代表小鼠感染H9N2病毒后第1、2、3和7天共计4个时间点肺内流感病毒相对载量拷贝。与成年对照组比较,*P< 0.05,**P< 0.01,***P< 0.001。
在感染后第1、2、3和7天四个时间点,收集100 μL肺泡灌洗液,检测具代表性的6类炎症-趋化因子。结果发现老年小鼠肺内炎症因子IL-6、趋化因子MCP-1急剧升高,在感染后第2天达到峰值,均超过4000 pg/mL,第3天至第7天炎症因子表达逐渐下降(图4a)。成年对照肺内炎症表达相对适度,峰值均未超过1000 pg/mL,感染后第3天迅速恢复至基线水平(图4b)。将峰值点的炎症-趋化因子分类分析发现,老年小鼠肺内炎症主要以炎症因子IL-6和趋化因子MCP-1为主(图4c),而成年小鼠肺内炎症因子包括炎症因子TNF-α、IL-6以及负调控因子IL-10(图4d)。
2.3 感染H9N2流感的老年小鼠肺内损伤情况和修复时间
在未感染的条件下,相比与成年对照,老年小鼠的肺泡增大,致密性更低。感染H9N2病毒第1天,老年小鼠肺内出现大量的炎性细胞,肺泡壁开始增厚,肺泡结构少量出现破损,在第2、3天,肺泡结构严重破环,大量红细胞渗入肺间隙,大量肺泡壁增厚。感染后第7天,肺泡结构部分修复,尚有大量的炎性细胞和少量的红细胞滞留在肺间隙内。感染H9N2病毒后,成年小鼠肺内出现适量的炎症细胞侵润,但肺泡结果相对完整。感染后第7天,肺泡结构修复良好,肺内炎性细胞很少潴留或几乎没有(图5a)。
根据文献中的评分体系(表1)[9],对两组小鼠的肺内动态病理损伤情况进行定量分析。统计结果提示老年小鼠感染H9N2病毒后第1、2、3和7天,肺组织损伤评分均显著高于成年对照(图5b)。感染后第7天,老年小鼠肺内损伤没有完全修复,成年小鼠肺内损伤修复良好。
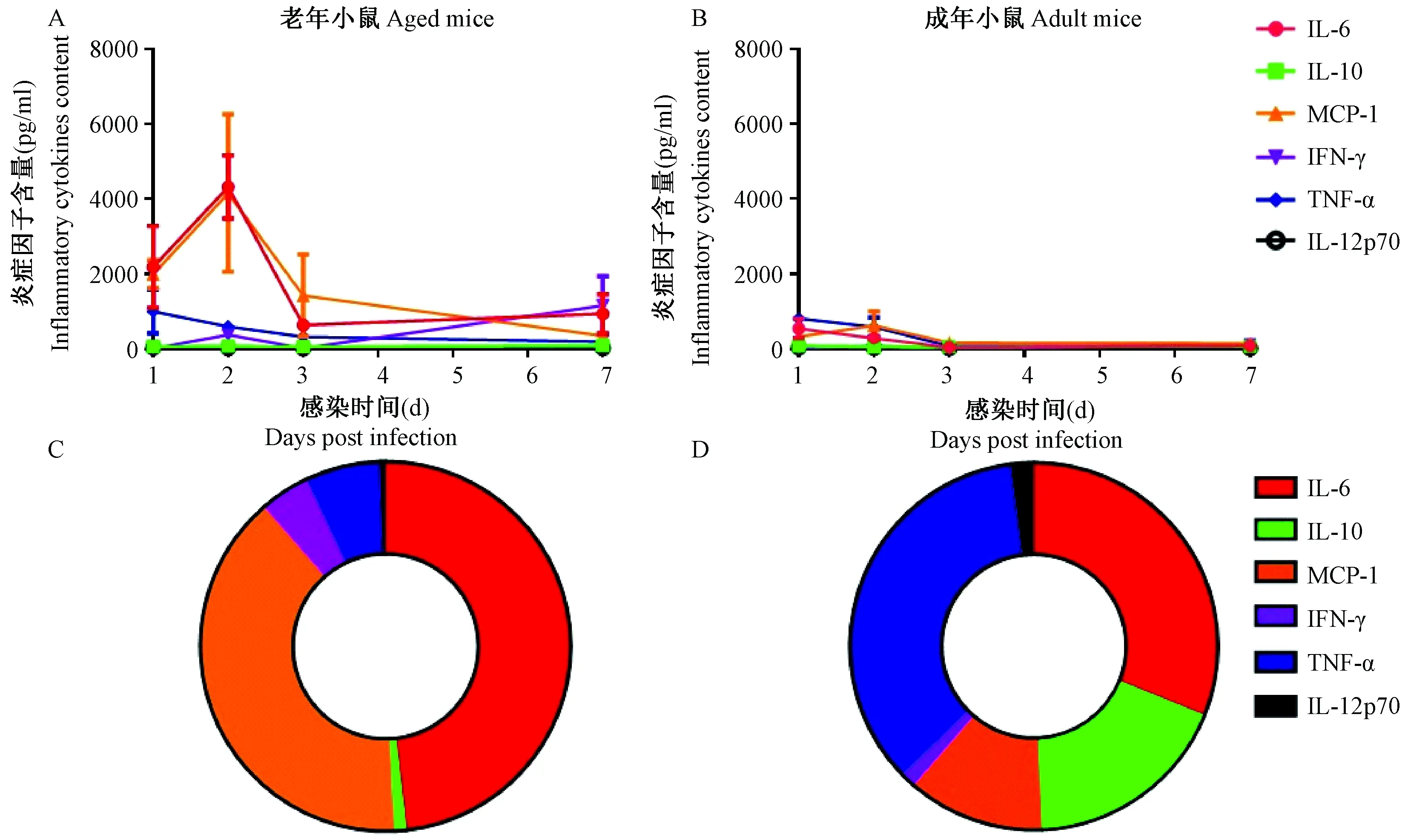
注:图a、b依次代表小鼠感染H9N2病毒后第1、2、3和7天共计4个时间点肺内灌洗液中多个炎症-趋化因子动态变化。图c、d代表感染后第2天(炎症表达峰值时间点)肺内炎症-趋化因子的组成比例。左侧图a、c为老年小鼠,右侧图b、d为成年对照,分别检测了第0,1,2,3,7天5个时间点。
表1 肺组织病理检查评分系统
Table 1 Scoring system for histopathological examination of lung tissue

参数Parameter描述Interpretation打分Score肺泡细胞数量Inflammation无No inflammatory cells in alveolar00~5个细胞0-5 cells in alveolar15~10个细胞5-10 cells in alveolar2>10个细胞>10 cells in alveolar3肺泡壁水肿程度Edema无Absent0肺泡壁增厚Increased swelling of alveolar walls1肺泡壁增厚:纤维蛋白渗出Increased swelling of alveolar walls and fibrinous2大量肺泡壁增厚:纤维蛋白渗出Widespread swelling of alveolar walls and fibrinous3红细胞渗出数量Hemorrhage<5个红细胞<5 erythrocytes in alveolar05~10个红细胞5-10 erythrocytes in alveolar110~15个红细胞10-15 erythrocytes in alveolar2>15个红细胞>15 erythrocytes in alveolar3肺泡破损程度Atelectasis无Absent0小面积肺不张Small atelectasis areas involved1大面积肺不张:形成1~5小叶Large atelectasis areas and some lobules involved2形成>5个小叶Several lobules involved3
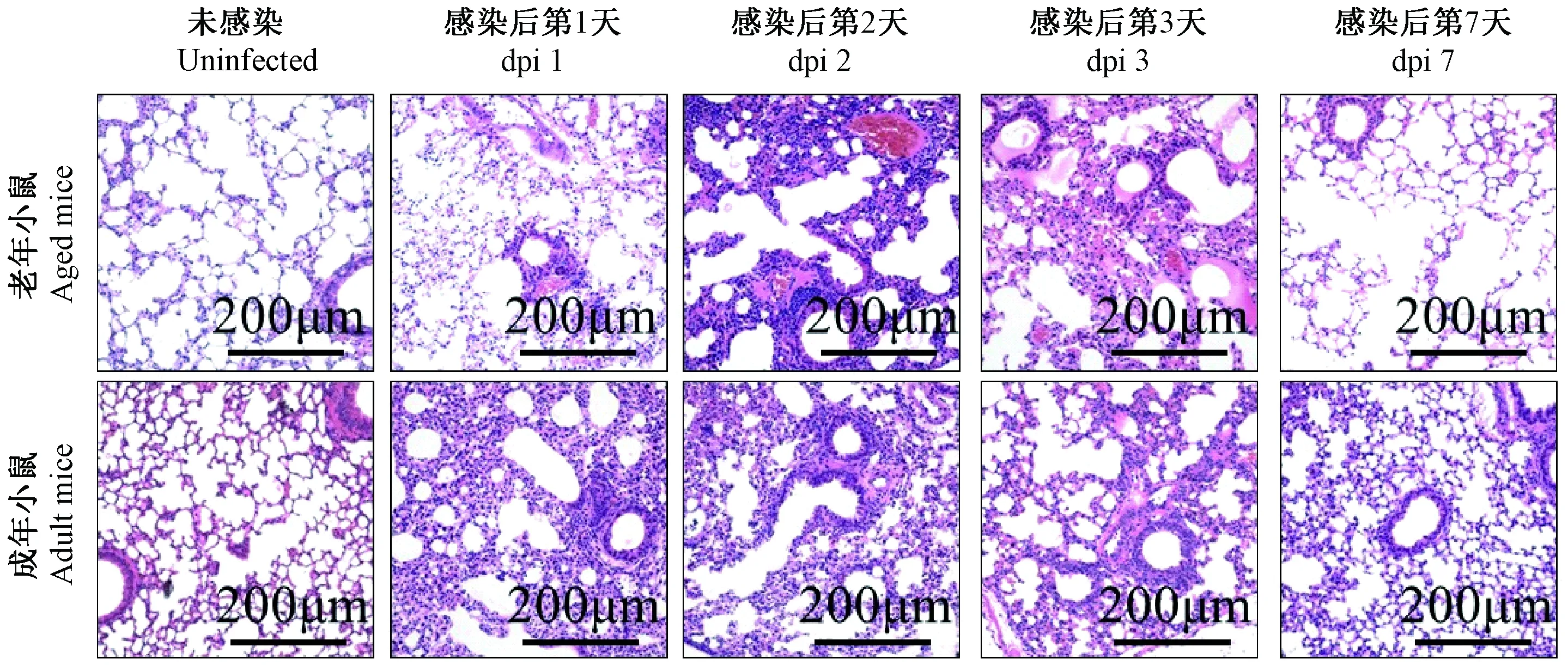
注:上行显示的是老年小鼠在感染H9N2后第0、1、2、3和7天共计5个时间点的肺组织HE染色结果,下行显示的是成年小鼠在H9N2感染过程中对应时间点的肺HE染色结果。

注:根据美国胸科医师协会官方杂志Chest中关于急性肺损伤模型报道,拟定肺病理损伤的评判标准分为肺泡内外炎性细胞数量,肺泡壁水肿程度,红细胞渗出数量以及肺泡破损严重程度四个方面,每一项目依据损伤的轻重程度,依次计分为0~3分。小鼠肺组织损伤最终得分四个项目得分之和,结果得分越高,代表肺损伤越严重。
3 讨论
部分研究选用基因组DNA片段错误编辑产生的基因型早衰小鼠[10]或化学试剂如D-半乳糖处理产生的诱导型早衰小鼠模型[11],这类模型小鼠的生理学特征是出生后数周内,机体表现出脏器老化、免疫衰老等的老年症状。这些人工促衰老模型,会出现部分共性衰老特征,然而与生理性衰老模型具有显著的区别[12]。生理性衰老的宿主具有胸腺输出能力不足、体液抗体分泌能力下调以及免疫细胞表面受体多样性缩减的免疫衰老的特征[13],如果选用人为衰老小鼠作为研究对象,不能科学地模拟老年宿主感染现状。因此,本课题组选用的生理性衰老,月龄为国际标准的18~24月[14],一直生活于SPF级环境的近交系C57小鼠。该模型小鼠的主要免疫学特点是体内不含特定病原体,同时免疫性质高度一致,适合免疫学群体的研究和评价。本课题组选用C57小鼠感染流感病毒,建立合适的病毒感染模型,主要评价感染后免疫应答,有助于解析老年宿主体内病理学、免疫学相关机制。
从病原学角度分析,H7N9流感病毒属于2013年中国东部出现的新发的高致病性禽流感病毒,其中6/8的基因组片段重组来源于东亚地区家禽、水鸟类中普遍潜伏的野生型低致病性H9N2禽流感病毒[15]。H7N9[16]、H9N2[17]病毒的攻毒剂量标准均参照前期成年小鼠感染模型中等同剂量。高致病性H7N9流感病毒感染后,两组不同月龄的小鼠体重下降速率和死亡情况的差异较小,与临床感染情况不符合。本课题组尝试梯度稀释10倍,发现老年小鼠感染后,第7天开始出现死亡,第14天组内小鼠全部死亡,体重下降速率和生存曲线类似,病理症状出现由感染后第1天,调整至第7天(数据未显示)。老年小鼠感染H9N2流感病毒后7天内,体重下降20%以上,死亡达到50%,与6~8周成年C57小鼠有显著区别。因此,本课题组认为H9N2流感病毒更适合老年小鼠流感病毒感染模型的病原。
2013年收治入院的H7N9流感病毒感染者临床研究发现,65周岁以上的老年人占比为72.2%(13/18),死亡率为22.2%(4/18),均高于成年人的住院率27.8%和死亡率11.1%[18]。年龄和恢复时间进行线性回归统计,结果显示随着年龄越大,感染恢复(住院天数)时间越长,呈显著正相关回归关系(P=0.0194)。另外在感染者血浆炎症动态学分析发现[19],老年感染者外周血中炎症因子IL-6(> 80 pg/mL),趋化因子IL-8(> 60 pg/mL)的分泌水平显著高于成年对照(P=0.003,P=0.03),绝对数值超过基线水平的10倍以上。肺组织病理切片同时清晰提示了H7N9老年感染者肺泡细胞壁增厚,肺泡间隙进一步被压缩,更多的炎性淋巴细胞趋化至病灶,肺损伤程度甚于成年。从模型可以看出老年小鼠组的体重下降速率、生存率,前7天肺内病毒控制情况,肺灌洗液中炎症因子的表达均显著高于成年对照,更符合临床实际情况。
重症流感的老年感染者临床突出表现为发热、咳嗽、呼吸困难以及上呼吸感染等,早期诊断主要评价呼吸频率、心率增快,谷丙转氨酶、胆红素为指标的肝功能异常,血小板计数降低等常规生化指标。但是由于老年感染者的临床表现与炎症指标相对不特异,现有临床指标正常值范围均基于健康成年人群界定的。本课题组通过18~24月龄的老年C57小鼠H9N2流感病毒感染模型,在感染期重现了老年宿主发病率、死亡率更高的临床现象。在急性感染期,发现老年宿主肺清除流感病毒的能力更弱,肺内炎症因子IL-6、趋化因子MCP-1更高水平,感染后肺组织损伤程度更为严重。因此,本课题组成功建立老年小鼠感染免疫模型,以肺内炎症因子IL-6和趋化因子MCP-1为特异性早期免疫指标评估老年宿主感染病毒后肺内病毒清除情况以及肺脏损伤与修复情况。
