幼羊颅骨缺损模型中颅骨组织Dlx2基因的表达及意义分析
2018-11-02毕玉杰张春阳
毕玉杰,周 昊,崔 阳,邵 国,张春阳*
(1.内蒙古科技大学包头医学院第一附属医院神经外科,包头 014010; 2.内蒙古包头医学院生物医学研究中心,包头 014040; 3.内蒙古科技大学包头医学院生物化学及分子生物学教研室,包头 014040; 4.首都医科大学宣武医院低氧适应转化医学北京市重点实验室,北京 100053)
各种原因造成的小儿外伤的发生率日益升高,在各类外伤中,颅脑外伤位居首位。颅骨作为脑组织的天然保护屏障,若其受到损伤,后果不堪设想。尤其对于小儿这一特殊群体,正处于生长发育的关键时期,若颅骨修补的选择不当,可能会对小儿的一生造成难以想象的后果[1]。截止目前,针对小儿颅骨缺损的修复问题,尚缺乏理想的修复方案,学者们纷纷从修复的必要性、时机、材料选择等各个宏观的角度进行了研究[2-3],而利用组织病理学、分子生物学技术和生物信息方法,从组织、细胞、分子和信号传导途径等层面,研究如何修复缺损区的颅骨组织可能还需进一步的补充。
DLx基因家族是同源盒基因系的一个分支,包括DLx2、DLx3、DLx5等,这些基因在颌面骨的发育中起重要作用[4-6]。剔除DLx2基因的新生小鼠出生后就死亡,并发现第一鳃弓衍化为畸形上颌突且(或)长骨发育异常[7-8]。DLx3诱导的成骨细胞骨形态发生蛋白2(BMP-2)是通过p38/Smad5信号通路调控[6]。DLx5是BMP信号通路的靶基因,并且在骨形成和胚轴背腹侧的形成中起重要调控作用[5]。这些结果提示DLx基因家族可能在颅面骨的发育和分化中起重要的调控作用。
Dlx2基因作为Dlx基因家族的一员,在调控细胞周期和凋亡、组织稳态发展、器官形态发育等方面发挥着重要的作用[9-10]。小儿颅骨的生长方式属于膜性成骨,成骨细胞的作用较活跃,能促进缺损边缘处产生新的骨基质,最后形成富有活力的骨组织[11]。基质矿化是骨形成过程中的一个重要阶段,也是一个紧密的有规律的过程,DLx2基因在参与调控成骨细胞的矿化过程中起重要作用[12]。目前关于Dlx2基因与骨代谢方面的研究多以鼠作为实验动物,且大多局限于细胞层面,选择与人类亲缘更近的绵羊进行研究,探寻幼羊颅骨组织中Dlx2的表达情况,国内外鲜有报道。本组实验主要利用幼羊缺损模型,观察颅骨缺损区域的新生骨组织中Dlx2的表达情况,从分子生物学的角度为小儿颅骨缺损的修复提供一定的思路。
1 材料和方法
1.1 实验动物
普通级雌性1月龄小尾寒羊10只,体重4.5~5.2 kg,来源于内蒙古科技大学包头医学院动物实验室[SCXK(蒙)K2016-0003],无菌手术在内蒙古科技大学包头医学院第一附属医院中心实验室[SYXK(蒙)K2005-0019]进行,动物实验由内蒙古科技大学包头医学院医学生物学研究所动物实验伦理审查委员会通过,伦理审批IACUC号:2016-033,实验过程中按3R原则给予实验动物人道的关怀。
1.2 主要试剂与仪器
Trizol(美国Ambion公司);反转录试剂盒(上海生工,B532445);2XReal-time PCR Mix(南京博尔迪,BR101);Dlx2基因和内参β-actin基因的引物(南京金斯瑞);兔源Dlx2抗体(英国Abcam公司,ab28461);兔源Histone抗体(美国cell signaling公司,#4499);辣根过氧化物酶标记的驴抗兔二抗(北京博奥森公司,bs-0295D);ECL化学发光显色试剂盒(北京普利莱公司,P1010);枪头与离心管(美国Axygen公司)。
自动双重纯水蒸馏仪(上海本波仪器有限公司,SZ-98);立式压力蒸汽灭菌器(日本坪山制作所株式会社,HVE/HVA);干燥箱(上海善志,DHG-9023 A);低温高速离心机(德国eppendorf公司,Crntrifuge5424 R);小型垂直电泳槽(美国BIO-RAD公司,1658001);电泳仪电源(美国BIO-RAD公司,1645050);凝胶成像系统(中国天能公司,1600);普通PCR仪(美国MJ Research公司,26665);超微量紫外分光光度计(美国Thermo公司,NanoDrop 2000);ABI7900荧光定量PCR扩增仪(美国ABI公司,ABI7900HT FAST);超声波破碎仪(宁波科生超声设备有限公司,JY98-Ⅲ);常温离心机(北京大龙兴创实验仪器有限公司,D1009);漩涡混合仪(北京大龙兴创实验仪器有限公司,Mx-s);全自动酶标仪(美国Thermo公司,Multiskan FC);摇床(美国Thermo公司);Western blot 化学发光成像系统(中国天能科技有限公司,Tanon4200SF);微量移液器(北京大龙兴创实验仪器有限公司);-80℃超低温冰箱(美国Thermo公司);-20℃冰箱和4℃冰箱(中国海尔公司)。
1.3 实验方法
1.3.1 颅骨缺损模型的制作与取材
给予小尾寒羊3%戊巴比妥钠溶液按照1 mL/kg体重,经颈外静脉注射麻醉后平卧于手术台上,待麻醉满意后进行手术。头顶备皮,在手术室内用2.5%的碘伏和75%的酒精常规消毒皮肤,铺无菌手术洞巾,无菌条件下,由两眼眶上缘连线中点至外耳道连线的中点线形切开头顶部皮肤,切透骨膜并向两侧牵开,充分暴露颅骨(图1),用环形铣刀铣出直径3 cm大小的颅骨缺损。双氧水和庆大霉素盐水反复冲洗手术区预防感染,将骨膜尽量平整的平铺在颅骨缺损区上,取出牵开器,全层缝合头皮。术后三天,每只羊给予青霉素320万单位,分两次肌肉注射。术后七天拆线。10只幼羊在相同饲养条件下,于1个月后宰杀,分别取缺损区新生的骨组织及其邻近的原生骨组织置于事先做好标记的冻存管中,储存在-80℃的冰箱中备用。
1.3.2 Real-time PCR检测颅骨组织Dlx2 mRNA的表达
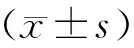
1.3.3 Western blot检测颅骨组织DLX2蛋白的表达
将-80℃冰箱取出的颅骨组织,液氮中冻存过夜,均加入RIPA强裂解液(上海碧云天生物技术有限公司),用手持式匀浆器和超声粉碎的方法,裂解10 min,将骨组织蛋白全部裂解,离心取上清,加入蛋白酶抑制剂(北京普利莱公司)。总蛋白经BCA法定量,加入6xLoading Buffer上样缓冲液和抗氧化剂,于100℃加热5 min使蛋白变性,-20℃保存备用。取10 μg总蛋白于8%SDS-PAGE胶中依次行电泳、转膜、5%的脱脂牛奶封闭,1xTBST洗涤后PVDF膜上检出目的蛋白和内参蛋白的条带,将膜剪开后,分别加入兔源Dlx2抗体(1∶800,英国Abcam公司)和兔源Histone抗体(1∶1000,美国cell signaling公司),4℃孵育过夜。第2日吸弃一抗后,1xTBST洗涤3次,每次10 min,加入辣根过氧化物酶标记的驴抗兔二抗(1∶1000,北京博奥森公司)孵育2 h,再次洗涤后,加入预先配置好的ECL发光液(A液∶B液=1∶1,北京普利莱公司),于Western blot化学发光成像系统曝光、显影。通过Image J软件进行灰度值测量,以Histone为内参,各条带灰度值作为目的蛋白DLX2的相对表达量。
1.4 统计学分析
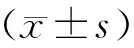
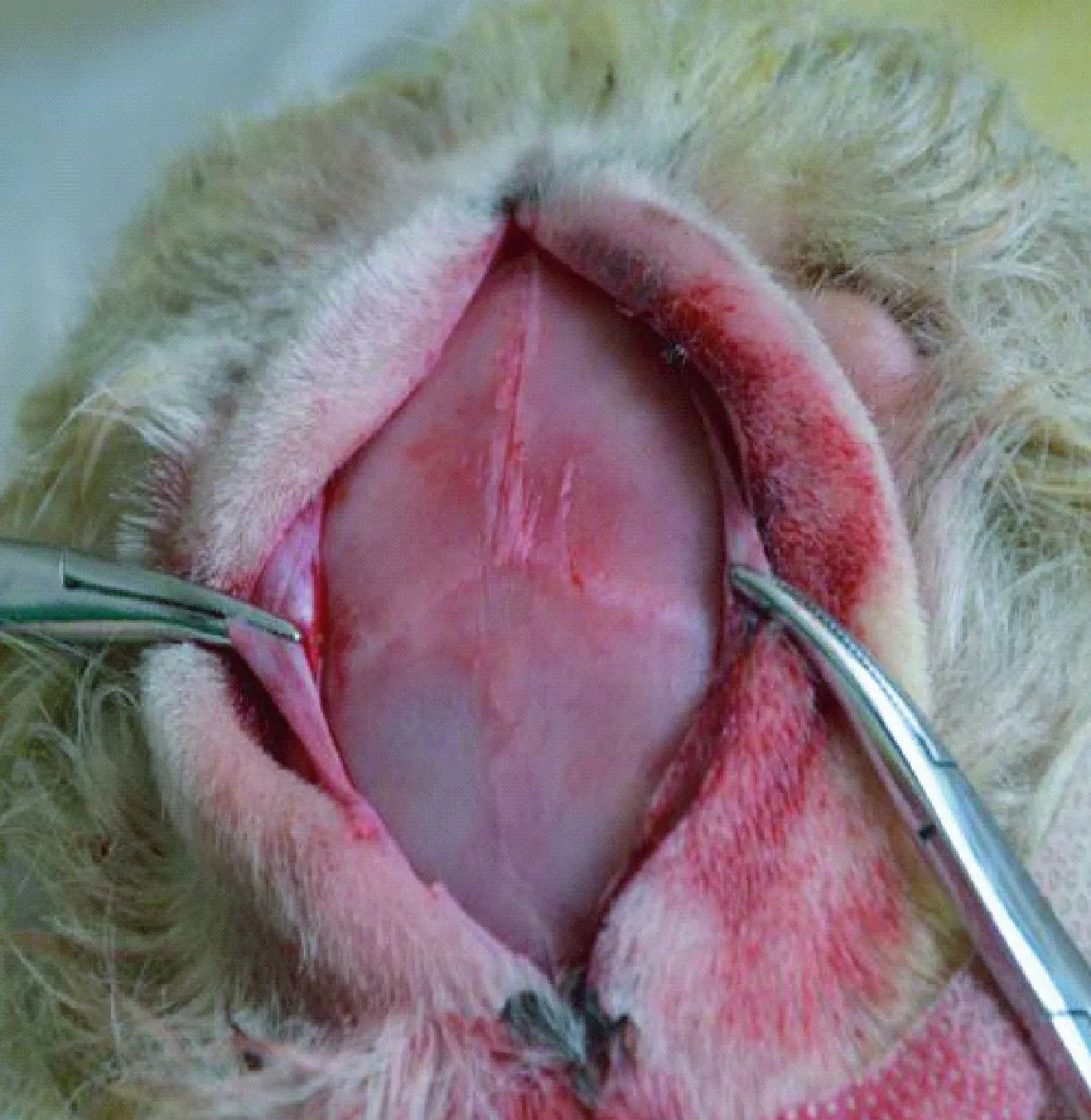
图1 切开后牵开暴露颅骨
2 结果
2.1 造模情况
造模完成后肉眼观察小尾寒羊颅骨有一直径3 cm左右的圆形骨缺损(图2),1个月后宰杀取材。

图2 颅骨缺损模型
2.2 Dlx2在缺损区新生骨组织及邻近的原生骨组织中mRNA的表达变化
通过对10对小尾寒羊颅骨缺损样本进行Real-time PCR的检测,比较了缺损区新生骨组织和邻近的原生骨组织中Dlx2 mRNA的表达变化。缺损区新生骨组织中Dlx2基因的相对丰度值为(0.04051±0.005465),邻近的原生骨组织中Dlx2基因的相对丰度值为(0.02388±0.004418),Dlx2在缺损区新生骨组织中的mRNA表达水平高于邻近的原生骨组织(P< 0.05),差异有显著性。(图3)
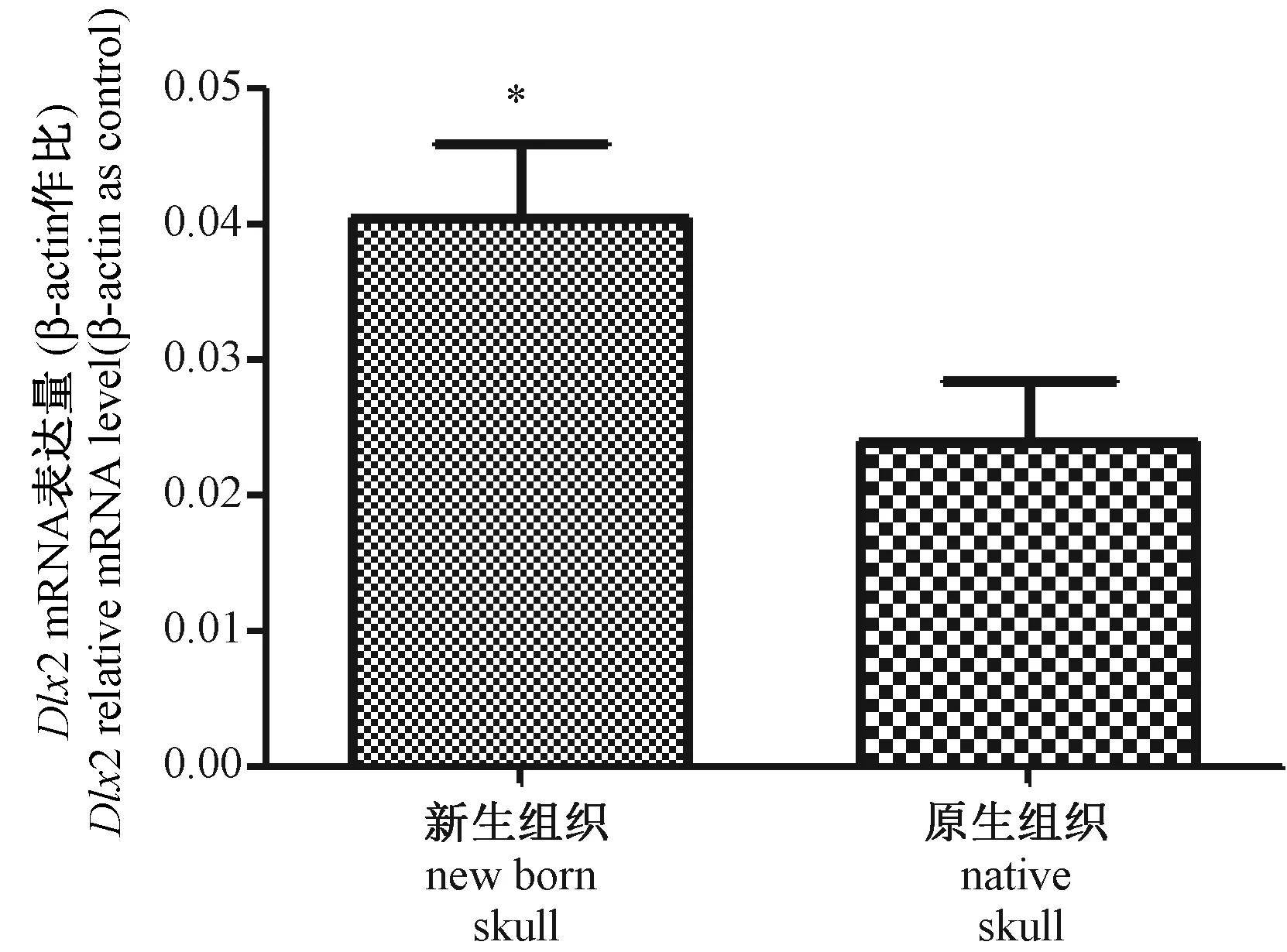
注:与原生骨组织组比较,*P < 0.05。

注:与原生骨组织比较,*P < 0.05。
2.3 DLX2在缺损区新生骨组织及邻近的原生骨组织中蛋白的表达水平
通过对10对小尾寒羊颅骨缺损样本进行Western blot的相对灰度值检测,比较了缺损区新生骨组织和邻近的原生骨组织中DLX2蛋白的表达变化。缺损区新生骨组织中Dlx2基因的相对灰度值为(6.308±0.8227),邻近的原生骨组织中Dlx2基因的相对灰度值为(2.328±0.4398),DLX2在缺损区新生骨组织中的蛋白表达水平高于邻近的原生骨组织(P< 0.05),差异有显著性。(图4)
3 讨论
颅骨作为脑组织最直接的保护屏障,若其缺损,对人的一生将会产生难以预测的影响[14]。颅骨缺损在小儿中的发生并不少见,据统计,跌倒坠落伤、交通事故伤在所有致伤因素中所占比例最高,依次为56%、29%,其次为碰撞伤(4%)、砸伤(1%)及其他原因不明因素伤(9%)[15]。尽管在小儿颅骨缺损方面的研究如火如荼,但大多局限于宏观方面,由于其相比成人有一定的年龄特殊性,其按照成人修补方式进行修补的弊端也是显而易见的,例如覆盖式修复可能限制颅骨发育,非降解材料填充修复可能致骨窗边缘和修复材料的对抗,均可导致颅骨发育畸形[16],所以,小儿颅骨缺损修补给临床医生增加了难度。与其他部位骨质缺损相似,若想进行颅骨缺损修复,也可利用一系列的分子机制进行调控等。
颅骨组织由细胞、纤维和基质构成,骨细胞是骨组织的主要细胞,而一个成骨细胞在3~4 d内可分泌其三倍体积的基质,然后自身埋于其中,即变为骨细胞[17],所以成骨细胞在骨组织的生长发育、骨量平衡的调节中发挥着关键作用。Dlx2调控生物体头颅颌面部骨骼的发育[18-19],在成骨细胞增殖、分化和成熟过程中起作用,可能直接参与骨细胞功能调控和骨形成过程[12]。有学者指出,Dlx2的表达可以诱发钙黏蛋白和神经细胞黏附因子的高表达,使神经嵴细胞黏附性增加,出现细胞的聚集,促进骨的生成[20]。本实验发现Dlx2在颅骨缺损区的新生骨组织中更高,与以上学者的研究结果一致。本实验通过检测颅骨缺损区的新生骨组织及其邻近的原生骨组织中Dlx2的mRNA表达水平发现,在两个区域中存在差异表达,与此同时,DLX2蛋白表达在颅骨缺损区的新生骨组织中表达增加。结果提示Dlx2表达增加与颅骨缺损区颅骨组织的新生可能密切相关。
从微观分子方面入手,研究调控颅骨生长的相关因子及机制,利用分子生物学的方法探索小儿颅骨缺损修补的新手段,尚有很大的探寻空间[21]。据报道,DLx2应该是成骨分化过程中一个关键分子[4,22-24],在Dlx2mRNA的3’端中有一个假定的mir-539结合序列,Dlx2作为mir-539的一个目标基因,mir-539可以通过靶向Dlx2参与成骨前细胞分化[20]。本研究结果提示,在新生的颅骨组织和其邻近的原生骨组织中Dlx2表达存在差异,Dlx2的相对高表达主要表现在颅骨缺损区域新生骨组织的Dlx2 mRNA和DLX2蛋白等分子水平,在此过程中,Dlx2的骨基质形成和成骨分化均有助于颅骨缺损区的组织生长,促进颅骨缺损的修复。因此,笔者猜测,可以将Dlx2作为调节颅骨缺损修复新的治疗研究靶点。
本实验研究结果显示,颅骨缺损区新生的骨组织Dlx2的表达较其邻近的原生骨组织高,笔者推测,Dlx2可能对颅骨缺损的修复起着重要作用[22-24]。在未来的研究中,Dlx2可能作为骨代谢和骨生长新的靶点,对其具体的调控通路和调控机制进行更深入的探索。由于本实验只是检测了10对小尾寒羊的颅骨组织标本,样本量相对有限;而且,本实验采用小尾寒羊作为研究对象,与人类毕竟不是同一物种,可能存在物种差异性。只有将这些问题充分地解决好,才能真正有可能将这些科研成果应用于临床上小儿颅骨缺损的修补。
