肝癌干细胞CD90+和ESA+亚群生物学特性研究
2018-10-31刘辉琦孙立新孙力超杨治华冉宇靓
刘辉琦,舒 雄,孙立新,遇 珑,孙力超,杨治华,冉宇靓
(1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院 细胞及分子生物学实验室,北京 100021)
肝癌是消化系统常见恶性肿瘤,全球范围内发病率位列恶性肿瘤的第5位,死亡率位列第2位[1-2]。据统计2012年全球新发肝癌病例782,500例,死亡745,500例,其中50%的新发及死亡病例均在中国[3]。肝癌病例中70%~85%的原发肝癌是肝细胞肝癌[4]。目前,主要通过影像学及实验室检查进行诊断,但发现时多已进展为中晚期,失去最佳治疗时机。肝癌的治疗仍以手术为主,并配以放疗、化疗、生物治疗等手段以最大可能去除肿瘤细胞,但治疗效果并不明显,仍有50%~80%的病人因复发、耐药在5年内死亡[5]。肿瘤干细胞(cancer stem cells,CSCs)或称为肿瘤起始细胞(tumor-initiating cells,TICs)是近年研究发现在肿瘤组织中存在的一小群具有干细胞特性的肿瘤细胞,它们与肿瘤的异常增殖、侵袭、转移、耐药、复发等生物学行为有着密切的关系[6]。目前已经证实在包括肝癌在内的多种肿瘤中存在有肿瘤干细胞,并通过不同表面标记物鉴定了不同的肝癌干细胞亚群[7-8]。对肝癌细胞中不同干细胞亚群的表达及生物学特性进行研究将有助于进一步了解肝癌干细胞在肿瘤发生、发展中的作用,并对临床个性化治疗提供新思路。
1 材料和方法
1.1 材 料
人肝癌MHCC97L细胞系由中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室保存。常规细胞培养液(美国 Gibco),胎牛血清(美国Hyclone),DAPI(美国Sigma),甲基纤维素(美国Sigma),表皮生长因子(美国Gibco)、碱性成纤维细胞生长因子(美国Gibco)、白血病抑制因子(美国Gibco)、无血清细胞培养因子B27(美国Gibco),肝素(常州千红),FITC标记CD90抗体(美国eBioscience)、PE标记ESA抗体(美国eBioscience)、顺铂(美国Hospira)、CCK8(日本东仁)、Transwell小室(美国millpore)。
1.2 细胞培养及传代
人肝癌细胞系MHCC97L用含10%胎牛血清,2 mmol/L谷氨酰胺、100 U/mL青霉素、100 U/mL链霉素的DMEM-H(Dulbecco's Modified Eagle Medium-High Glucose)培养液培养。培养条件:37 ℃、5%CO2孵箱中饱和湿度培养,隔天换液。待细胞长至90%左右满时,0.2%胰酶和0.1%EDTA消化培养的细胞进行传代,每周传代2次。37 ℃、5%CO2孵箱中培养5 d,活细胞流式检测并分选。无血清球体细胞培养采用含有表皮生长因子(20 ng/mL)、碱性成纤维细胞生长因子(20 ng/mL)、白血病抑制因子(10 ng/mL)、肝素(375 U/mL)、无血清细胞培养因子B27(1∶50)的DMEM-F12(Dulbecco's Modified Eagle Medium-F12)无血清培养基中培养。
1.3 流式细胞术检测MHCC97L细胞中ESA+和CD90+细胞表达比例
无菌条件下消化细胞为单细胞悬液,无菌磷酸盐缓冲液洗涤两次,加入荧光标记ESA和CD90抗体,细胞孵育密度为1×106/mL,室温孵育1 h,无菌磷酸盐缓冲液洗涤3次,用含1%胎牛血清的无菌磷酸盐缓冲液重悬,过筛网后流式细胞仪检测阳性细胞表达比例。
1.4 流式细胞术分选MHCC97L细胞中ESA+和CD90+细胞
无菌环境中消化细胞为单细胞悬液,无菌磷酸盐缓冲液洗涤两次,加入荧光标记ESA和CD90抗体,细胞孵育密度为1×106/mL,室温孵育1 h,无菌磷酸盐缓冲液洗涤3次,用含1%胎牛血清的无菌磷酸盐缓冲液重悬,过筛网后流式分选仪分选阳性细胞进行功能实验。
1.5 干细胞成球检测MHCC97L细胞中ESA+和CD90+细胞自我更新能力
将流式分选获得的ESA+、ESA-、CD90+、CD90-细胞及亲本细胞制备单细胞悬液以500个/孔接种于含0.8%甲基纤维素的低粘附24孔板,进行半固体无血清悬浮培养,7~10 d后显微镜下计成球数。
1.6 Transwell侵袭实验检测MHCC97L细胞中ESA+和CD90+细胞侵袭能力
将流式分选获得的ESA+、ESA-、CD90+、CD90-细胞及亲本细胞制备无血清单细胞悬液,以1×104个细胞/孔接种于Transwell小室上室中,下室加入含10%胎牛血清的完全培养基0.5 mL。置Transwell小室于37 ℃,5%CO2孵箱,饱和湿度培养16 h,取下底膜,洗去未穿透细胞并用DAPI染色、封片,在荧光显微镜下检测穿膜细胞并计数。每个培养孔随机选择3个视野拍照(200×),每组细胞设一个平行小室,Image-Pro Plus计算每个视野的细胞数,取平均值计数。
1.7 CCK-8法检测MHCC97L细胞中ESA+和CD90+细胞顺铂耐药性
将流式分选获得的ESA+、CD90+细胞制备单细胞悬液以3000个/孔接种于96孔板,37 ℃,5%CO2孵箱,饱和湿度培养24 h后更换含0 μg/mL、0.125 μg/mL、0.25 μg/mL、0.5 μg/mL、1 μg/mL和2 μg/mL不同浓度顺铂的培养基,37 ℃、5%CO2孵箱,饱和湿度培养,3 d换液,7 d后按照CCK-8试剂盒说明书加入CCK-8试剂,测定OD450值,用IC50软件计算各组IC50值。
1.8 CCK-8法检测MHCC97L细胞中ESA+和CD90+细胞增殖能力
将流式分选获得的ESA+、CD90+细胞制备单细胞悬液以3000个/孔接种于96孔板,于37 ℃、5%CO2孵箱,饱和湿度培养,分别于24、48、72、96、120 h后按照CCK-8试剂盒说明书加入CCK-8试剂,测定OD450值,绘制增殖曲线。
1.9 统计学方法
2 结 果
2.1 ESA+和CD90+细胞在MHCC97L肝癌细胞系中的表达
活细胞流式免疫荧光术检测MHCC97L细胞系中CD90+、ESA+亚群细胞表达比例分别为2.37%,3.70%(图1)。

图1 MHCC97L细胞系中CD90+,ESA+细胞亚群表达Fig 1 Expression of CD90+,ESA+ in MHCC97L
2.2 ESA+和CD90+细胞自我更新能力检测
亲本MHCC97L细胞甲基纤维素成球率为(16.4±0.8)%,活细胞流式分选获得ESA+、ESA-、CD90+、CD90-细胞成球率分别为(35.6±2.4)%、(9.6±1.4)%、(29.2±1.3)%及(7.4±0.6)%。
ESA+细胞成球率明显高于CD90+细胞(P<0.05)、ESA-及亲本细胞(P<0.01),CD90+细胞间成球率明显高于CD90-细胞(P<0.01), 亲本细胞成球率则明显高于ESA-、CD90-细胞(P<0.01),但两组阴性细胞ESA-、CD90-细胞间成球率无显著性差异(P>0.05);ESA+细胞成球体积明显大于其他组细胞(图2,图3)。

A:ESA+; B:CD90+ ; C:MHCC97L; D:ESA- ; E:CD90-图2 不同亚群细胞成球体积比较(×200)Fig 2 Volume of different sub-population cells(×200)

*** P<0.01;# P<0.05图3 ESA+、CD90+、ESA-、CD90-细胞及亲本细胞自我更新能力比较Fig 3 Self-renewal ability of ESA+, CD90+, ESA- , CD90-and parent cells
2.3 ESA+和CD90+细胞侵袭能力检测
Transwell侵袭结果显示(图4),亲本MHCC97L细胞、ESA+、ESA-、CD90+及CD90-侵袭细胞数为(185±14.2) 、(282±15.1)、(133±12.4) 、(231±11.8)及(113±10.2)个。ESA+细胞侵袭能力是ESA-细胞的2.12倍(P<0.01)。CD90+细胞侵袭能力是CD90-细胞的2.04倍(P<0.01),并且ESA+细胞侵袭能力明显强于CD90+细胞(P<0.05),而亲本细胞侵袭细胞数明显高于ESA-、CD90-细胞(P<0.01),但两组阴性细胞ESA-、CD90-细胞侵袭细胞数无明显差异(P>0.05),见图5。
2.4 ESA+细胞和CD90+细胞顺铂耐药性检测

A:ESA+; B:CD90+; C:MHCC97L; D: ESA-; E:CD90-图4 不同亚群细胞侵袭能力比较(×200)Fig 4 Invasion ability of different sub-population cells(×200)
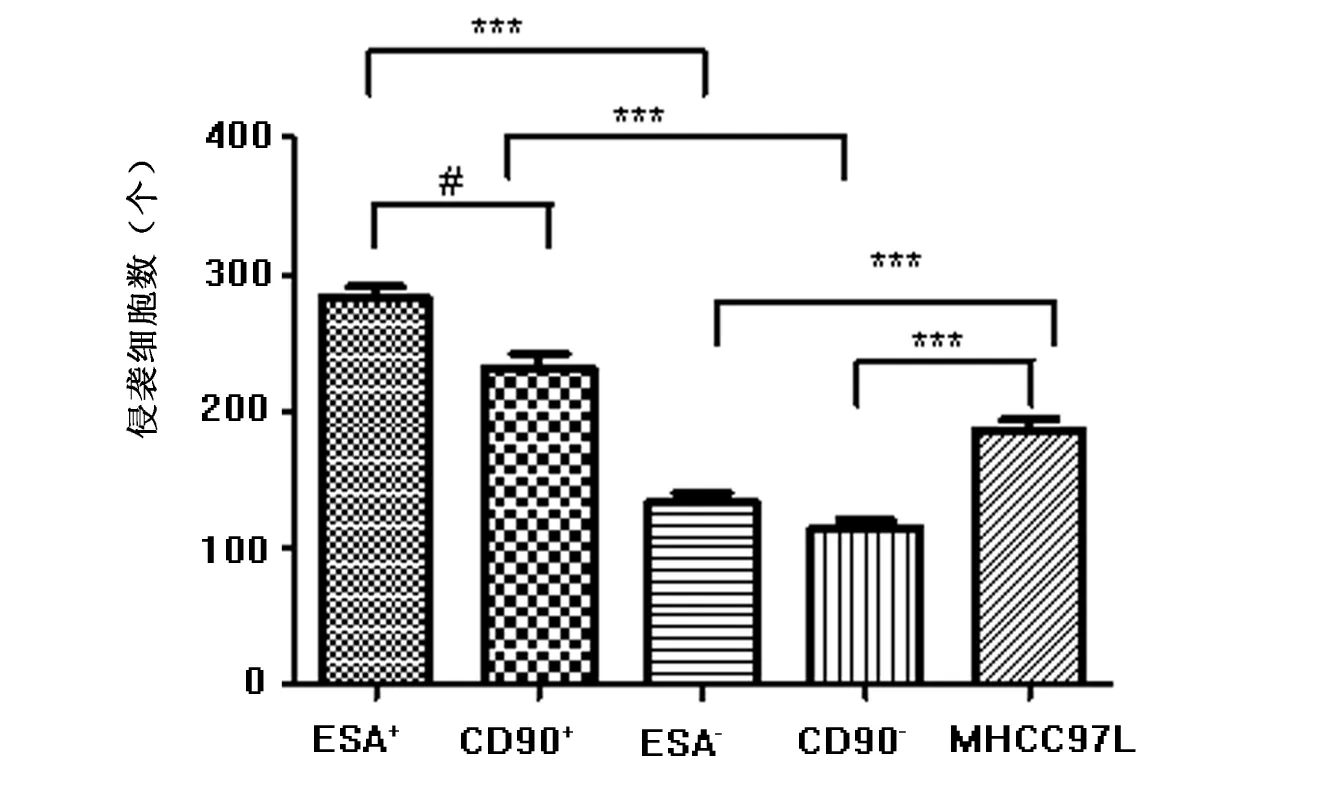
*** P<0.01;# P<0.05图5 ESA+、ESA-、CD90+、CD90-细胞及亲本细胞侵袭数比较Fig 5 Invasion ability of ESA+, CD90+, ESA- , CD90-and parent cells
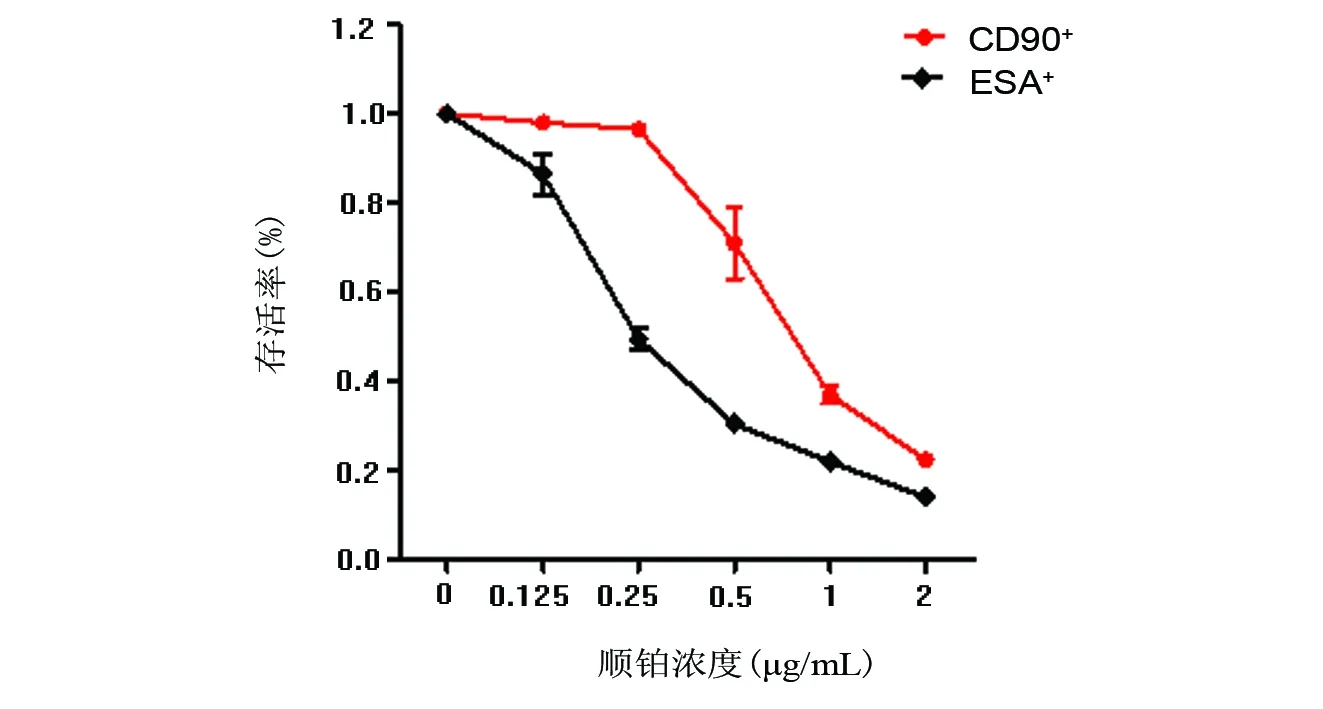
图6 ESA+和CD90+细胞顺铂耐药Fig 6 Drug-resistance capacity of ESA+ and CD90+ cell
CD90+细胞的顺铂耐药实验IC50值为0.98 μg/mL,ESA+细胞IC50值为0.36 μg/mL(图6),明显低于CD90+细胞。
2.5 ESA+细胞和CD90+细胞增殖能力检测
CCK-8结果显示培养24 h后ESA+细胞增殖速度逐渐快于CD90+细胞,至120 h后ESA+细胞增殖速度明显快于CD90+细胞(图7)。
3 讨 论
2003年Al-Hajj等[9]首次从实体瘤乳腺癌细胞中分离并鉴定出具有干细胞类似生物学特性的细胞群体,从而在实体瘤中证明了CSCs/TICs的存在。进一步研究发现CSCs表达不同的标志物[10]。同一标志物也可以出现在不同肿瘤细胞中且表达比例有所不同,而同一肿瘤细胞又可表达多个CSCs标志物。如CD90既是肝癌干细胞标志物[11-12],也是胃癌干细胞标志物[13],而在肝癌细胞中有CD90、ESA、CD133等多种不同CSCs标志物表达[14]。目前研究证实同一肿瘤在不同病人之间表现出不同生物学性状,推测可能与不同肿瘤干细胞标志物的表达相关。同时,同一肿瘤的不同细胞系也表现出不同生物学性状,考虑也与不同干细胞标志物的表达相关。本研究以人肝癌细胞系MHCC97L为研究对象,活细胞流式免疫荧光术检测发现肝癌细胞中ESA、CD90亚群细胞均有表达,但表达比例有所区别(3.70% vs. 2.37%),前者高于后者。进而分选两个亚群的细胞进行生物学功能研究发现ESA+亚群细胞的自我更新能力、侵袭能力及增殖能力显著强于CD90+亚群细胞。该细胞系中ESA表达多于CD90,而ESA+细胞又表现出了很强的侵袭能力及自我更新能力,因此使得MHCC97L细胞系表现出强侵袭、转移特性及体内成瘤能力,与相关文献报道一致[15],提示MHCC97L细胞系的生物学特性与其干细胞亚群组成与分布具有相关性。试验结果还显示CD90+细胞具有强于ESA+细胞的顺铂耐药能力,但由于MHCC97L细胞系中表达比例低于ESA+细胞,使得该细胞系顺铂耐药能力弱于高表达CD90的细胞系。

图7 ESA+和CD90+细胞增殖能力Fig 7 Proliferation of ESA+ and CD90+ cells
CD90又称THY-1,是一种表达于细胞表面的糖蛋白分子,属于免疫球蛋白超家族,与细胞增殖、坏死、凋亡等相关[16]。有研究认为其能够促进肿瘤细胞生长,抑制CD90的表达可以抑制肿瘤细胞的增殖、分化及克隆形成能力,因此可作为新的靶向肿瘤干细胞的靶点[17],但也有不同观点认为,CD90的表达反而可以抑制卵巢癌细胞的增殖[18],本研究中CD90+细胞增殖能力明显强于CD90-细胞,提示在不同肿瘤细胞中CD90发挥着不同的效应,可能参与了肿瘤异质性的形成。研究显示CD90+细胞高表达Oct4和ABCG2,这可能是本研究中CD90+细胞较ESA+细胞具有更强顺铂耐药性的原因,提示CD90高表达细胞可能具有更强的耐药性,并参与肿瘤耐药的形成,与肿瘤复发密切相关[19]。ESA属黏附分子家族,是一种钙非依赖性的上皮细胞间黏附分子,在上皮癌变过程中发挥着重要作用,具有调节细胞迁移、增殖、分化功能[20],是公认的肝癌干细胞标志物[14,21]。裸鼠体内致瘤实验发现ESA+肝癌细胞成瘤能力明显强于ESA-肝癌细胞,并且ESA+肝癌细胞能够在软琼脂中形成非粘附性的克隆结构[22],具有明显强于ESA-细胞的侵袭性,与研究中ESA+细胞表现出的强侵袭、增殖能力能相一致。综上所述,肝癌细胞系MHCC97L中ESA+细胞与CD90+细胞表达比例不同,二者表现出了不同的生物学特性,提示肿瘤细胞中不同干细胞标志物的表达可能会影响到肿瘤的转移、耐药、复发等,具有一定的临床指导意义。
