响应面法优化微波辅助提取诺丽果多酚工艺研究
2018-10-31方瑞娜赵心瑗贾小菊
方瑞娜,赵心瑗,贾小菊
(1.黄河水利职业技术学院环境工程学院,河南开封475004;2.开封市绿色涂层材料重点实验室,河南开封475004)
诺丽,生活在南太平洋岛屿,有极高医药价值,常用于饮品和制药[1-2]。多酚提取方法有很多,目前比较常见的有:超临界流体萃取、超声波辅助提取和微波辅助提取等[3-5]。其中超临界流体萃取对设备要求高,一次性投资较大[6-7];超声波辅助提取效率高,但对多酚提取纯度不高[8];微波辅助提取技术具有操作简单、溶剂消耗量少、有效成分不易流失等优点,被广泛应用在生物活性成分的提取中[9-10]。目前,微波辅助提取诺丽果多酚工艺的研究寥寥无几[11-13]。本试验利用微波辅助法探讨了诺丽果多酚的提取工艺,在单因素基础上使用响应曲面进行优化,并提供一定的理论基础和工艺参考为诺丽果多酚的开发利用。
1 材料与方法
1.1 材料
1.1.1 样品与试剂
诺丽果:海口;没食子酸标准品(≥98%):中国药品生物制品鉴定所;无水C2H5OH(分析纯):烟台淞郁股份有限公司;Na2CO3(分析纯):天津市北辰方正试剂厂;1,1-二基-2-苦基肼自由基(DPPH)(分析纯):南京奥多福尼生物科技;2,2-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS)(分析纯):合肥巴斯夫生物科技有限公司。
1.1.2 样品预处理
取新鲜诺丽果,切块并洗净后110℃干燥、粉碎过200目筛,装入棕色瓶中备用。
1.1.3 仪器与设备
UV-1200型紫外可见分光光度计:上海美普达仪器有限公司;XO-SM100型超声微波组合反应系统:南京先欧仪器制造有限公司。
1.2 方法
1.2.1 提取
诺丽果处理后,加入相应的乙醇浓度,搅拌并静置15 min,在不同功率下,选择不同的提取时间,制得待测样品液。平行3次试验,取算术平均值。
1.2.2 没食子酸标准曲线及多酚含量的测定
以没食子酸为标准品,参照李莉[14]的方法进行多酚的测定。配制成0.50 mg/mL浓度的标准液,吸量管移取 0.10、0.20、0.30、0.40、0.50 mL 上述溶液置于容量瓶中,依次加入1.50 mL Folin-Cioealteu试剂、2.00 mL 20%Na2CO3,定容、摇匀、并加热显色 30 min,于 760 nm测吸光度。将提取液稀释后依次测定,利用标准曲线计算诺丽果多酚含量。
1.2.3 单因素试验
取1.000 0 g的诺丽果粉,选取不同的C2H5OH浓度以相应的液料配比,不同的提取时间和不同微波功率制得待测样品,进行测量。取各因素试验多次测定的平均值,具体各因素水平见表1。
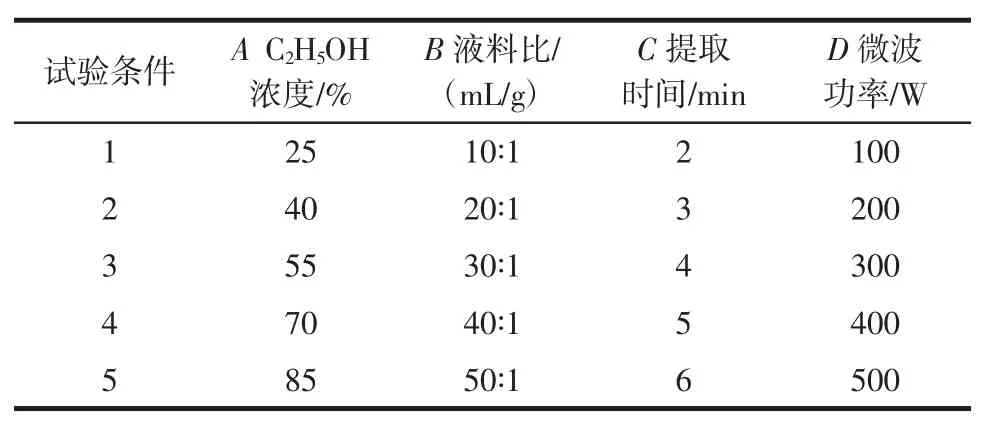
表1 不同提取条件对多酚提取量的影响Table 1 Effects of extraction conditions on the yield of TPC
1.2.4 诺丽果多酚抗氧化试验
根据DPPH自由基和ABTS+自由基的去除率研究诺丽果中多酚的抗氧化性。
1.2.4.1 DPPH自由基的去除
参照崔鹏等[15]方法,采用DPPH自由基测定其抗氧化能力。配制浓度是0.20 mg/mL DPPH溶液,放至冰箱避光保存备用。取不同浓度样品2.00 mL,加入已配置DPPH溶液,摇匀暗处反应30 min。以无水C2H5OH做参比,在517 nm处测吸光度。清除率公式为:
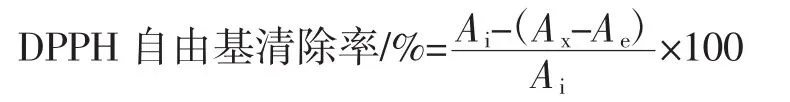
式中:Ai为DPPH溶液吸光度值;Ax为样品液和DPPH溶液吸光度值;Ae为不含DPPH溶液时样品液吸光度值。
1.2.4.2 ABTS+自由基的去除
参照韩光亮等[16]方法,以分光光度法测定ABTS+自由基去除率。取不同浓度样品液2.00 mL,与8.00 mL ABTS使用液混合,混匀,置于暗处30 min,以蒸馏水作参比,于517 nm波长测定吸光度。ABTS+自由基清除率公式为:
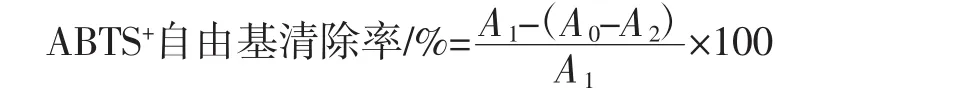
式中:A1为ABTS+自由基溶液吸光度值;A0为样品液和ABTS+自由基溶液吸光度值;A2为不含ABTS+自由基溶液时样品液吸光度值。
1.2.5 CCD响应面法优化
根据单因素试验结果,参照孟蕲翾等[17-18]的方法,采用CCD法设计四因素五水平试验,选取C2H5OH浓度A、液料比B、提取时间C、微波功率D等4个因素优化提取工艺,试验平行3次,取平均值,因素水平见表2。
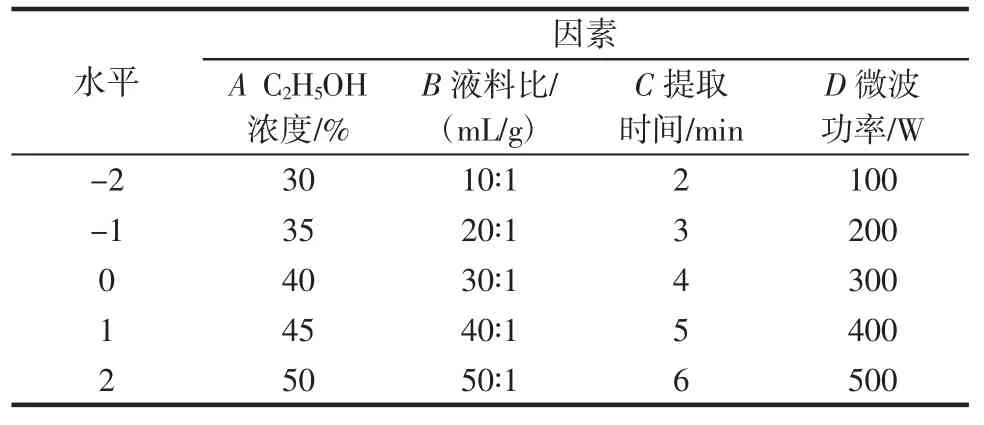
表2 因素水平编码表Table 2 Actors and levels of CCD test
1.3 数据处理
试验数据采用origin75软件进行处理并制图分析单因素试验结果,运用Design Expert 8.0.6软件进行响应面结果分析和图形输出。
2 结果与分析
2.1 标准曲线
试验获得没食子酸标准系列方程:Y=0.118 5X+0.042 3,R2=0.999 1,没食子酸标准曲线如图1所示。
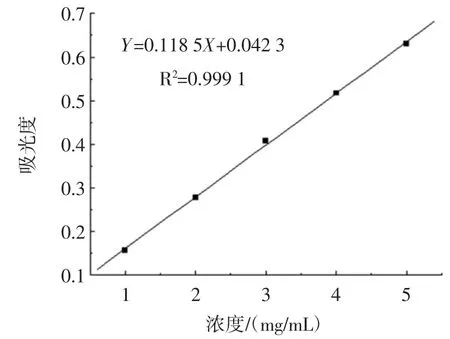
图1 没食子酸标准曲线Fig.1 The standard curve of gallic acid
2.2 单因素试验结果
2.2.1 C2H5OH浓度对多酚提取率的影响C2H5OH浓度曲线如图2所示。
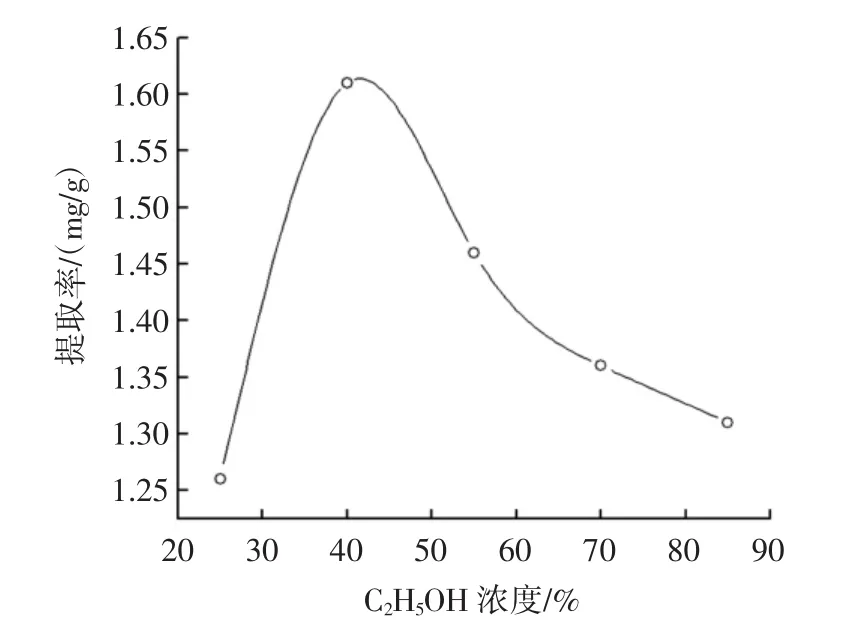
图2 C2H5OH浓度对诺丽果多酚提取率的影响Fig.2 Effect of concentration of ethanol on the extraction rate of polyphone from Noni
随着C2H5OH浓度增大,多酚的提取率上升,当C2H5OH浓度为40%时,提取率最大而后呈现下降的趋势。这可能是由于乙醇极性比水小,极性小的物质乙醇浓度越高越易溶解,因此影响提取率。故确定选择C2H5OH浓度为40%。
2.2.2 液料比对多酚提取率的影响
液料比的曲线如图3所示。
当液料比增大时,多酚提取率随之增高,当液料比达到30∶1(mL/g)时提取率最大而后呈持续稳定趋势。因此,选择液料比为30∶1(mL/g)以节约成本和浓缩工艺。
2.2.3 提取时间对多酚提取率的影响
提取时间的曲线如图4所示。
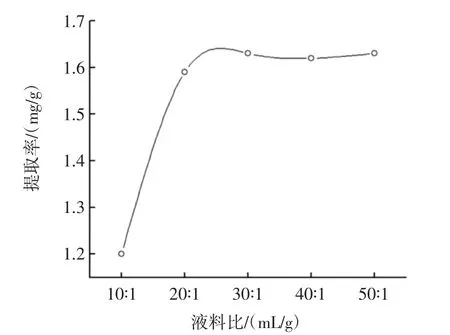
图3 液料比对诺丽果多酚提取率的影响Fig.3 Effect of ratio of liquid to material on the extraction rate of polyphone from Noni
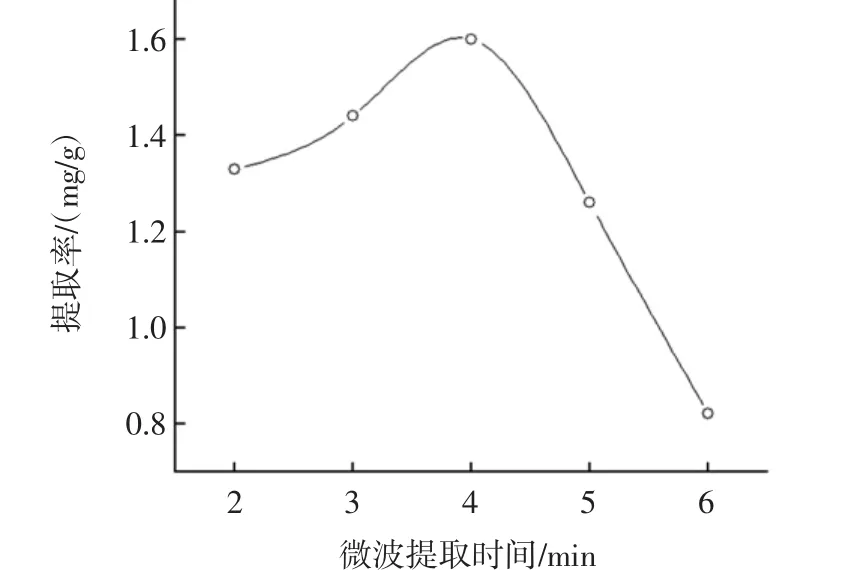
图4 微波辅助提取时间对诺丽果多酚提取率的影响Fig.4 Effect of extraction time on the extraction rate of polyphone from Noni
多酚的提取率提取时间的增加而升高,当提取时间达到4 min时,提取率最大而后呈现下降趋势。这可能是随时间的增加,多酚溶解更充分,在4 min后,多酚可能会被分解,从而影响提取率。故确定提取时间4 min。
2.2.4 微波功率对多酚提取率的影响
微波功率的曲线如图5所示。
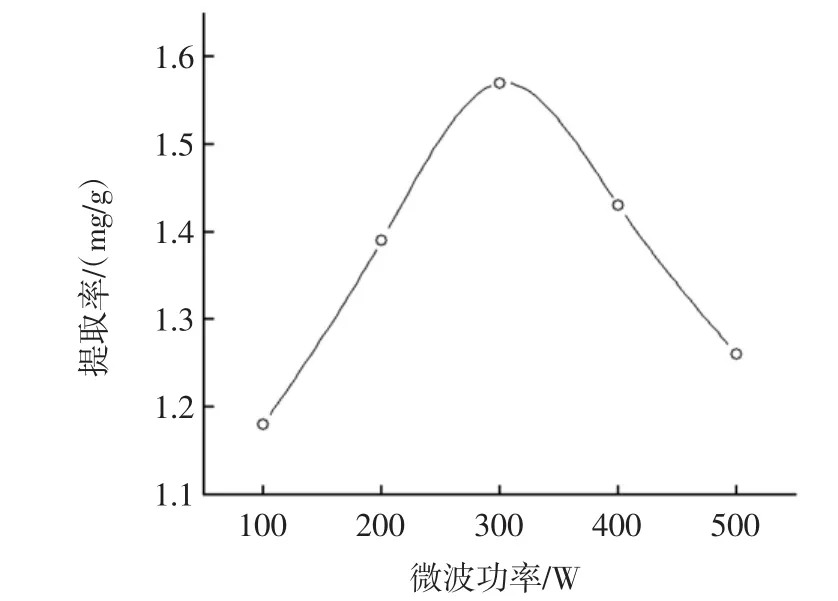
图5 微波辅助微波功率对诺丽果多酚提取率的影响Fig.5 Effect of microwave power on the extraction rate of polyphone from Noni
随着微波功率的增加,多酚的提取率升高,当微波功率达到300 W时提取率最大而后呈现下降趋势。这可能是随着时间增加,微波辐射产生大量的热量,致使多酚物质被氧化。故确定提取时间300 W。
2.3 响应面法优化工艺条件
2.3.1 响应面试验设计及结果
根据响应面设计原理和表2因素编码表,响应值为诺丽果中多酚的提取率(Y),使用Design-Expert8.0.6软件对结果进行分析和图形输出。CCD设计和分析结果如表3所示。
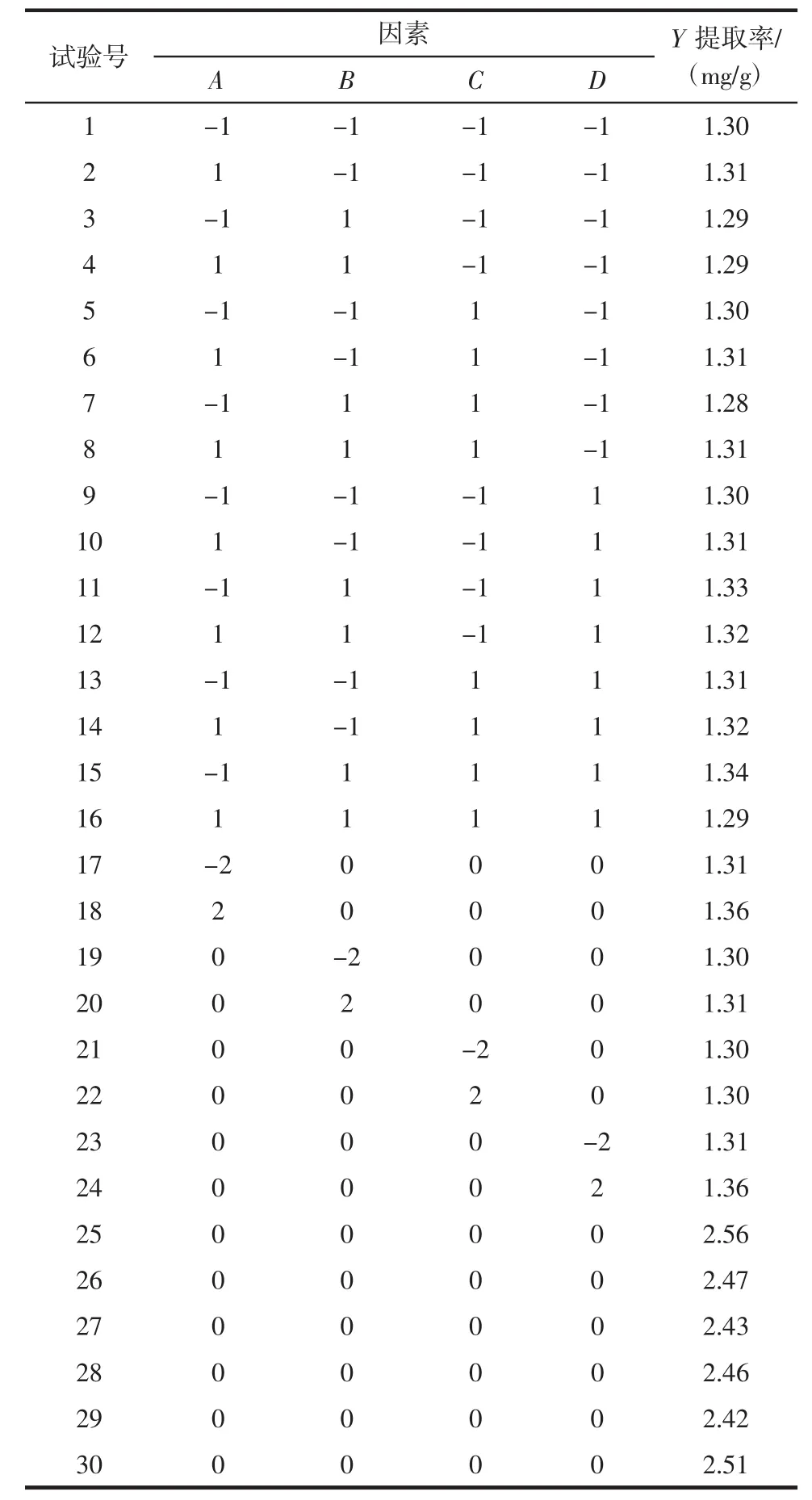
表3 响应面试验设计与结果Table 3 Design and result of CCD
2.3.2 模型的建立及方差分析
参照朱春丽[19-20]等的方法,用Design-Expert8.0.6软件将模型进行分析,得到诺丽果中多酚提取率以及所选4个因素编码值的回归方程为:
Y=2.14+5.74×A+1.35×B-6.41×C+7.34×D-3.49×A×B+1.46×A×C-2.56×A×D-4.33×B×C+4.35×B×D-1.00×C×D-0.20×A2-0.21×B2-0.21×C2-0.20×D2对其检验及方差分析,具体结果如表4所示。
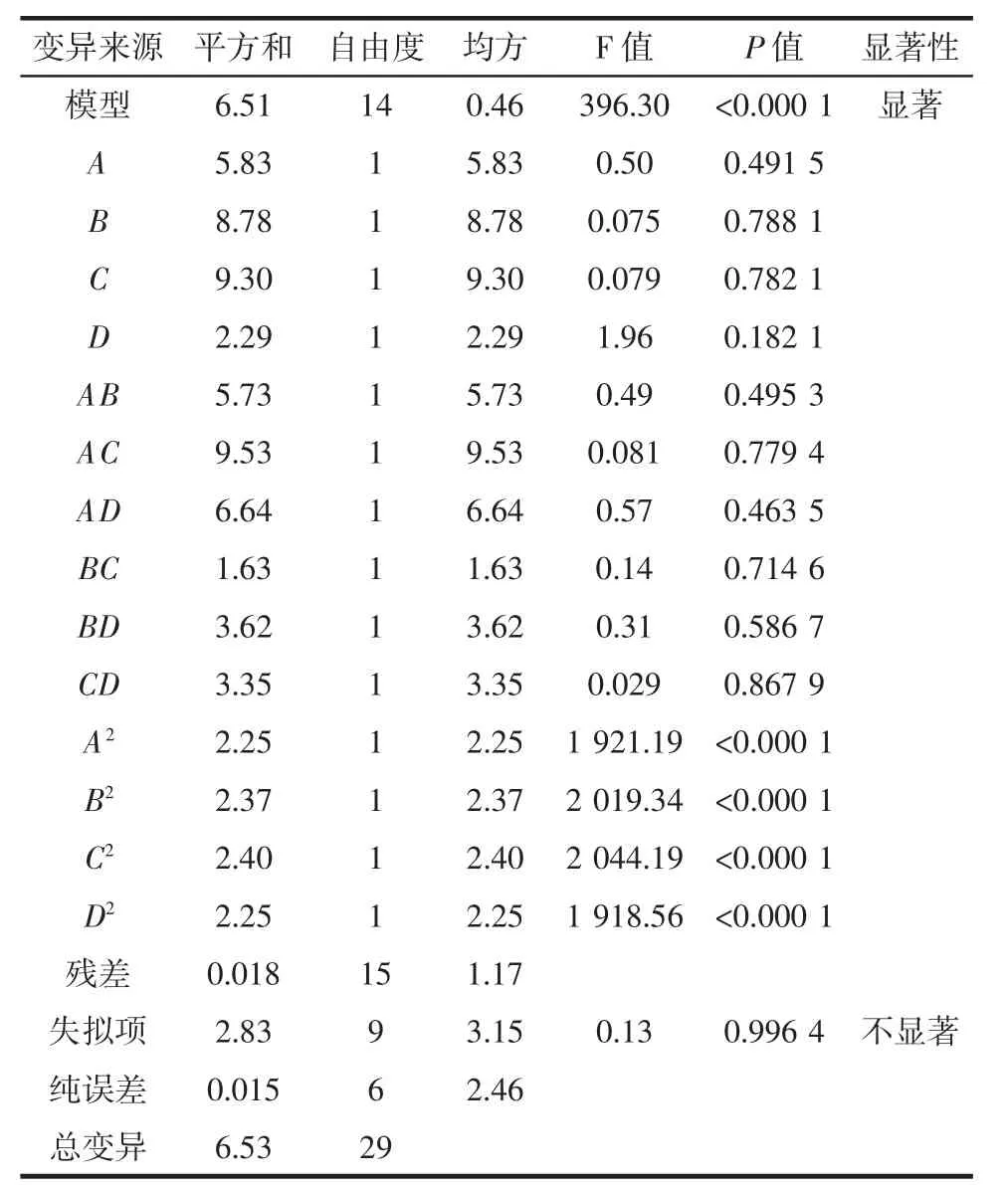
表4 多元回归模型方差分析Table 4 Analysis of variance for the response surface quadratic model
由回归方程分析可知,以多酚含量建立的模型为显著。其中模型的决定系数R2=0.997 3,模型的变异系数CV=2.22%,失拟项F=396.30,说明相对于纯误差失拟不显著。综合显示该模型是可以用来分析和预测诺丽果中的多酚的提取量。根据F值的大小,推测本试验几个影响因素的重要性为:微波功率(D)>C2H5OH浓度(A)>提取时间(C)>液料比(B)。经响应曲面法分析,最佳提取条件为C2H5OH浓度为40.05%,液料比30.03∶1(mL/g),提取时间为4.00 min,微波功率为301.78 W,此时诺丽果多酚提取量应为2.47 mg/g。
2.3.3 响应面分析
用Design-Expert8.0.6软件绘制以多酚提取率为响应值的各因子交互作用的响应面图。具体如图6~图11所示。
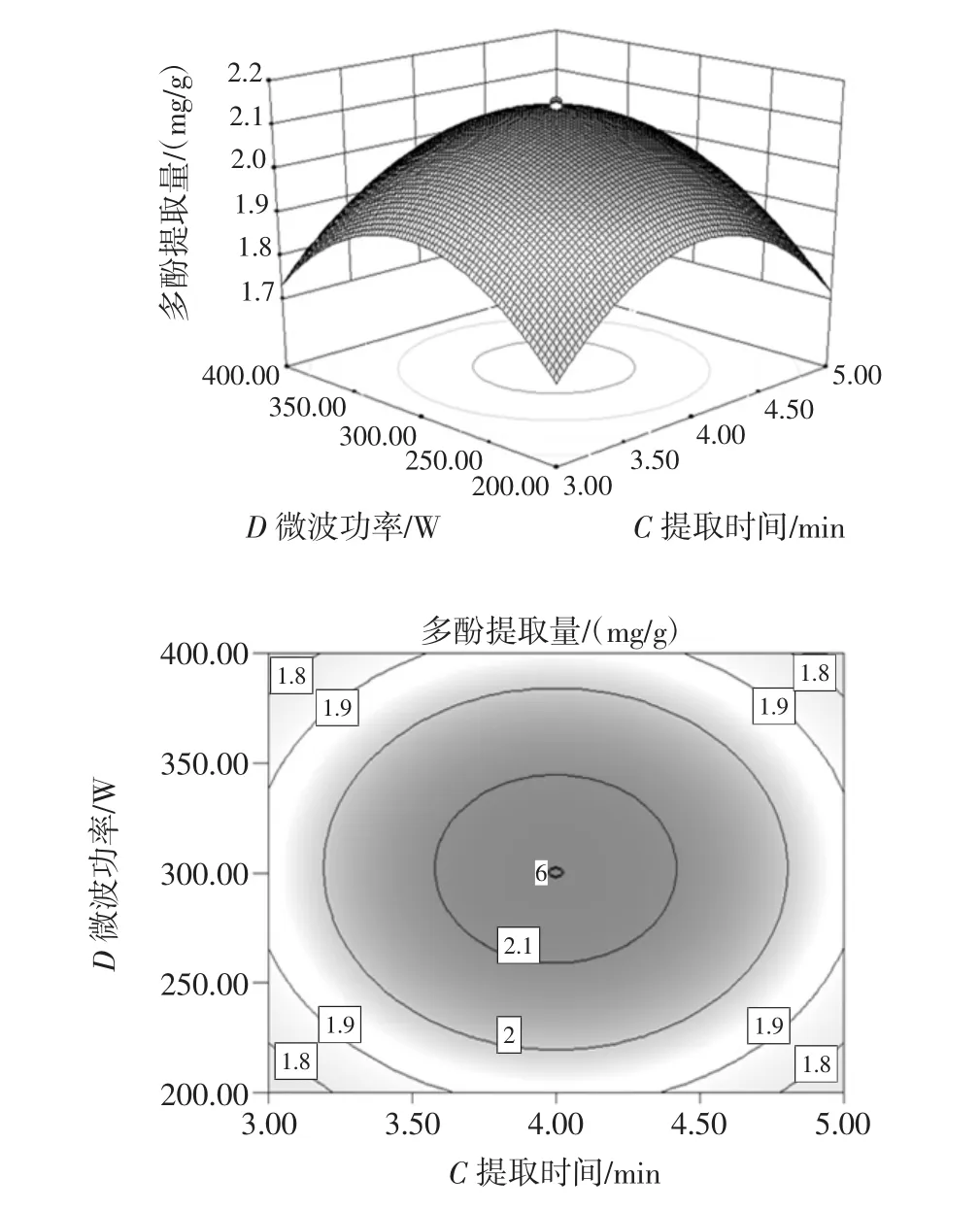
图6 提取时间与微波功率的等高线图和响应曲面图Fig.6 The response surface and contour figure about extraction time and microwave power
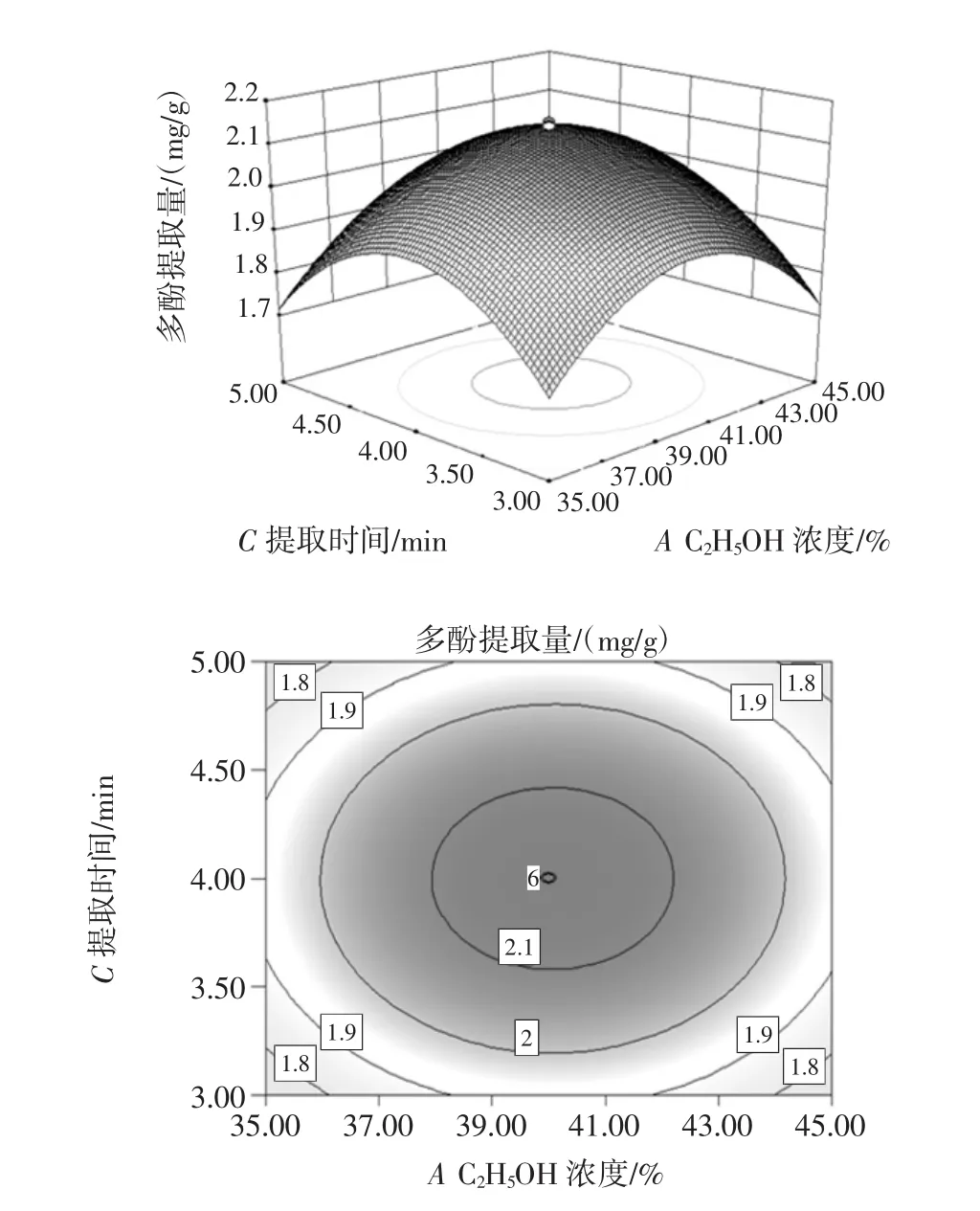
图7 C2H5OH浓度与提取时间的等高线和响应曲面Fig.7 The response surface and contour figure about ethanol concentration and extraction time
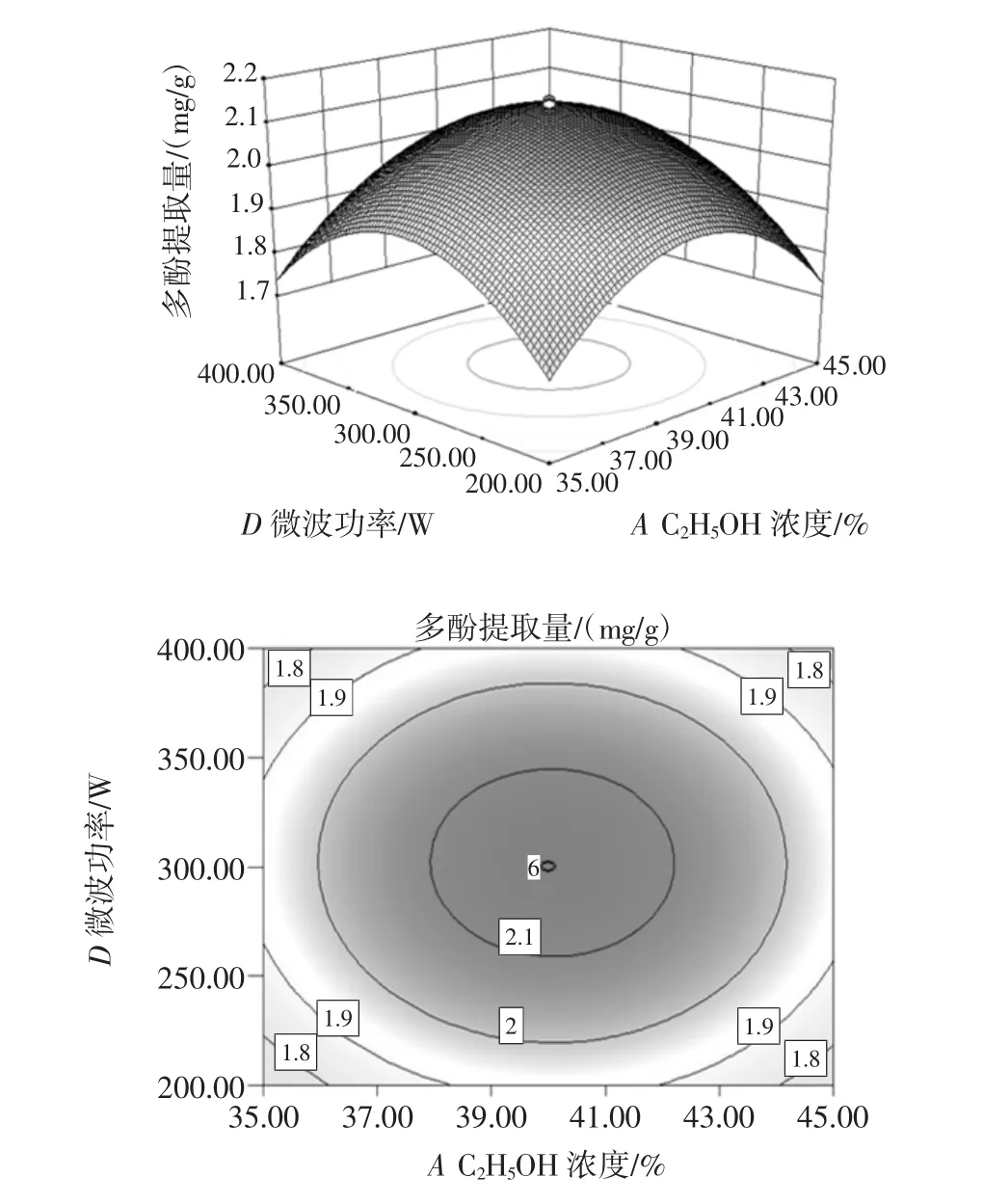
图8 C2H5OH浓度与微波功率的等高线和响应曲面Fig.8 The response surface and contour figure about ethanol concentration and microwave power
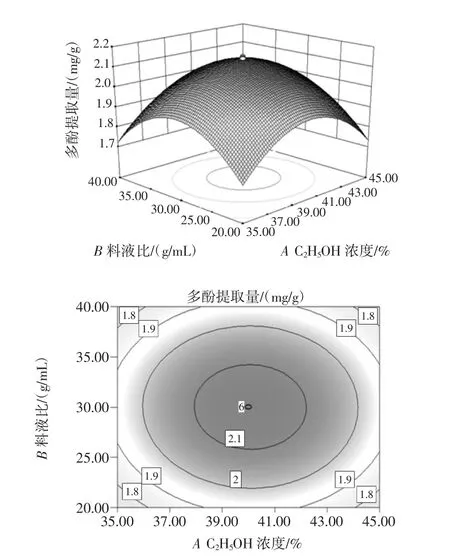
图9 C2H5OH浓度与液料比的等高线和响应曲面Fig.9 The response surface and contour figure about ethanol concentrate and liquid-to-solid ratio
从图6~图9中通过观察等高线的稀疏度和响应曲面的斜率可知,多酚提取率随着提取时间的增大微波功率先升高后减小,C2H5OH浓度也大致相同,随着乙醇浓度的增大提取时间先升高后减小,微波功率也有相同的趋势;等高线呈椭圆形说明提取时间与微波功率、C2H5OH浓度与提取时间、C2H5OH浓度与微波功率、C2H5OH浓度与液料比对多酚提取率的交互作用显著。由图10可以看出,固定C2H5OH浓度和提取时间,随着液料比增大提取率也增大,提取率也随微波功率的增加呈先上升后下降趋势,表明微波功率和液料比对试验影响较大,等高线呈椭圆形,表明二者的交互作用较显著,因此曲线较陡峭。由图11可以看出,固定C2H5OH浓度和微波功率,多酚提取量的平均值为2.45 mg/g与理论预测值接近,说明该模型所得的优化条件参数准确可靠具有实用价值。
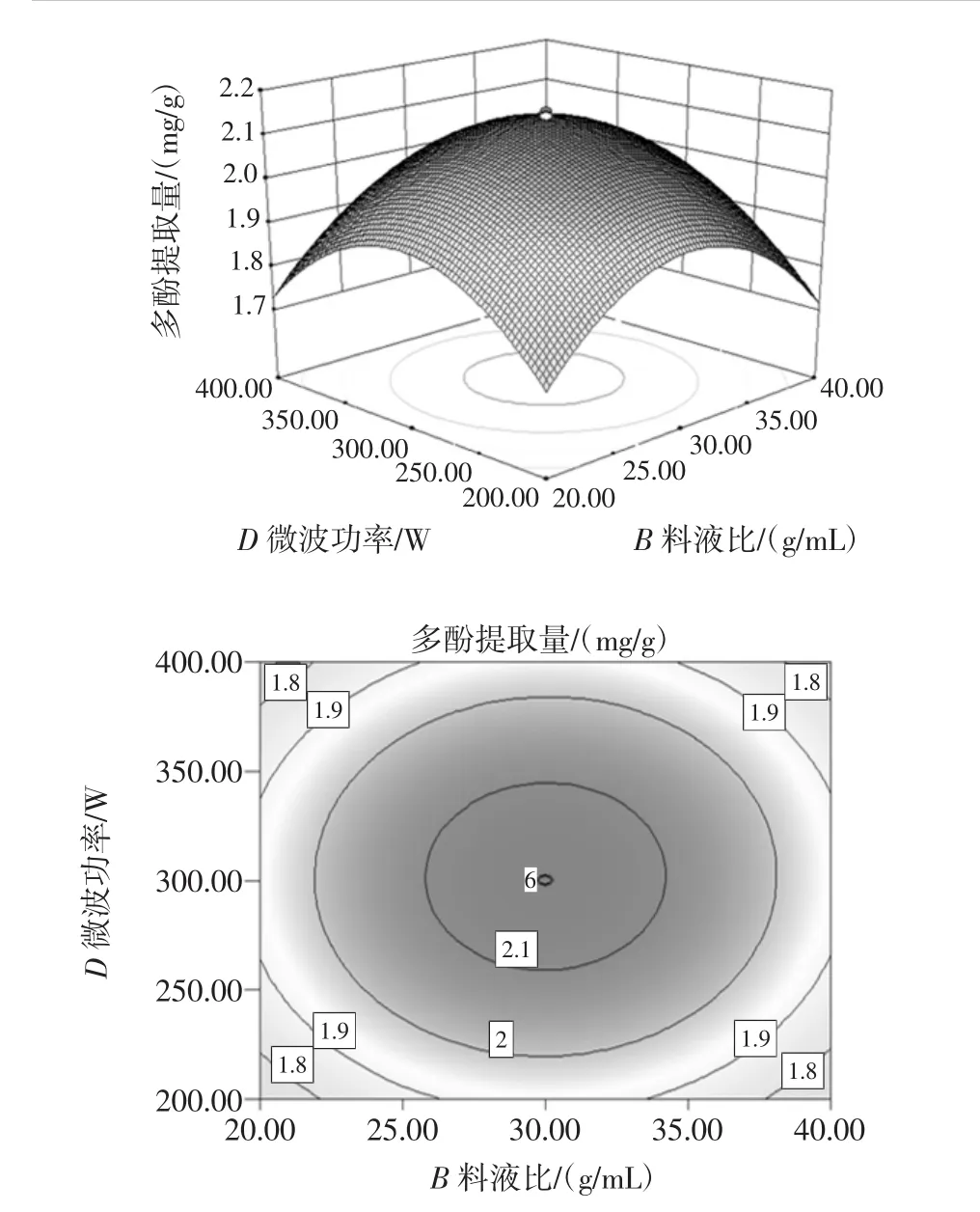
图10 液料比与微波功率的等高线和响应曲面Fig.10 The response surface and contour figure about liquid-tosolid and microwave power
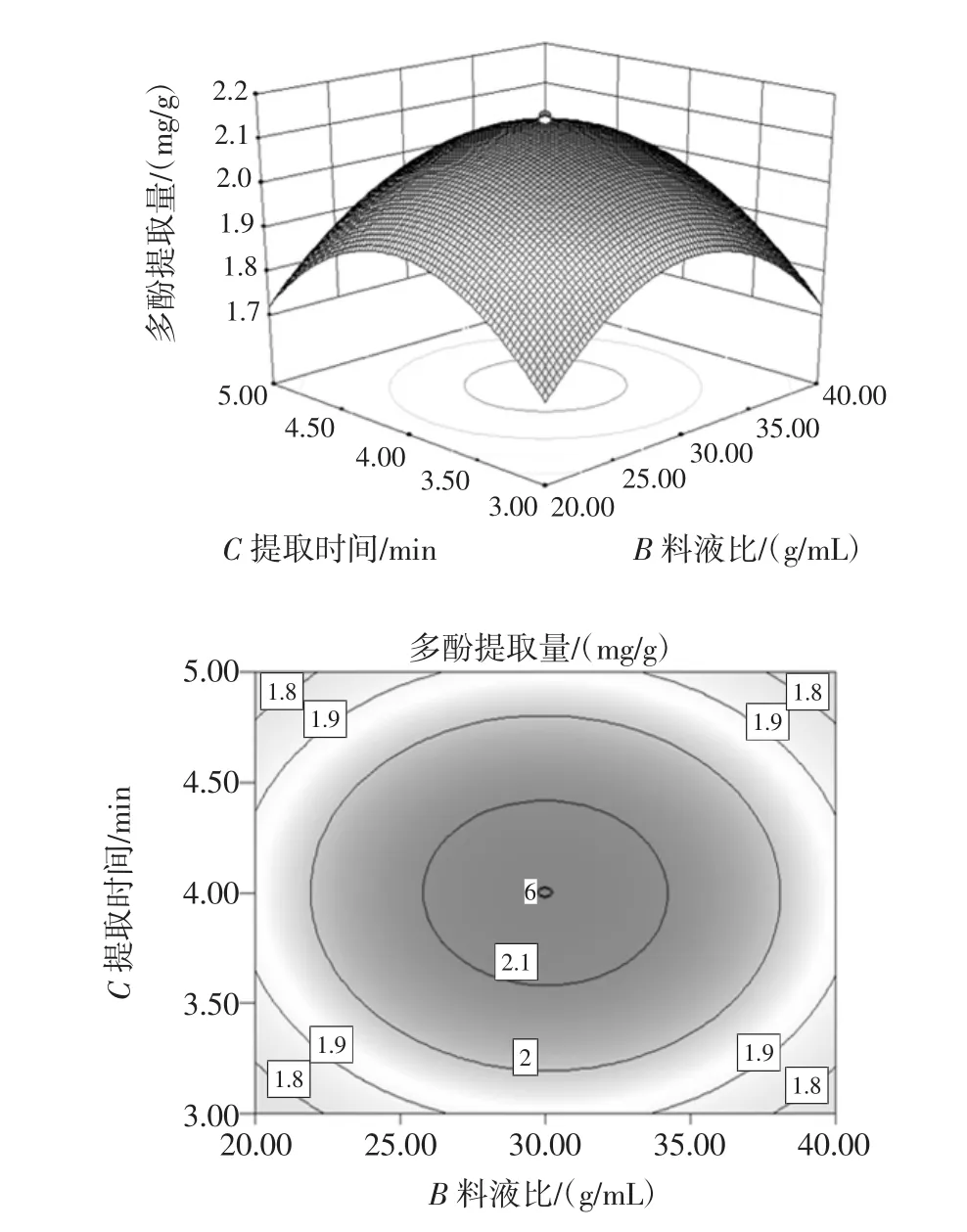
图11 液料比与提取时间的等高线和响应曲面Fig.11 The response surface and contour figure about liquid-tosolid and extraction time
2.5 抗氧化能力测定结果分析
2.5.1 DPPH自由基清除能力
为考察提取产品的抗氧化性,做DPPH验证试验,发现采用此CCD模型提取诺丽果多酚提取液在6.00 mg/mL时,清除率达到58.62%,说明诺丽果多酚提取液抗氧化能力较好。
2.5.2 ABTS+自由基清除能力
为考察诺丽果中多酚对ABTS+自由基清除能力,随着样液浓度的增加,自由基的清除能力逐渐增强,当浓度为4.00 mg/mL时,清除能力最高,对ABTS+自由基的清除率达到51.46%,因此诺丽果多酚提取液抗氧化能力较好。
3 结论
采用微波法提取诺丽果中多酚,最优试验条件如下:C2H5OH 浓度 40%、液料比 30∶1(mL/g)、提取时间4 min,微波功率300 W优化提取条件后多酚平均提取率为2.45 mg/g,与预测值接近说明所得模型可以用于诺丽果多酚提取工艺的优化。进行抗氧化性的试验得出,诺丽果多酚提取液对DPPH自由基清除率达58.62%,ABTS+自由基的清除率达到51.46%。证明诺丽果多酚成分有较强的抗氧化能力,可以延缓衰老、去除内脏脂肪意义重大。微波辅助提取工艺应用于诺丽果中多酚的提取效果较好,此方法可为诺丽的进一步开发提供有效参考。
