桂花黄酮类化合物体内外抗氧化活性的研究
2018-10-31包骐林王丹陆葵青申雨燕周明明李云
包骐林,王丹,陆葵青,申雨燕,周明明,李云,*
(1.四川大学华西公共卫生学院,四川成都610041;2.郑州市中心医院,河南郑州450000)
桂花(Osmantus fragrans)是木犀科木犀属小乔木,是我国特产的珍贵芳香观赏花卉,其花气味清香有很好的食用以及药用价值[1]。四川地区是我国桂花的原产地之一,长期以来将桂花作为观赏树种用于园林绿化[2]。本次研究所使用的桂花为常见品种——日香桂,采摘自四川江油万亩桂花产业园。该产业园桂花资源丰富,但对其的加工利用除传统的晒制,泡制以外,在其它深加工方面有限。而桂花中含有黄酮、多糖、脂肪酸、酚类等多种生物活性成分[3-5]。其中黄酮化合物含量丰富[6-7],根据多种研究表明,黄酮具有抗氧化、抗肿瘤、降血脂、治疗心血管疾病等多种生理活性作用[8-11]。目前对桂花中黄酮类化合物的研究大部分集中于提取、含量测定等方面,对其体内外抗氧化活性的研究有限。本次研究以桂花黄酮清除自由基和对铁离子的还原能力为指标评价其体外抗氧化活性水平,以建立D-半乳糖致亚急性衰老小鼠模型为研究对象,探究桂花黄酮类化合物在机体内的抗氧化能力,为进一步开发利用四川江油万亩桂花产业园中桂花资源以及为当地经济产业的发展拓展新方向。
1 材料与方法
1.1 材料与仪器
桂花:品种为日香桂,采摘于江油市万亩桂花产业园。
亚硝酸钠、过硫酸钾:成都市科龙化工试剂厂;硝酸铝:天津致远化学试剂有限公司;芦丁:北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、D-半乳糖:美国Sigma公司;总超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、考马斯亮蓝蛋白测定试剂盒:南京建成生物工程研究所;其它化学试剂均为国产分析纯。
SPF级雄性昆明种小鼠50只,体重25g~30 g,8周龄,购自成都达硕生物科技有限公司,动物合格证:SCXK(川)2014-028。
HSY-SP电热恒温水浴箱:北京市永光明医疗器械厂;GZD-D400-BS-Ⅱ电热恒温干燥器:上海越近医疗器械厂;Multiskan GO自动酶标读数仪:美国Thermo Fisher科技有限公司;Thermo ST16低温高速离心机:美国Thermo Fisher科技有限公司;ICC50HD显微镜:德国Leica Microsystems有限公司;HHSYZL-Ni电热恒温水浴箱:北京长风仪器公司。
1.2 方法
1.2.1 桂花黄酮的提取
新鲜桂花用烘箱烘干,粉碎,于干燥器中常温保存。采用乙醇回流法提取桂花中的黄酮类化合物,称取一定质量的桂花干粉,按照料液比140(g/mL)加入60%的乙醇,回流提取3 h,提取温度为70℃,过滤得滤渣后重复提取滤渣一次,合并滤液得到桂花黄酮提取液,于70℃在旋转蒸发仪中回流乙醇并浓缩,得到桂花黄酮溶液。
1.2.2 桂花中黄酮化合物含量的测定
准确称取芦丁标准品20 mg,用30%乙醇溶解,将芦丁标准品配制成浓度为0.1 mg/mL的标准溶液备用。取芦丁标准液 0、1、2、3、4、5 mL 分别移入 10 mL 容量瓶中,各加入0.4 mL的5%NaNO2溶液,摇匀,静置6 min后加入10%Al(NO3)3溶液0.4 mL,混匀,放置6 min;最后加入4%NaOH溶液4 mL,混匀,用30%乙醇稀释至刻度,摇匀,室温放置10 min后在波长510 nm处测定吸光度,空白参比溶液为30%乙醇溶液。横坐标(X)为芦丁标准溶液的浓度C,纵坐标(Y)为吸光度A,绘制标准曲线,并得到回归方程。取1 mL的桂花黄酮溶液置于10 mL容量瓶中,按照绘制标准工作曲线的方法,测定吸光度,按照回归方程计算出样品桂花溶液中总黄酮的含量。
1.2.3 清除DPPH自由基的能力的测定[12]
准确称取20 mgDPPH,用少量无水乙醇溶解后,移至250 mL容量瓶中用无水乙醇定容,配置成浓度为2×10-4mol/L 的溶液。移取 100 μL 浓度为 2×10-4mol/L的DPPH乙醇溶液于96孔板中,之后加入不同浓度的桂花黄酮溶液100 μL。混匀后在室温下避光反应30 min于517 nm处测定各孔吸光度,以同样浓度系列的抗坏血酸为阳性对照,以同样的方法测定吸光度值。按照以下公式计算DPPH·的清除率。
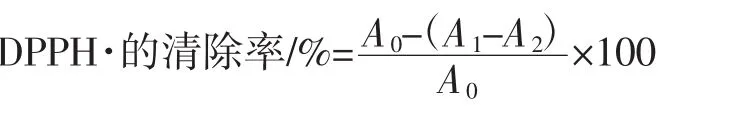
式中:A0为 100 μLDPPH 溶液+100 μL 无水乙醇的吸光度值;A1为100 μLDPPH 溶液+100 μL 桂花黄酮溶液的吸光度值;A2为100 μL桂花黄酮溶液+100 μL无水乙醇的吸光度值。
1.2.4 清除ABTS+自由基的能力的测定[13]
将7.4 mmol/L的ABTS与2.6 mmol/L的过硫酸钾溶液等体积混合,于室温下避光放置12 h~16 h制得ABTS+储备液。使用前用无水乙醇稀释,得在734 nm下测量吸光度在0.7±0.02之间的ABTS+工作液。以50%的乙醇为溶剂稀释样品,取2.4 mL ABTS+工作液与0.6 mL不同浓度样品,混匀,室温反应6 min后迅速测定734 nm处各管的吸光度值。以抗坏血酸为阳性对照。根据以下公式计算ABTS+·的清除率。

式中:A0为50%的无水乙醇为空白加入ABTS+工作液后测定的吸光度值;A1为不同浓度的待测样品与ABTS+工作液反应后的吸光度值。
1.2.5 还原能力的测定[14]
在试管中依次加入1 mL不同浓度的桂花黄酮溶液,再加入2.5 mL 1%铁氰化钾溶液和2.5 mL 0.2 mol/L的磷酸盐溶液(pH=6.6),混匀后于50℃恒温水浴20 min后急速冷却。加入2.5 mL 10%三氯乙酸溶液,混匀后在3 000 r/min离心10 min,取上清液5 mL,加入5 mL蒸馏水和1%氯化铁溶液后震荡混匀,静置10 min,于700 nm波长处测定各管吸光度值。根据吸光度值大小评价物质的还原能力,所测吸光度越大,还原能力越强。
1.2.6 桂花黄酮体内抗氧化作用研究
将50只小鼠适应性喂养7天后,按体重随机分为5组,分别为空白组、模型组、桂花黄酮高、中、低剂量组。除空白组以外,其余各组按照小鼠体重以500 mg/kg的剂量与颈背部皮下注射D-半乳糖,空白组小鼠注射等量生理盐水。造模同时,3个实验组经口灌胃分别给予不同剂量的桂花黄酮溶液,空白组和模型组给予等体积蒸馏水灌胃。剂量设计与分组如表1所示。

表1 动物实验剂量设计及分组Table 1 Dose design and grouping in animal exprements
按照上述的方法,连续培养6周后,小鼠禁食不禁水24 h,摘取眼球取血后立即颈椎脱臼处死,迅速剖出肝脏、肾脏、脾脏、脑组织称重并计算其脏器系数,计算公式为:

取小鼠部分肝脏,固定、进行苏木精-伊红染色(Hematoxylin-eosin staining,HE),观察肝细胞排列形态大小间隙等。按照相应试剂盒说明,测定小鼠肝、肾组织匀浆中蛋白质、谷胱甘肽过氧化物酶(GSH-Px)、过氧化物酶(GSH)的活力以及小鼠血清和肝、肾组织匀浆中丙二醛(MDA)的含量和超氧化物歧化酶(SOD)的活力。
1.3 统计学分析
2 结果与分析
2.1 芦丁标准曲线
根据芦丁浓度和吸光度绘制标准曲,如图1,得到浓度和吸光度值得回归方程:Y=0.574 3X+0.004 9,(R2=0.999)。再测定桂花黄酮溶液的吸光度值,根据回归方程得到其中桂花提取液中总黄酮的浓度。
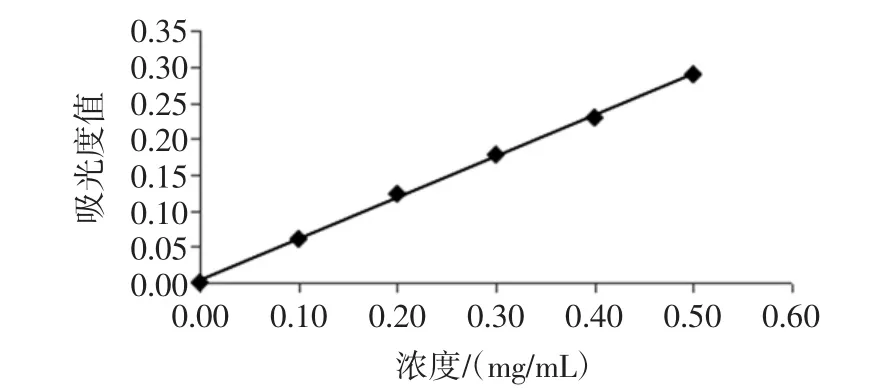
图1 芦丁标准曲线Fig.1 Standrad curve of rutin
2.2 DPPH自由基清除试验
DPPH自由基清除能力见图2。

图2 对DPPH自由基的清除能力Fig.2 Scavenging ability of DPPH radical
由图2可知,桂花总黄酮清除DPPH自由基的能力在0~0.08 mg/mL浓度范围内,随浓度的增加而增强,当浓度大于0.08 mg/mL时,清除率增长较缓慢,逐渐趋于稳定接近于抗坏血酸清除DPPH自由基的能力。说明桂花总黄酮具有一定清除DPPH自由基的能力。DPPH·是一种以氮为中心的自由基,易溶于醇溶液并呈紫色,当加入自由基清除剂时,DPPH自由基与其发生反应,可以通过在517 nm处比较溶液吸光值的变化评价物质的抗氧化能力。刘军海等[15]在评价桂花残渣中总黄酮抗氧化能力时发现在一定浓度范围内桂花总黄酮清除DPPH自由基的能力逐渐增强并且趋于稳定与本试验相同,但当桂花残渣总黄酮的质量浓度达到0.06 mg/mL时其抗氧化能力优于抗坏血酸与本试验不同,推测是因为桂花品种不同,提取黄酮的条件方式不同,提取原料不同所造成。郭娇娇等[16]研究表明桂花总黄酮提取物有良好的DPPH自由基清除能力与本试验所得结果一致。
2.3 ABTS+自由基清除试验
ABTS+自由基清除能力见图3。
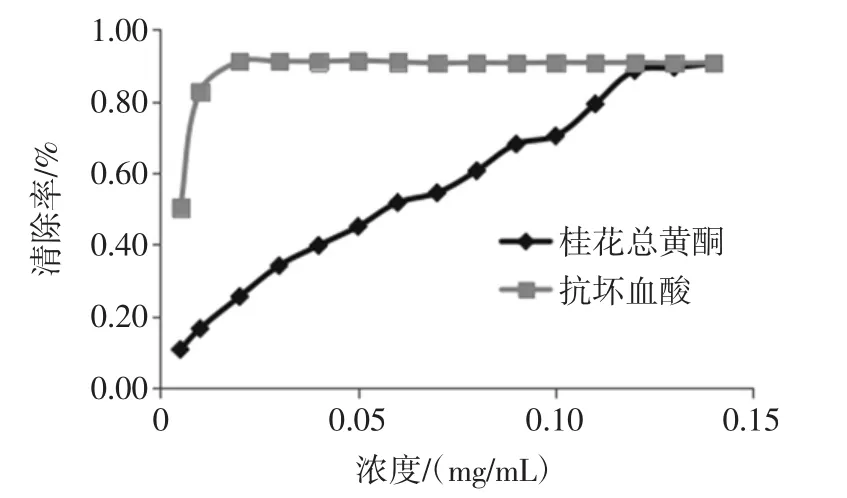
图3 对ABTS+自由基的清除能力Fig.3 Scavenging ability of ABTS+radical
由图3可知,桂花黄酮对ABTS+自由基的清除效果与其浓度大小紧密相关,随着桂花黄酮浓度的升高,对ABTS+自由基的清除能力也迅速增强。当桂花黄酮浓度低于0.12 mg/mL,随着浓度的增加,对ABTS+自由基的清除能力也迅速增加,当浓度大于0.12 mg/mL时,桂花总黄酮对ABTS+自由基的清除能力增长缓慢逐渐接近于抗坏血酸清除ABTS+自由基的能力,并趋于稳定。说明桂花总黄酮化合物能够有效清除ABTS+自由基。
2.4 还原能力
还原能力与氧化活性之间有显著的相关性,物质的还原能力越强,越不容易被氧化,表示抗氧化能力越强,结果见图4。

图4 桂花总黄酮的还原能力Fid.4 Reducing capacity of TFOF
由图4可知,桂花总黄酮化合物在试验质量浓度范围内随桂花黄酮浓度的增加,对铁离子的还原能力越强,说明桂花黄酮具有良好的还原能力。
2.5 体内抗氧化作用研究
2.5.1 桂花黄酮对小鼠体征和脏器系数的影响
与正常小鼠对比,模型组小鼠明显毛色稀疏且无光泽毛发易脱落,行动迟缓,有嗜睡现象;而正常小鼠毛发浓密有光泽,行动更敏捷。其余3个实验组,高、中剂量组与正常组无明显差别,而低剂量组毛色明显稀疏灰暗。
脏器系数能初步反应动物机体受到氧化损伤的程度,脏器系数与机体的衰老程度相关[17]。桂花黄酮对小鼠脏器系数的影响见表2。从表2可知,与空白组比较,模型组小鼠肝脏、肾脏、胸腺、脑系数都略有下降,其中肝脏、脾和胸腺系数与空白对照组相比均显著降低(P<0.05),说明D-半乳糖抑制了小鼠各脏器组织的生长并且使肝脏、脾、胸腺受到一定程度的损伤。与模型组相比,桂花黄酮高、中、低剂量组的各脏器系数略高于模型组,其中桂花黄酮高剂量组的肝脏和胸腺系数显著增高,具有极显著性差异(P<0.01)。由此可以说明桂花黄酮在一定程度上可以修复D-半乳糖所致的损伤作用,或可以阻止D-半乳糖对小鼠生长的抑制作用。
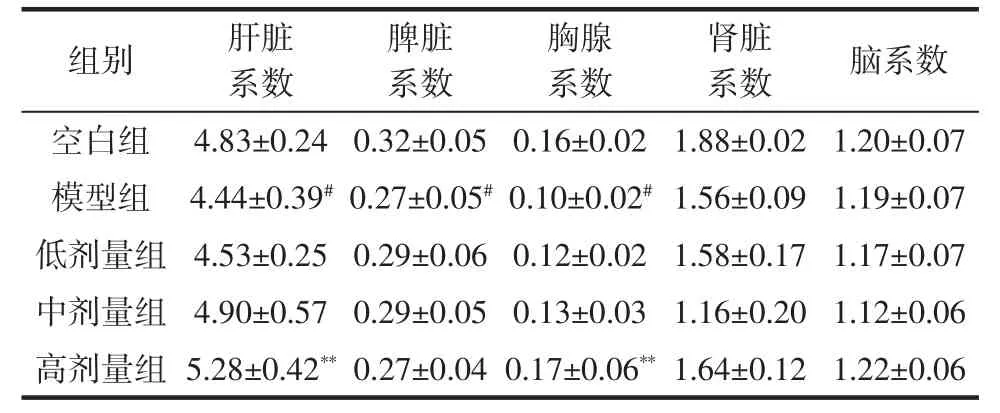
表2 桂花黄酮对小鼠脏器系数的影响Table 2 Effects of TFOF on organs indexes in mice %
2.5.2 桂花黄酮对小鼠血清及脏器中MDA含量的影响
MDA是生物体内最具有代表性脂质过氧化产物,MDA的含量能够反应生物体内脂质过氧化的程度[18]。桂花黄酮对小鼠血清及脏器中MDA含量的影响见表3。

表3 桂花黄酮对小鼠血清及脏器中MDA含量的影响Table 3 Effects of TFOF on MDA contents in mice’s serum,liver and kidney
从表3中的实验数据可以得出,与空白组相比较,模型组小鼠血清及肝脏组织中MDA的含量升高具有极显著差异(P<0.01),并且肾脏组织中MDA含量升高具有显著差异(P<0.05);与模型组相比较,小鼠血清中,桂花高、中、低剂量组MDA含量均低于模型组且具有极显著性差异(P<0.01),在肝脏组织中,桂花黄酮中、高剂量组MDA含量较模型组低且具有极显著性差异(P<0.01),在肾脏组织中,桂花黄酮高剂量组的MDA含量较模型组极显著降低(P<0.01),说明桂花黄酮能降低D-半乳糖致衰小鼠体内MDA的含量,降低机体内脂质过氧化的程度,从而保护细胞结构和功能的完整性,并且随桂花黄酮浓度增大,对机体的保护作用增强。
2.5.3 桂花黄酮对小鼠血清、肝脏及肾脏组织中SOD活性的影响
SOD是生物体内重要的抗氧化酶,是生物体内清除自由基的首要物质。SOD在机体内主要清除超氧阴离子自由基,超氧阴离子自由基是自由基链锁反应的前生物,SOD可将其除去是避免机体活性氧大量生成的第一道防线[19]。桂花黄酮对小鼠血清、肝脏及肾脏组织中SOD活性的影响见表4。

表4 桂花黄酮对小鼠血清、肝脏及肾脏组织中SOD活性的影响Table 4 Effects of TFOF on the activity of SOD in mice’s serum,liver and kidney
从表4实验数据可知,与空白组相比,模型组小鼠的血清,肝脏和肾脏中SOD活性明显降低,有极显著性差异(P<0.01);与模型组相比,血清中,桂花黄酮高剂量组小鼠SOD活性高于模型组,有极显著性差异(P<0.01);在在肝脏组织中,桂花黄酮中、高剂量组SOD活性较模型组具有显著差异(P<0.05);在肾脏组织中桂花黄酮高剂量组的SOD活性较模型组具有极显著差异(P<0.01)。本实验表明,D-半乳糖可以通过降低小鼠血清、肝脏和肾脏中SOD的活性造成超氧阴离子等自由基在小鼠体内大量累积,导致小鼠机体衰老损伤,而一定浓度的桂花黄酮可以提高小鼠体内SOD的活性,清除机体中的有害物质,修复D-半乳糖对小鼠机体造成损伤。
2.5.4 桂花黄酮对小鼠肝脏和肾脏中GSH的影响
GSH是组织中一种非蛋白的硫基化合物,可以通过硫基和自由基结合,稳定含硫基的酶和防止血红蛋白等受到氧化损伤[20]。桂花黄酮对小鼠肝脏和肾脏中GSH的影响见表5。

表5 桂花黄酮对小鼠肝脏和肾脏中GSH的影响Table 5 Effects of TFOF on the activity of GSH in mice’s liver and kidney μmol/gprot
从表5实验数据可知,与空白组相比,模型组小鼠肝脏中GSH活性具有显著差异(P<0.05),肾脏中的GSH活性具有极显著差异(P<0.01);与模型组相比较,桂花黄酮高剂量组小鼠肝脏和肾脏组织中GSH活性较模型组增加,且具有显著性差异(P<0.05)。表明一定浓度的桂花黄酮可以提高衰老小鼠体内GSH的活性,清除机体内多余的自由基,保护蛋白质及相关抗氧化酶不受自由基的损害,从而维持细胞结构和功能的完整性。
2.5.5 桂花黄酮对小鼠肝脏和肾脏组织中GSH-Px活力的影响
GSH-Px在机体内能特异的催化GSH对过氧化氢的分解,从而阻断脂质过氧化反应,降低MDA的生成从而起到保护细胞膜功能和结构的作用[21]。桂花黄酮随小鼠肝脏和肾脏中GSH-Px的影响见表6。

表6 桂花黄酮随小鼠肝脏和肾脏中GSH-Px的影响Table 6 Effects of TFOF on the activity of GSH-Px in mice’s liver and kidney U/gprot
如表6所示,与空白组相比,模型组小鼠肝脏组织中的GSH-Px活力下降且具有极显著差异(P<0.01),肾脏组织中GSH-Px活性下降且具有显著差异(P<0.05);与模型组小鼠相比,桂花黄酮高剂量组小鼠肝脏组织中GSH-Px活性增加且具有极显著差异(P<0.01),桂花黄酮中剂量组小鼠肾脏组织中GSH-Px活性增高具有显著差异(P<0.05)并且高剂量组小鼠肾脏组织中GSH-Px活性增高具有极显著差异(P<0.01)。表明一定浓度的桂花黄酮可以提高D-半乳糖所致亚急性衰老小鼠体内GSH-Px的活性,增强GSH的功能,减少机体内有害物质的堆积,一定程度上修复D-半乳糖对小鼠造成的损伤。
2.5.6 小鼠肝组织病理学观察
小鼠肝组织病理切片见图5。

图5 小鼠肝组织病理切片(100×)Fig.5 Pathological sections of liver in mice(100×)
空白对照组小鼠肝细胞无明显变化,而模型组小鼠肝脏细胞形态排列紊乱,细胞间隙较大,可见脂肪变性,说明D-半乳糖破坏了小鼠的肝组织细胞结构。与模型组比较,桂花黄酮中、低剂量组小鼠肝细胞仍可见脂肪细胞变性,而桂花黄酮高剂量组小鼠肝细胞排列整齐,未见脂肪变性。表明桂花黄酮可以改善D-半乳糖致衰老小鼠肝细胞的形态,减轻氧化反应对细胞造成的损害,保护细胞正常生理功能,其修复能力与桂花黄酮的浓度有关。
3 结论
本研究中体外试验采用了DPPH法和ABTS法两种最常用的评价物质抗氧化性的试验体系以及对铁离子的还原能力的测定,证明了桂花黄酮类化合物具有良好的抗氧化活性,据此可以将桂花黄酮作为天然抗氧化剂加以开发利用。体内实验证明,桂花黄酮类化合物能够修复D-半乳糖对小鼠的损伤作用,提高机体的抗氧化能力,其机制与清除自由基,提高机体内抗氧化酶活性和降低脂质过氧化反应有关。本次研究通过较为系统的对桂花黄酮类化合物在体内外抗氧化活性进行了评价为其以后在食品、药品及保健品方面的应用提供了理论和试验基础。
