小分子青稞β-葡聚糖辅助降血糖功能研究
2018-10-31胡辉刘鹏程佩佩王委刘源才
胡辉,刘鹏,程佩佩,王委,刘源才,4
(1.劲牌生物医药有限公司,湖北黄石435000;2.劲牌有限公司,湖北大冶435100;3.中药保健食品质量与安全湖北省重点实验室,湖北大冶435100;4.劲牌研究院,湖北黄石435000)
β-葡聚糖,即(1-3)(1-4)-β-D-葡聚糖,是由 β-1,3和β-1,4糖苷键将D-吡喃葡萄糖基连接而成的线型均一性非淀粉多糖[1],具有降低血液中胆固醇水平[2]、调节血糖浓度[3]、增强机体免疫力[4]等重要的生理功能。美国食品药品管理局已颁发相关条例,认可在食品中添加β-葡聚糖组分有利于人们健康[5],英、法等国食药监局不但允许在含大麦的产品包装上标明该类食物能减少患冠心病风险,还强制规定“一般成人日均摄入食品中β-葡聚糖绝对量不低于3 g”的指标[6]。随着高血压、高血脂、肥胖、糖尿病等“现代文明病”的高发,膳食纤维的需求量日渐旺盛。青藏高原特殊的生态条件赋予了青稞在世界范围内拥有最高β-葡聚糖含量[7-8]的宝贵特征,青稞β-葡聚糖的研究与利用对青稞产业的发展具有重要意义。
然而青稞β-葡聚糖是青稞籽粒胚乳细胞壁的主要成分,占胚乳细胞壁干重的75%左右,是一类非淀粉多糖[9]。与纤维素结构类似,其中就有超过10个葡萄糖分子以β-1,4糖苷键连接的β-葡聚糖片段,该结构片段在水及乙醇中溶解性极低[10],影响产品稳定性和消费者体验。另有学者研究显示,餐后血糖指数与胰岛素反应受β-葡聚糖分子量的影响[11],分子量为40 000[12]及100 000[13]的β-葡聚糖提取物无显著降低餐后血糖的效果,而分子量为70 000[12]的β-葡聚糖提取物具有显著降低餐后血糖的效果,推测其降血糖功效可能与分子量关系密切,因此特定分子量的β-葡聚糖需进行药理活性研究。
现行的提取工艺分为3类,分别为水提法[14-17]、碱提法[18-19]和酸提法[20-21],水提法得到的葡聚糖分子片段最完整,但分子量大小不齐,且含有难溶大分子片段,提取物在水及乙醇溶液中的稳定性不好,易沉淀;碱提法和酸提法对不溶性葡聚糖提取效果较好,但水解产物的分子量不易控制,且酸提法得到的提取物降低了提取物的黏度,可能影响其功能活性。鉴于此,本课题组将从工艺和药效方面解决以下问题:1)采用先碱提再酶解的方法,解决青稞β-葡聚糖分子量大和在水及乙醇溶液中溶解性不好的问题,拓展青稞β-葡聚糖在饮料行业中的应用;2)以酶解前后青稞β-葡聚糖为受试样品进行动物实验,研究酶解后产物的辅助降血糖功能。
1 材料与方法
1.1 材料
1.1.1 受试样品的制备方法
青稞β-葡聚糖A(未酶解样品):将青稞粉碎后用80%乙醇回流2 h脱脂,弃去乙醇液,加4倍量水混匀后,饱和碳酸钠溶液调pH值至8.5~9.0,(75±5)℃提取2 h,提取液加入10%的盐酸调pH 4.5,冷却后离心(16 000 r/min),将离心清液干燥即得。
青稞β-葡聚糖B(酶解后样品):青稞粉碎后用80%乙醇回流2 h脱脂,弃去乙醇液,加4倍量水混匀后,饱和碳酸钠溶液调pH值至8.5~9.0,(75±5)℃提取2 h,提取液加入10%的盐酸调pH 4.5,冷却后离心(16 000 r/min),离心清液pH值用饱和碳酸钠溶液调节调至7.0,加入10%α-淀粉酶,在50℃下酶解4 h,煮沸30 min杀酶,冷却,上清液经过超滤膜纯化,收集截留液,干燥即得。
1.1.2 材料及仪器
KM小鼠(SPF等级,雌性,生产许可证号SCXK(湘)2011-0003,合格证号 43004700016013):湖南斯莱克景达实验动物有限公司;小鼠于湖北师范大学动物实验房养殖,环境温度20℃~26℃,相对湿度40%~70%,光照12 h/d;辐照小鼠繁殖饲料:湖南斯莱克景达实验动物有限公司。
JPS-6型系列手持式全血葡萄糖测试仪、虹吸式血糖试条:北京怡成生物电子技术有限公司;小鼠灌胃针:武汉恒康医疗器械有限公司。
1.1.3 样品及试剂
青稞β-葡聚糖提取物样品A、B(黄色粉末,2.25 kg/袋)人体推荐摄入量7.8 g/d,按成人60 kg.bw计为130 mg/kg·bw、15度基酒(10瓶,5 L/瓶):均由湖北劲牌生物医药有限公司生产;链脲佐菌素:Sigma;中温α-淀粉酶(酶活力3 000 U/g):山东苏柯汉生物工程股份有限公司;其他试剂均为分析纯。
柠檬酸缓冲液:称取2.1 g柠檬酸(相对分子量210.4)溶于双蒸水,定容至100 mL,配成A液。称取2.94 g柠檬酸钠(相对分子量294.10)溶于双蒸水,定容至100 mL,配成B液。用时将A液和B液按照1∶1.32(体积比)混合,即配成柠檬酸缓冲液。链脲佐菌素溶液:用柠檬酸缓冲液配置,现配现用,遮光置于冰上,30 min内,必须注射完毕。
青稞葡聚糖A(批号20141008)、青稞葡聚糖B(批号20150416)样品均委托青岛科标化工分析有限公司检测,检测结果见表1。
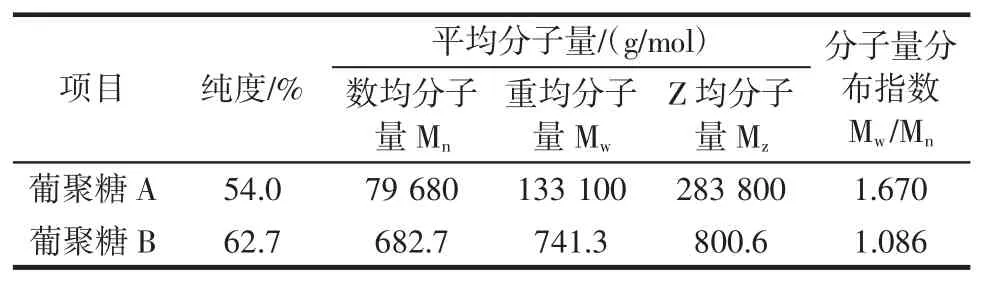
表1 青稞β-葡聚糖样品平均分子量和纯度Table 1 Average molecular weight and purity quotient of hull-less barley β-glucan
青稞β-葡聚糖酶解后(B)相较于未酶解(A)产物,在50%乙醇溶液和纯水溶液中澄清透明,不显乳白色浑浊状态,显示酶解后产物溶解性良好(葡聚糖浓度为5%)。
1.2 方法
1.2.1 实验方法
1.2.1.1 正常小鼠降血糖实验
75只KM小鼠,适应性饲养一周后,按禁食不禁水7 h~8 h的血糖水平随机分组,分别为:空白对照组(15度基酒、纯水)、3个样品组(15度基酒+B、纯水+B、纯水+A),15只/组,共5组。空白对照组给予同体积溶剂(15度基酒、纯水),3个样品组给予20倍人体推荐量,连续灌胃30 d,灌胃体积为0.4 mL,测空腹血糖值(禁食同实验前),比较各组动物血糖值。
1.2.1.2 高血糖(1型糖尿病)模型小鼠降血糖实验
随机取15只KM小鼠,适应性饲养1周后,禁食7 h~8 h,测空腹血糖,作为该批次小鼠基础血糖值。随后取200只待造模小鼠,禁食12 h以上(自由饮水),注射链脲佐菌素(用前新鲜配制)造模,小鼠腹腔注射80 mg/kg.BW,连续注射两天。5 d~7 d后小鼠禁食7 h~8 h,测血糖,血糖值 10 mmol/L~25 mmol/L[22]的小鼠,判断高血糖模型建立成功。
取165只成功的高血糖模型小鼠按禁食7 h~8 h的血糖水平(组间差不大于1.1 mmol/L)随机分组,分别为:2个模型对照组(15度基酒、纯水)、9个样品组(15度基酒+B、纯水+B、纯水+A),15只/组,共 11组。样品组分别给予低中高3个剂量,剂量浓度依次为5、10、20倍人体推荐量,模型对照组分别给予同体积溶剂(15度基酒、纯水),连续灌胃30 d,测空腹血糖值(禁食同实验前),比较各组动物血糖值及血糖下降百分率。

1.2.1.3 高血糖模型小鼠糖耐量实验
高血糖模型小鼠(降血糖实验),连续灌胃30 d后,测空腹血糖值(禁食同实验前),作为给葡萄糖前(即0 d)血糖值,15 min~20 min后各组经口给予葡萄糖2.0 g/kg·bw,测定给葡萄糖后各组0.5、2 h的血糖值,观察模型对照组与受试样品组给葡萄糖后各时间点(0、0.5、2 h)血糖值及血糖曲线下面积的变化。
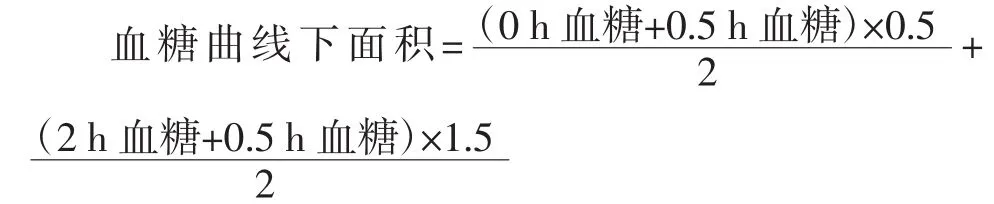
1.2.2 数据分析及结果判定
采用T检验、方差分析SNK检验(方差齐时)及Dunnett T3检验(方差不齐时)(SAS9.3软件包),结果以±s表示,组间比较采用单因素方差分析。
血糖指标:空腹血糖受试样品剂量组与对照组比较无统计学意义,判定对正常动物血糖无影响。
空腹血糖指标:模型成立的前提下,受试样品剂量组与模型对照组比较,空腹血糖下降或血糖下降百分率升高有统计学意义,判定该受试样品空腹血糖指标结果阳性。
糖耐量指标:模型成立的前提下,受试样品剂量组与模型对照组比较,在给葡萄糖后0.5、2 h任一时间点血糖下降(或血糖下降百分率升高)有统计学意义,或0、0.5、2 h血糖曲线下面积降低有统计学意义,判定该受试样品糖耐量指标结果阳性。
结果判定:根据“保健食品功能学评价程序和检验方法”中辅助降血糖功能的结果判定规则[23],在模型成立的条件下空腹血糖和糖耐量二项指标中有一项阳性,且对正常动物空腹血糖无影响即可判定该受试物辅助降血糖功能为阳性。
2 结果与分析
2.1 青稞β-葡聚糖辅助降血糖功能评价
2.1.1 正常小鼠降血糖实验
正常小鼠降血糖实验,灌胃30天前后,各组血糖水平,如表2。
表2 对正常小鼠血糖水平的影响(±s,n=15)Table 2 Effects of blood glucose levels on normal mice
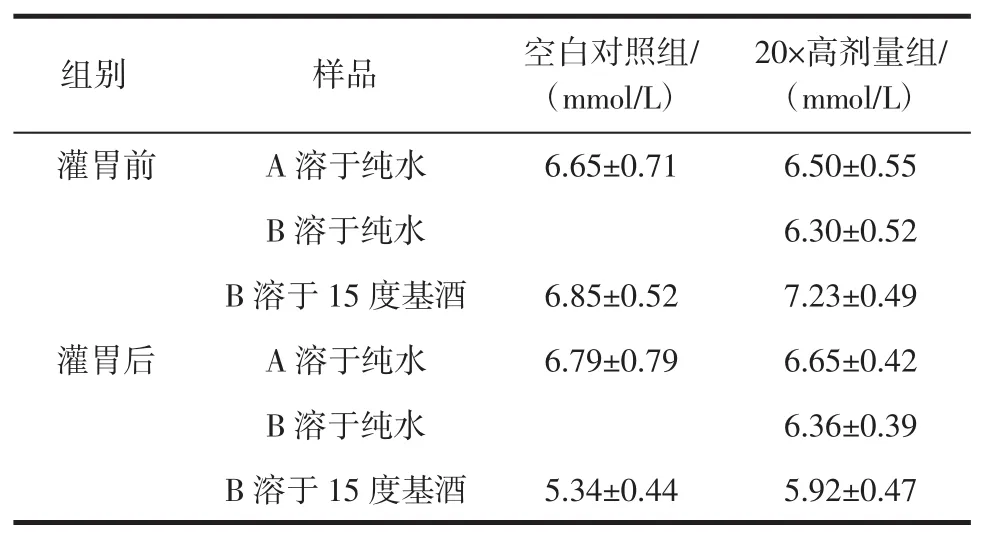
表2 对正常小鼠血糖水平的影响(±s,n=15)Table 2 Effects of blood glucose levels on normal mice
20×高剂量组/(mmol/L)灌胃前 A溶于纯水 6.65±0.71 6.50±0.55 B溶于纯水 6.30±0.52 B溶于15度基酒 6.85±0.52 7.23±0.49灌胃后 A溶于纯水 6.79±0.79 6.65±0.42 B溶于纯水 6.36±0.39 B溶于15度基酒 5.34±0.44 5.92±0.47组别 样品 空白对照组/(mmol/L)
与空白对照组相比,青稞β-葡聚糖A和B溶于纯水及15度基酒实验,灌胃前后,各组小鼠血糖值均无显著差异,表明受试物对正常小鼠的空腹血糖水平无明显影响。
2.1.2 高血糖模型小鼠降血糖实验
将造模成功的高血糖模型小鼠按血糖水平随机分组,组间差不大于1.1 mmol/L,实验前后各组小鼠血糖值变化见表3、表4。
青稞β-葡聚糖A、B分别溶于纯水的实验中,灌胃前后,3个剂量组血糖下降率与模型组相比具有显著性差异,但各剂量组之间无显著差异。青稞β-葡聚糖B溶于15度基酒灌胃实验中,中、高剂量组小鼠血糖下降率均不及模型组。
表3 建模成功时,各组小鼠血糖值(±s,n=15)Table 3 Levels of blood glucose on hyperglycemic mice before test

表3 建模成功时,各组小鼠血糖值(±s,n=15)Table 3 Levels of blood glucose on hyperglycemic mice before test
注:#表示与空白对照组相比,结果差异显著(p<0.05)。
样品/组别空白对照组/(mmol/L)模型对照组/(mmol/L)5×低剂量组/(mmol/L)10×中剂量组/(mmol/L)20×高剂量组/(mmol/L)A 溶于纯水 6.65±0.44 14.11±0.77# 13.96±0.88# 13.86±0.59# 14.20±0.62#B 溶于纯水 14.18±0.75# 14.21±0.63# 14.02±0.72#B 溶于基酒 6.85±0.39 15.93±0.63# 15.96±0.91# 16.04±0.84# 15.92±0.88#
表4 灌胃30天后,各组小鼠血糖值(±s,n=15)Table 4 Levels of blood glucose on hyperglycemic mice after test
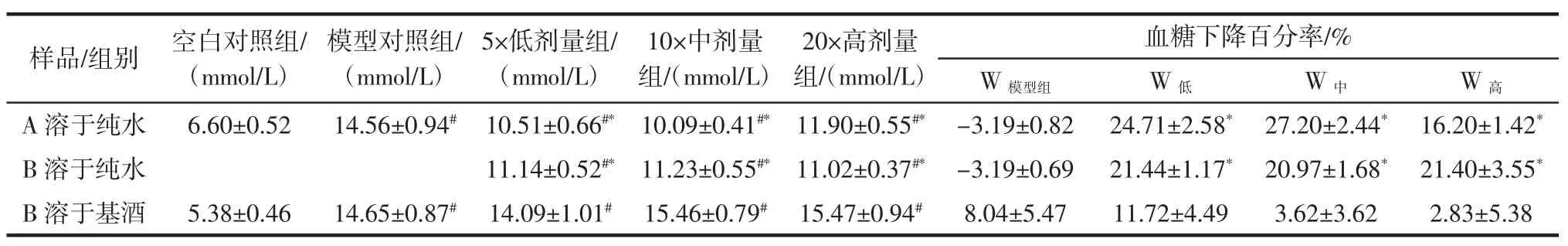
表4 灌胃30天后,各组小鼠血糖值(±s,n=15)Table 4 Levels of blood glucose on hyperglycemic mice after test
注:#表示与空白对照组相比,结果差异显著(p<0.05);*表示与模型对照组相比,结果差异显著(p<0.05)。
血糖下降百分率/%W模型组 W低 W中 W高A 溶于纯水 6.60±0.52 14.56±0.94# 10.51±0.66#* 10.09±0.41#* 11.90±0.55#* -3.19±0.82 24.71±2.58* 27.20±2.44* 16.20±1.42*B 溶于纯水 11.14±0.52#* 11.23±0.55#* 11.02±0.37#* -3.19±0.69 21.44±1.17* 20.97±1.68* 21.40±3.55*B 溶于基酒 5.38±0.46 14.65±0.87# 14.09±1.01# 15.46±0.79# 15.47±0.94# 8.04±5.47 11.72±4.49 3.62±3.62 2.83±5.38样品/组别 空白对照组/(mmol/L)模型对照组/(mmol/L)5×低剂量组/(mmol/L)10×中剂量组/(mmol/L)20×高剂量组/(mmol/L)
2.1.3 高血糖模型小鼠糖耐量实验
将青稞β-葡聚糖A、B分别溶于纯水,青稞β-葡聚糖B溶于15度基酒,分别对此3个样品进行糖耐量实验,结果见表5~表7。
表5 高血糖模型小鼠糖耐量实验(A溶于纯水)(±s,n=15)Table 5 Test of glucose tolerance on hyperglycemic mice(sample A dissolved in water)
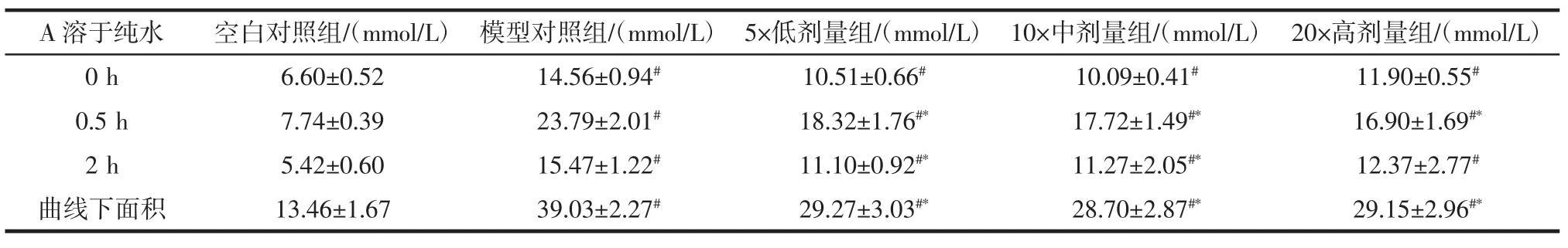
表5 高血糖模型小鼠糖耐量实验(A溶于纯水)(±s,n=15)Table 5 Test of glucose tolerance on hyperglycemic mice(sample A dissolved in water)
注:#表示与空白对照组相比,差异显著(p<0.05);*表示与模型对照组相比,差异显著(p<0.05)。
A溶于纯水空白对照组/(mmol/L)模型对照组/(mmol/L)5×低剂量组/(mmol/L)10×中剂量组/(mmol/L)20×高剂量组/(mmol/L)0 h 6.60±0.52 14.56±0.94# 10.51±0.66# 10.09±0.41# 11.90±0.55#0.5 h 7.74±0.39 23.79±2.01# 18.32±1.76#* 17.72±1.49#* 16.90±1.69#*2 h 5.42±0.60 15.47±1.22# 11.10±0.92#* 11.27±2.05#* 12.37±2.77#曲线下面积 13.46±1.67 39.03±2.27# 29.27±3.03#* 28.70±2.87#* 29.15±2.96#*
表6 高血糖模型小鼠糖耐量实验(B溶于纯水)(±s,n=15)Table 6 Test of glucose tolerance on hyperglycemic mice(sample B dissolved in water)

表6 高血糖模型小鼠糖耐量实验(B溶于纯水)(±s,n=15)Table 6 Test of glucose tolerance on hyperglycemic mice(sample B dissolved in water)
注:#表示与空白对照组相比,差异显著(p<0.05);*表示与模型对照组相比,差异显著(p<0.05)。
B溶于纯水空白对照组/(mmol/L)模型对照组/(mmol/L)5×低剂量组/(mmol/L)10×中剂量组/(mmol/L)20×高剂量组/(mmol/L)0 h 6.60±0.52 14.56±0.94# 11.14±0.52# 11.23±0.55# 11.02±0.37#0.5 h 7.74±0.39 23.79±2.21# 18.86±1.89#* 19.02±2.41#* 19.37±2.33#*2 h 5.42±0.60 15.47±1.22# 12.11±0.71#* 12.56±1.48# 12.62±0.96#曲线下面积 13.46±1.67 39.03±2.47# 30.73±2.32#* 31.25±3.27#* 31.59±2.95#*
表7 高血糖模型小鼠糖耐量实验(B溶于15度基酒)(±s,n=15)Table 7 Test of glucose tolerance on hyperglycemic mice(sample B dissolved in ethanol solution)
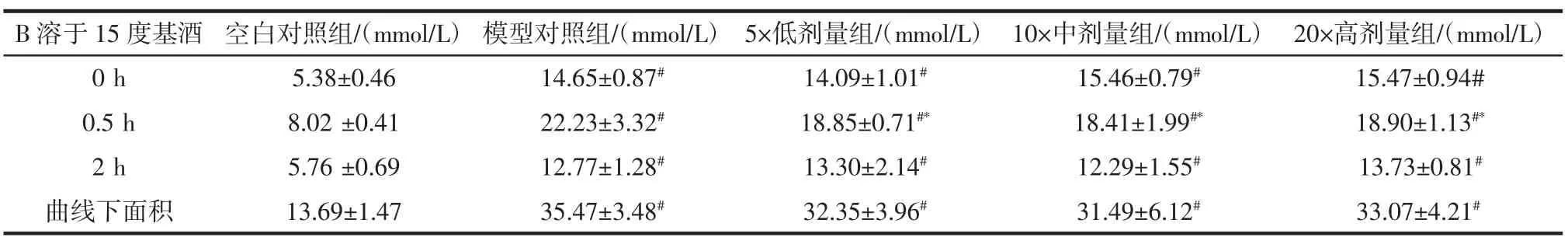
表7 高血糖模型小鼠糖耐量实验(B溶于15度基酒)(±s,n=15)Table 7 Test of glucose tolerance on hyperglycemic mice(sample B dissolved in ethanol solution)
注:#表示与空白对照组相比,差异显著(p<0.05);*表示与模型对照组相比,差异显著(p<0.05)。
B溶于15度基酒空白对照组/(mmol/L)模型对照组/(mmol/L)5×低剂量组/(mmol/L)10×中剂量组/(mmol/L)20×高剂量组/(mmol/L)0 h 5.38±0.46 14.65±0.87# 14.09±1.01# 15.46±0.79# 15.47±0.94#0.5 h 8.02 ±0.41 22.23±3.32# 18.85±0.71#* 18.41±1.99#* 18.90±1.13#*2 h 5.76 ±0.69 12.77±1.28# 13.30±2.14# 12.29±1.55# 13.73±0.81#曲线下面积 13.69±1.47 35.47±3.48# 32.35±3.96# 31.49±6.12# 33.07±4.21#
降血糖实验结束后,灌胃给予2.0 g/kg·bw葡萄糖,糖耐量实验结束时模型对照组0.5、2 h血糖与空白对照组相比显著升高,提示高血糖小鼠模型成立。对于以纯水为溶剂的A、B受试样品实验中,3个剂量组0.5h血糖值显著低于模型组,且曲线下面积均显著降低,而不同剂量组之间无显著性差异,说明A、B样品溶于纯水均具有辅助降血糖功效,但无明显剂量效应。B样品溶于15度基酒实验中,0.5 h血糖值下降与模型组相比具有显著性,但2 h后并不能显著降低血糖,提示B样品溶于15度基酒不具有辅助降血糖功能。
3 讨论与结论
3.1 青稞β-葡聚糖溶解性
青稞β-葡聚糖提取物的溶解性受制备工艺、提取物纯度、分子量范围等多方面的影响。研究考察不同提取工艺(水提、碱水提、酶水解)之间β-葡聚糖的性质差别,水及碱水提取得到的大分子β-葡聚糖,在水及醇溶液中溶解性不佳,而经过酶切工艺得到的小分子β-葡聚糖溶解性良好;考察了不同种类的酶(糖化酶、α-淀粉酶以及双酶联用)对大分子β-葡聚糖的酶解效果,结果糖化酶糖化4 h对大分子片段的酶解效果并不明显且糖化过程耗时[24],不利于工业生产;考察不同比例α-淀粉酶(1%、5%、10%)对β-葡聚糖的酶解效果,结果表明添加10%α-淀粉酶后,小分子葡聚糖得率最高(得率分别为68.1%、70.4%、74.8%);中试实验中采用膜过滤工艺后,β-葡聚糖转移率为34.45%,明显高于醇沉工艺的转移率23.52%,且便于车间自动化控制,王谦等[25]研究结果显示优化后的膜滤工艺能够使青稞提取液中β-葡聚糖截留率达到99.2%,且起到了纯化蛋白质、色素等杂质的作用。最终采取碱水提取后,经10%α-淀粉酶酶解,再经过固定孔径的超滤膜过滤,得到的β-葡聚糖分子量小且均匀,在50%乙醇溶液及水中的溶解性良好。
3.2 辅助降血糖作用
本实验研究了低分子量青稞-β葡聚糖对高血糖小鼠的辅助降血糖活性。结果表明,青稞-β葡聚糖A(未酶解)、B(酶解后)两种提取物样品,对正常动物空腹血糖无显著影响;在溶于纯水的降血糖及糖耐量实验中,血糖下降百分率和血糖曲线下面积均具有显著性,判定两种样品溶于纯水具备辅助降血糖的功能;但是将青稞-β葡聚糖B(酶解后)样品溶于15度基酒的动物实验中,血糖下降百分率及血糖曲线下面积相较于模型组均未显著降低,提示基酒溶解的样品不具备辅助降血糖功能。有文献报道,β-葡聚糖在水中溶解后具有粘性,食用后可覆盖于胃黏膜,减缓胃肠道对葡萄糖的吸收[15,26-27],是否改用15度基酒为溶剂后降低了溶液的粘性,从而无法减缓葡萄糖的吸收,导致辅助降血糖作用不明显,还有待进一步研究。
