俄色叶水提物对糖尿病模型小鼠降血糖作用的研究
2018-10-31任军辉索朗欧珠邵妍丽德央丁云春
任军辉,索朗欧珠,*,邵妍丽,德央,丁云春
(1.西藏职业技术学院,西藏拉萨850000;2.西藏自治区罗布林卡管理处,西藏拉萨850000)
俄色叶为蔷薇科植物变叶海棠Malus toringoides(Rehd.)Hughes.和花叶海棠 Malus tiansitoria(Batal.)Schneid.的叶,在西藏、青海、四川等藏区可作为保健饮品,泡水代茶饮用,具有攻坚化积、除腻涤滞等功效,用于治疗消化不良、高血糖、高血脂、高血压等,日用量为5 g~10 g[1-2]。已有研究表明,俄色叶中含有大量黄酮类物质,其中,以根皮苷的含量较高[3-4]。俄色叶醇提物用于糖尿病小鼠模型,可有效改善糖尿病症状,降低血糖水平[5]。但是,对于俄色叶水提物降血糖作用未有报道,此外,日常茶饮中,原料用量一般较少,俄色叶能否在较低剂量下发挥作用,这是本研究希望探讨的问题之一。因此,本论文采用日常茶饮方法,通过沸水浸提俄色叶,探究其降血糖作用,为俄色叶茶饮产品的进一步开发提供试验依据。
1 材料与方法
1.1 材料
俄色叶:采自西藏昌都,经西藏职业技术学院丁云春教授鉴定为蔷薇科苹果属植物变叶海棠Malus toringoides(Rehd.)Hughes.的叶。
实验动物:雄性昆明种小鼠,SPF级,体重(20±2)g,购自西安交通大学,动物质量合格证号SCXK(陕)2012-003。
1.2 仪器与试剂
四氧嘧啶(批号 101615221):Sigma公司;盐酸二甲双胍片(批号1707052):青岛黄海制药有限责任公司;总超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号:20171118)、丙二醛(malondialdehyde,MDA)试剂盒(批号:20171118)、一氧化氮(nitric oxide,NO)试剂盒(批号:20171118)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(批号:20171118)、甘油三酯(triglyceride,TG)试剂盒(批号:20171206)、总胆固醇(totalcholesterol,TC)试剂盒(批号:20171206)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)测试盒(批号:20171118)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)测试盒(批号:20171118):南京建成生物工程研究所;其他试剂均为分析纯。
安准型血糖仪:三诺生物传感股份有限公;ELx800酶标仪:美国Bio-Tek公司;TGL-16高速离心机:长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 俄色叶水提物的制备
称取俄色叶50 g,加入沸水约1 L,浸泡30 min后倒出上清液,反复浸泡3次,至水溶液呈无色,合并药液,真空减压浓缩至相当于俄色叶生药量5 kg/L,即得俄色叶水提物,备用。
1.3.2 糖尿病小鼠模型建立[6]
小鼠适应性喂养7 d后,随机分组,禁食但不禁水12 h,每只小鼠按220 mg/kg剂量腹腔注射四氧嘧啶(四氧嘧啶采用pH 4.5柠檬酸缓冲液溶液配制),空白组、小鼠注射等剂量生理盐水,随后正常饲养。72 h后尾静脉取血,利用血糖试纸测定空腹血糖,血糖值≥11.1 mmol/L视为糖尿病模型造模成功。
1.3.3 动物分组及给药
将造模成功的糖尿病小鼠进行分组,分别为俄色叶水提物低剂量组(130 mg/kg,相当于成人量1 g/d)、俄色叶水提物中剂量组(260 mg/kg,相当于成人量2 g/d)、俄色叶水提物高剂量组(520 mg/kg,相当于成人量4 g/d)、阳性对照组(盐酸二甲双胍260 mg/kg)、模型组,同时,设立空白组,每组10只,模型组和空白组给予等体积生理盐水,连续灌胃21 d。
1.4 观测指标及方法
1.4.1 小鼠体重变化情况监测
灌胃给药期间监测小鼠第0天、第7天、第14天、第21天的体重,比较各组小鼠的体重变化。
1.4.2 小鼠空腹血糖监测
灌胃给药后的第0天、第7天、第14天、第21天,各组小鼠禁食不禁水12 h,剪尾尖取血,用血糖仪测定其空腹血糖,结果以mmol/L表示,比较各组小鼠的血糖变化。
1.4.3 给药3周后小鼠糖耐量测定[7]
各组小鼠于第21天禁食不禁水12 h后灌胃相应药物,30 min后按照2.0 g/kg剂量灌胃25%的葡萄糖溶液,分别记录灌胃葡萄糖之后的0、30、60、120 min血糖变化并按照公式计算曲线下面积(area under curve,AUC)。
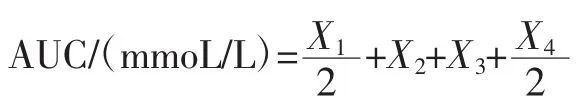
式中:X1、X2、X3、X4分别代表 0、30、60、120 min 的血糖值。
1.4.4 血清中超氧化物歧化酶(SOD)、一氧化氮(NO)、谷丙转氨酶(ALT)、谷草转氨酶(AST)的测定[8-10]
各组小鼠末次灌胃后,禁食不禁水12 h,摘眼球取血,离心得到血清,按照试剂盒说明书测定血清中SOD、NO、ALT、AST 的含量。
1.4.5 肝脏中丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、总胆固醇(TC)、甘油三酯(TG)的测定[11-14]
脱颈处死小鼠后分离肝脏,用生理盐水洗净,而后用匀浆器研磨得肝匀浆,离心,取上清液,按照试剂盒说明书测定肝匀浆中MDA、GSH-Px、TC、TG的含量。
1.5 统计学检验
采用SPSS17.0统计软件进行统计分析,统计量用均值±标准差(±s)表示,组间比较用单因素方差分析,P<0.05具有统计学意义。
2 结果与分析
2.1 俄色叶水提物对糖尿病小鼠体重的影响
俄色叶水提物对糖尿病小鼠体重的影响结果见表1。
表1 俄色叶水提物对糖尿病模型小鼠体重的影响(±s,n=10)Table 1 Effect of water-extraction from Malus toringoides leaves on weight of diabetic mice(±s,n=10)

表1 俄色叶水提物对糖尿病模型小鼠体重的影响(±s,n=10)Table 1 Effect of water-extraction from Malus toringoides leaves on weight of diabetic mice(±s,n=10)
注:与模型组比较,*P<0.05 显著,**P<0.01极显著;与空白组比较,△P<0.05显著,△△P<0.01 极显著。
体重/g造模前 给药0 d 给药7 d 给药14 d 给药21 d空白组 22.30±1.30 25.93±1.55** 29.35±1.21** 33.22±1.41** 36.25±1.98**模型组 21.26±1.24 20.55±1.43△△ 23.58±1.39△△ 25.63±1.88△△ 27.23±1.80△△阳性对照组 0.26 21.38±1.03 21.03±1.84△△ 26.91±1.47*△ 29.40±1.97*△ 31.53±1.56*△△俄色叶低剂量 0.13 21.00±1.39 21.18±1.12△△ 26.08±1.82△ 28.35±1.17*△△ 30.08±1.06*△△俄色叶中剂量 0.26 20.86±1.53 20.90±1.29△△ 26.35±1.70*△ 29.13±1.75*△△ 31.43±2.16*△△俄色叶高剂量 0.52 20.53±1.04 20.35±0.65△△ 26.98±1.88* 29.15±1.91*△ 31.90±1.89*△组别剂量/[mg/(kg·d)]
表1结果表明,造模后,除空白组外,其余各组小鼠体重均增长缓慢,与空白组相比,有极显著性差异(P<0.01)。灌胃给药后,俄色叶水提物各剂量组和阳性对照组体重增加较为明显,与模型组比较,均呈现显著性差异(P<0.05)。但给药组体重仍低于空白组,与之对比,有统计学意义(P<0.05或 0.01)。
说明俄色叶水提物可明显改善糖尿病小鼠症状,体重增加明显,且呈现一定的量效关系。
2.2 俄色叶水提物对糖尿病小鼠空腹血糖的影响
俄色叶水提物对糖尿病小鼠空腹血糖的影响结果见表2。
由表2可知,灌胃给药后,与模型组比较,俄色叶水提物低、中、高剂量组及阳性对照组的血糖值均呈现下降趋势,有显著性差异(P<0.05或0.01);与空白组比较,未降低至正常水平,且差异显著(P<0.05或0.01)。说明俄色叶水提物对糖尿病小鼠具有降低血糖作用。
2.3 俄色叶水提物对糖尿病模型小鼠口服糖耐受量的影响
俄色叶水提物对糖尿病模型小鼠口服糖耐受量的影响结果见表3。
表2 俄色叶水提物对糖尿病模型小鼠空腹血糖的影响(±s,n=10)Table 2 Effect of water-extraction from Malus toringoides leaves on fasting plasma glucose of diabetic mice(±s,n=10)

表2 俄色叶水提物对糖尿病模型小鼠空腹血糖的影响(±s,n=10)Table 2 Effect of water-extraction from Malus toringoides leaves on fasting plasma glucose of diabetic mice(±s,n=10)
注:与模型组比较,*P<0.05 显著,**P<0.01 极显著;与空白组比较,△P<0.05 显著,△△P<0.01极显著。
组别剂量/[mg/(kg·d)]血糖水平/(mmol/L)造模前 给药0 d 给药7 d 给药14 d 给药21 d空白组 7.75±1.22 7.96±1.18** 7.80±1.35** 7.90±1.36** 7.78±1.28**模型组 7.81±1.19 22.85±7.13△△ 23.94±3.79△△ 24.67±5.47△△ 24.01±4.51△△阳性对照组 0.26 7.91±1.26 20.43±6.36△△ 14.26±5.73**△△ 13.43±5.97**△ 11.88±4.79**△俄色叶低剂量 0.13 7.66±1.37 19.45±6.63△△ 18.32±6.96△△ 16.70±7.49*△△ 14.55±3.45*△△俄色叶中剂量 0.26 7.72±1.32 19.73±6.20△△ 16.87±6.27*△△ 15.02±5.89**△△ 12.90±2.44**△△俄色叶高剂量 0.52 7.82±1.28 21.06±7.16△△ 15.39±4.89**△△ 14.33±4.81**△△ 11.73±1.25**△△
表3 俄色叶水提物对糖尿病模型小鼠口服糖耐受量的影响(±s,n=10)Table 3 Effect of water-extraction from Malus toringoides leaves on glucose tolerance test of diabetic mice(±s,n=10)
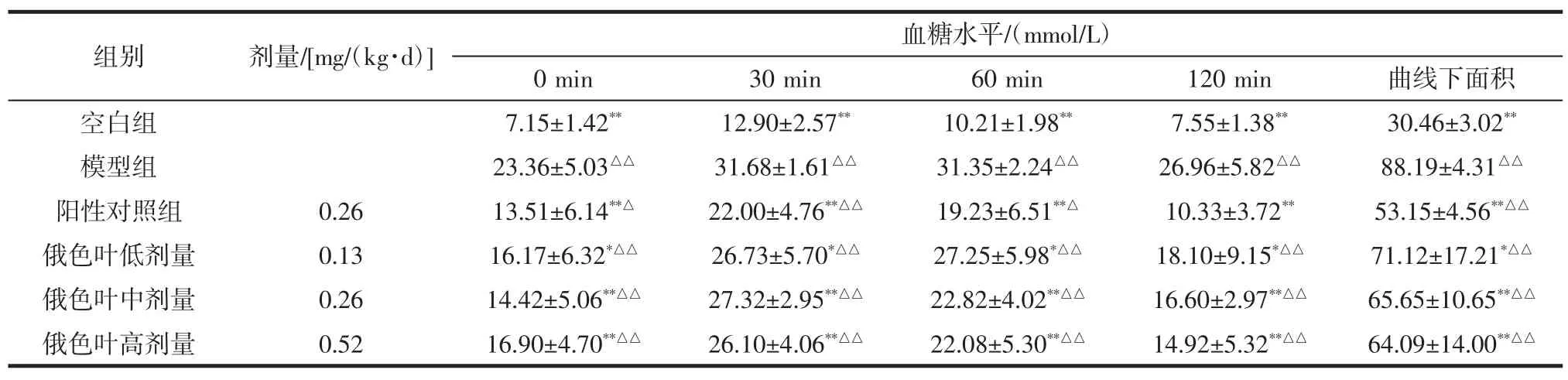
表3 俄色叶水提物对糖尿病模型小鼠口服糖耐受量的影响(±s,n=10)Table 3 Effect of water-extraction from Malus toringoides leaves on glucose tolerance test of diabetic mice(±s,n=10)
注:与模型组比较,*P<0.05 显著,**P<0.01 极显著;与空白组比较,△P<0.05 显著,△△P<0.01极显著。
组别剂量/[mg/(kg·d)]血糖水平/(mmol/L)0 min 30 min 60 min 120 min 曲线下面积空白组 7.15±1.42** 12.90±2.57** 10.21±1.98** 7.55±1.38** 30.46±3.02**模型组 23.36±5.03△△ 31.68±1.61△△ 31.35±2.24△△ 26.96±5.82△△ 88.19±4.31△△阳性对照组 0.26 13.51±6.14**△ 22.00±4.76**△△ 19.23±6.51**△ 10.33±3.72** 53.15±4.56**△△俄色叶低剂量 0.13 16.17±6.32*△△ 26.73±5.70*△△ 27.25±5.98*△△ 18.10±9.15*△△ 71.12±17.21*△△俄色叶中剂量 0.26 14.42±5.06**△△ 27.32±2.95**△△ 22.82±4.02**△△ 16.60±2.97**△△ 65.65±10.65**△△俄色叶高剂量 0.52 16.90±4.70**△△ 26.10±4.06**△△ 22.08±5.30**△△ 14.92±5.32**△△ 64.09±14.00**△△
由表3可知,给予葡萄糖溶液后,各组血糖水平均有明显上升,其中,30 min时,俄色叶水提物中、高剂量组血糖处于最高水平,而后血糖水平均有所下降;其中,俄色叶3个剂量组血糖水平均低于模型组,曲线下面积也小于模型组,均呈现显著性差异(P<0.05或0.01),但仍极显著高于空白组(P<0.01)。说明俄色叶水提物可有效改善糖尿病小鼠的糖耐量。
2.4 俄色叶水提物对糖尿病模型小鼠血清SOD、NO、ALT、AST的影响
俄色叶水提物对糖尿病模型小鼠血清SOD、NO、ALT、AST的影响结果见表4。
表4 俄色叶水提物对糖尿病模型小鼠血清SOD、NO、ALT、AST的影响(±s,n=10)Table 4 Effect of water-extraction from Malus toringoides leaves on SOD,NO.ALT,AST in serum of diabetic mice(±s,n=10)
注:与模型组比较,*P<0.05 显著,**P<0.01 极显著;与空白组比较,△P<0.05 显著,△△P<0.01极显著。
组别剂量/[mg/(kg·d)]血清SOD/(U/mL)血清NO/(μmol/L)血清ALT/(U/gprot)血清AST/(U/gprot)空白组 79.05±7.77** 60.63±9.23** 31.90±5.85 39.14±5.06模型组 47.29±4.45△△ 113.08±7.83△△ 32.17±7.45 39.71±3.14阳性对照组 0.26 62.00±6.07**△ 60.21±8.32** 33.05±6.77 38.04±6.49俄色叶低剂量 0.13 59.91±4.82**△△ 81.86±6.97**△△ 34.36±5.31 40.28±5.78俄色叶中剂量 0.26 63.09±3.78**△ 76.84±4.68**△△ 33.28±6.69 37.28±6.14俄色叶高剂量 0.52 70.12±9.19** 64.02±4.03**△ 32.81±4.87 36.89±9.16
由表4可见,俄色叶水提物各剂量组及阳性对照组的SOD活性升高明显,而NO含量显著下降,与模型组比较,有统计学意义(P<0.01),与空白组比较,未完全恢复至正常水平(P<0.05或0.01)。ALT、AST结果显示,各组两个指标均未出现显著性差异。说明俄色叶水提物可提高SOD活性,降低NO含量,且对肝功无影响。
2.5 俄色叶水提物对糖尿病模型小鼠肝脏MDA、GSH-Px、TG、TC 的影响
俄色叶水提物对糖尿病模型小鼠肝脏MDA、GSH-Px、TG、TC 的影响见表 5。
表5 俄色叶水提物对糖尿病模型小鼠肝脏MDA、GSH-Px、TG、TC的影响(±s,n=10)Table 5 Effect of water-extraction from Malus toringoides leaves on MDA,GSH-Px,TG,TC in liver of diabetic mice(±s,n=10)
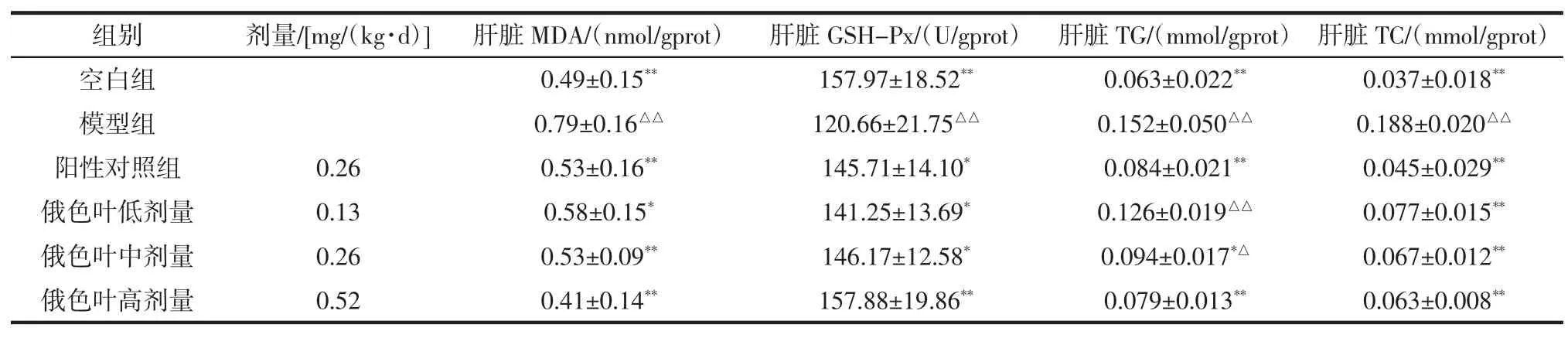
表5 俄色叶水提物对糖尿病模型小鼠肝脏MDA、GSH-Px、TG、TC的影响(±s,n=10)Table 5 Effect of water-extraction from Malus toringoides leaves on MDA,GSH-Px,TG,TC in liver of diabetic mice(±s,n=10)
注:与模型组比较,*P<0.05 显著,**P<0.01极显著;与空白组比较,△P<0.05显著,△△P<0.01 极显著。
组别剂量/[mg/(kg·d)]肝脏MDA/(nmol/gprot)肝脏GSH-Px/(U/gprot)肝脏TG/(mmol/gprot)肝脏TC/(mmol/gprot)空白组 0.49±0.15** 157.97±18.52** 0.063±0.022** 0.037±0.018**模型组 0.79±0.16△△ 120.66±21.75△△ 0.152±0.050△△ 0.188±0.020△△阳性对照组 0.26 0.53±0.16** 145.71±14.10* 0.084±0.021** 0.045±0.029**俄色叶低剂量 0.13 0.58±0.15* 141.25±13.69* 0.126±0.019△△ 0.077±0.015**俄色叶中剂量 0.26 0.53±0.09** 146.17±12.58* 0.094±0.017*△ 0.067±0.012**俄色叶高剂量 0.52 0.41±0.14** 157.88±19.86** 0.079±0.013** 0.063±0.008**
表5结果可知,与模型组比较,俄色叶水提物各剂量组及阳性对照组的MDA、TG、TC含量均显著降低,有统计学意义(P<0.05或0.01),除TG外,其余两个指标均接近空白组。而GSH-Px测定结果显示,俄色叶水提物各剂量组及阳性对照组含量明显升高,与模型组比较,有显著性差异(P<0.05或0.01),且与空白组无显著性差异。说明俄色叶水提取物可提高GSH-Px,降低MDA、TG、TC等指标水平。
3 结论与讨论
糖尿病(diabetes mellitus,DM)是一组以高血糖为特征的慢性非传染性代谢性疾病,主要与遗传及生活习惯等因素相关。糖尿病发病率高、病程较长,易诱发冠心病、动脉粥样硬化及多器官功能衰竭等并发症[15-16]。随着生活水平的提高,饮食结构的改变,糖尿病已成为高发疾病,严重威胁着人类健康。血糖控制不佳的糖尿病晚期患者常伴有多器官的并发症,是导致糖尿病患者死亡的主要原因。研究表明氧化应激及其所诱发的脂质过氧化是糖尿病发展并加重的主要因素[17-18]。此外,糖尿病患者往往伴发高血脂症,极易引起血液黏稠度增高和动脉粥样硬化,进而诱发各种血管病变,也是导致并发症发生的关键因素之一[19-21]。肝组织作为机体调节血脂的重要器官,对氧化应激反应十分敏感。因此,糖尿病患者除了很好地控制血糖外,还应抑制自由基损伤、调节血脂并保护肝功能。
氧化应激反应会加剧糖尿病病情的发展,并进一步导致相应并发症的发生。研究表明,过高的氧化应激压力会使细胞膜上生成大量有高度毒性作用的脂质过氧化物MDA,并对胰腺β细胞的功能造成不同程度的损伤,加剧胰岛组织的破坏[22-23]。另一方面,内源性抗氧化物酶体系对患者机体又可起到保护作用,例如,SOD和GSH-Px可以通过清除体内过多的自由基,来降低有毒有害自由基在机体内的堆积,防止产生的氧化应激反应对机体组织所造成的损伤,从而防止糖尿病并发症的发展[24-25]。此外,NO对于糖尿病胰岛素抵抗和胰腺β细胞功能障碍的发生发展,也可发挥重要作用,其会导致胰岛β细胞凋亡,减少胰岛素的分泌[26]。因此,增加 SOD、GSH-Px含量,并抑制 MDA、NO在体内的生成,可起到预防和治疗糖尿病的作用。此外,糖尿病患者多有血脂升高的症状,而TG、TC含量可反映机体内血脂水平,有效控制二者含量,能够防止糖尿病及并发症的恶化,故降低二者水平可反应药物对糖尿病的治疗效果[27-28]。以上氧化应激指标和血脂指标的改善均能说明药物对糖尿病模型的治疗作用。
本论文研究显示,俄色叶水提物可有效恢复糖尿病小鼠体重增长,降低血糖水平,提高糖耐受量,且呈现一定的剂量关系,还可提高SOD、GSH-Px活性,降低 NO、MDA、TG、TC 含量,对 AST、ALT 等指标无影响。说明俄色叶水提物对糖尿病模型小鼠有降血糖作用,其作用与抗氧化应激反应有关,且对肝功无影响。
本研究样品采用常规茶饮方式制备所得,降血糖效果良好且剂量较低,说明俄色叶作为日常茶饮,具有辅助糖尿病患者降血糖的潜力,可为下一步俄色叶资源的开发与利用提供试验依据及广阔前景。
