AEG-1肺归巢域与Flagellin融合基因的杆状病毒制备及鉴定
2018-10-31张惠中
王 希,王 琳,张 喆,龙 敏,董 轲,张惠中
(第四军医大学唐都医院 临床实验与检验科,陕西 西安710038)
近年来,以肿瘤特异靶抗原为基础的病毒样颗粒(Virus like particles,VLPs)疫苗研发越来越受重视[1-3],此类疫苗因携带病毒抗原成分,可模拟病毒抗原呈递过程,故可以高效激发机体内的免疫应答反应,活化CD4+及CD8+细胞,突破肿瘤微环境中免疫耐受,发挥抗肿瘤作用[4]。
星形细胞上调基因-1(Astrocyte elevated gene-1,AEG-1)[1]与肿瘤的发生、发展、预后密切相关,在多种恶性肿瘤组织中均高表达[5,6],而在正常组织中表达非常低、甚至不表达,因此作为一种新的肿瘤免疫治疗候选靶点备受瞩目。Rown和Ruoslahti[7]发现,AEG-1蛋白C端的肺归巢蛋白结构域(Lung Homing Domain,LHD)能够介导肿瘤细胞粘附到远处器官的血管并促进肿瘤转移,具有多种重要细胞生物学功能。因此,以AEG-1的C末端肽段制备肿瘤疫苗理论上可在体液和细胞免疫双重作用下发挥抑瘤作用。
本研究拟采用重叠PCR的方法构建AEG1 LHD区与flagellin(C)蛋白的融合基因,在其N端和C端分别添加SIV gag env gp41的信号肽(SP)与跨膜区(TM)构建融合表达蛋白AEG-1C-Flic,并通过杆状病毒表达系统制备其杆状病毒,以期通过逆转录病毒gag产生VLPs 的特点,增加AEG-1C-Flic VLPs的组装效率,为后期获得高产量的AEG-1C-Flic VLPs奠定基础。
1 材料与方法
1.1材料
1.1.1质粒、菌株及细胞株 质粒: 含有SIV env 的质粒pCAGGS/gp41由美国EMORY大学ChingLai Yang教授馈赠;含有AEG-1全长基因的克隆载体AEG1-TV、真核表达载体pCAGGs及杆状病毒表达载体pFastbacTM、昆虫细胞Tn5、鼠伤寒沙门菌、E.coliJM109、E.coliDH5a和E.coliDH10bac均由本室保存。
1.1.2主要试剂、仪器 昆虫细胞培养液SF-900Ⅱ、转染试剂CellfectinⅡ、Grace’s Insect Medium、Lipofectamine2000购自Thermo Fisher Scientific公司,分子克隆载体及相关辅助试剂,Prime STAR HS DNA Polymerase、T4 DNA Ligase、限制性内切酶BamHI、EcoRI及XhoI及抗菌药物均购自于宝生物工程有限公司(大连Takara公司),QSM-O3SP/50蛋白质浓缩仪购自美国通用公司,Hitachi-H7500透射电镜由唐都医院疼痛生物研究所提供。
1.2方法
1.2.1鼠伤寒沙门杆菌Flagellin(C) PCR引物合成 根据 Genbank(D13689.1)中发布的鼠伤寒沙门菌鞭毛蛋白的基因序列,设计Flagellin (C)PCR引物。引物序列为:F1:5’-CCC GGATCC ATG GGCACAAGTCATTAATACAA-3’ (引入BamH1酶切位点);F2:5’-CCC GAATTC TTAACGCAGTAAAGAGAGGACGTTTT-3’ (引入EcoRI酶切位点)。引物由北京奥科鼎盛生物科技公司合成。
1.2.2目的基因的PCR扩增 利用OMEGA公司的细菌基因组提取试剂盒从新鲜的沙门氏菌菌液中提取沙门氏菌基因组,菌体DNA提取纯化后进行 PCR扩增Flagellin (C)基因片段,程序为:94℃ 5 min;94℃30 s,60℃ 30 s,72℃ 90 s,共30个循环;72℃延伸 10 min。PCR反应完成后1%琼脂糖凝胶电泳鉴定目的条带。
1.2.3重组质粒pMD18-T-FliC的构建 回收目的片段后,回收产物与克隆载体PMD18-T连接,连接产物转化感受态细胞E.coli JM109,于Amp+的LB培养板上37℃过夜培养。随机挑取单克隆菌落,提取质粒DNA、酶切鉴定。对酶切鉴定正确的重组载体测序,测序正确的重组DNA载体命名为Tv/FliC。
1.2.4AEG1-LHD-flagellin融合基因引物设计 含有信号肽与跨膜区的AEG1-LHD-flagellin融合基因采用重叠PCR的方法制备,根据Genebank中AEG1与flagellin序列,设计重叠PCR引物如下:P1: 5’-CCC GAATTCAT GCGCGTGAAAGGCATTCG-3’(引入EcoRI酶切位点);P2: 5’-AACCTGAAGTGTGGCGGAGCAAAT-3’;P3: 5’-ATTTGCTCCGCCACACTTCAGGTT-3’;P4:5’-TTAATGAC-TTGTGCAGCTATTTCTT-3’;P5: 5’-AAGAAAGAGCTGCACAAGTCATTAA-3’;P6: 5’-AATCATGATGAAACGCAGTAAAGAGAG-3’;P7:5’-CT CTCTTTACTGCGCTCTTTACTGCGTT-TCATCATGATT-3’;P8: 5’-CCC CTCGAG TTACAGCAGGGCGCGCTCGAAG-3’ (引入XhoI酶切位点)。
1.2.5含有信号肽与跨膜区的AEG1-LHD-flagellin融合基因扩增 P1、P2为引物,质粒pCAGGS/gp41为模板,扩增获得片段A; 以质粒AEG1-TV为模板,P3、P4为引物PCR扩增获得片段B;再以A、B为共同模板,P1、P4为引物PCR扩增获得片段C; Flagellin-TV质粒为模板,P5、P6为引物扩增获得D;再以C、D为共同模板,P1、P6为引物PCR扩增获得产物E;以质粒pCAGGS/gp41为模板,P7、P8为引物,PCR扩增获得产物片段F;以E、F为共同模板,P1、P8为引物PCR扩增,最终获得含有信号肽与跨膜区的AEG1-LHD-flagellin融合基因,命名为AEG-1C-Flic。
1.2.6重组AEG-1C- Flic杆状病毒pFastbacTM表达载体的构建 回收并纯化经EcoRI/Xho I双酶切的PCR片段AEG-1C- Flic及pFastbacTM载体,T4 DNA连接酶4℃连接过夜。连接产物转化感受态细胞E.coli DH5α,涂布LB/Amp +培养板。随机挑取单克隆菌落过夜培养后提取质粒DNA, EcoRI/Xho I双酶切鉴定并测序, 得到含gp41信号肽和跨膜区的AEG-1C- Flic融合基因的pFastbacTM载体,命名为pF/AEG-1C- Flic。
1.2.7重组质粒pF/AEG-1C- Flic转座 1 μl pF/AEG-1C- Flic加入到100 μl E.coli DH10Bac感受态细胞中,冰浴30 min后42℃热激45 s,加入900 μl LB 培养基,37℃ 220 rpm/min培养4 h,菌液稀释后涂布于含50 g/ml卡那霉素、7 g/ml庆大霉、10 g/ml四环素、100 g/ml X-gal、40 g/ml IPTG的筛选培养板37℃培养,直至白色菌落清晰可见。
1.2.8AEG-1C- Flic Bacmid鉴定 随机挑取阳性白色单克隆菌落,同时挑取蓝色克隆作为阴性对照,过夜培养后按照PureLinkTM Hipure Plasmid Miniprep Kit说明书提取杆粒DNA(Bacmid),PCR鉴定。鉴定引物按照说明书合成,序列为F:5’-CCCAGTCACGACGTTGTAAAACG-3’;R:5’-AGCGGATAATTTCACACAGG-3’。 反应程序:94℃、5 min;94℃、45 s,55℃、45 s,72℃、5 min,30cycles;72℃ 10 min。扩增产物经0.8% 琼脂糖凝胶电泳鉴定。
1.2.9重组杆粒转染细胞 6孔板中接种5×105个Tn5细胞,待细胞贴壁后混合10 μl转染试剂与1μg Bacmid,按照CellfectinII Reagent说明书转染(Invitrogen)。转染后6h,换成Sf-900II SFM培养基。待细胞出现病变后收集细胞培养上清,命名为AEG-1C- Flic rBv P1。
1.2.10AEG-1C- Flic rBv的扩增及鉴定 将上述收集的P1代病毒上清8 000 rpm/min,4℃离心30 min,取病毒上清液,感染Tn5细胞,2-3 d后,至90%以上转染细胞出现病变现象,收集细胞悬液4℃、8 000 rpm离心20 min,取上清,培养液中含有第2代病毒,命名为P2;FastplaxTM病毒滴度测定试剂盒测定病毒滴度。并用Western Blot检测AEG-1C-Flic rBv P2。一抗、二抗分别为为AEG-1单克隆抗体(Sino Biological公司)和山羊抗小鼠IgG。
2 结果
2.1细菌鞭毛蛋白Flagellin基因的克隆及鉴定
从鼠伤寒沙门杆菌基因组DNA中常规PCR扩增,扩增产物经1%琼脂糖凝胶电泳,结果可见1条特异性条带(图1),与预期值相符,约为1 488 bp。克隆入T载体,提取重组质粒并进行BamHI/XhoI双酶切,1%琼脂糖电泳后出现2条带,分别与pMD-18T载体和fliC基因片段大小相符(图2),DNA测序结果经比对后确定其开放读码框架正确,提示重组质粒构建成功。
2.2AEG1-C-FliC目的片段的扩增及其杆状病毒表达载体的构建及鉴定
AEG1-C-FliC融合基因模式图如图3所示,经重叠PCR获得2 517 bp的AEG-1C-FliC目的片段(图4),克隆入pFastBacTM载体,经EcoRI/XhoI双酶切鉴定,大小正确(图5),测序结果与AEG1肺归巢域及FliC基因序列完全一致,且含有gp41的信号肽及跨膜区。

图1 Flagellin (C)PCR扩增产物的琼脂糖凝胶电泳分析

图2 重组质粒 pMD18-T-Flagellin(C) 的双酶切鉴定

图3AEG-1C-FliC融合基因结构示意图
2.3AEG-1C-FlicBacmid制备及鉴定
Pf/AEG-1C- Flic质粒转化感受态细胞E.coli DH10Bac,经蓝白筛选获得白色阳性克隆。挑取阳性克隆过夜培养并提取Bacmid,鉴定结果显示PCR获得约4 817 bp大小的片段(2 300 bp载体片段+2 517 bp目的基因片段),与预期相符(图6),同时设有阴性对照与阳性对照(本室构建),PCR结果显示阴性对照条带为300 bp大小片段。

图4 AEG-1C-FliC融合基因 扩增产物的琼脂糖凝胶电泳分析
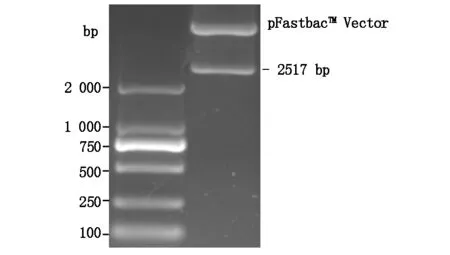
图5 重组质粒 PF/AEG-1C-FliC的双酶切鉴定

1.DL5000 Marker 2.阳性克隆Bacmid #1 3.阳性克隆Bacmid #2 4.阴性克隆 5.本室阳性对照Bacmid
图6重组BacmidPCR鉴定
2.4AEG1-C-Flic杆状病毒制备及鉴定
AEG-1C- Flic Bacmid转染Tn5细胞5天后显微镜下观察,图7显示与阴性对照细胞相比,转染后的Tn5胞浆内出现丝状或颗粒样物质,细胞肿胀,折光性增强,收集细胞培养液即为P1代病毒。P1代病毒扩增后获得P2代病毒,FastplaxTM病毒滴度测定试剂盒测定病毒滴度达到 5×(107-108) pfu/ml之间。取P2代病毒上清进行Western Blot检测,结果显示(图8)在90 kDa处有目的条带,预期目的条带大小一致。

图7 Bacmid转染昆虫细胞后 5天

1.蛋白Marker 2.AEG-1C-Flic rBv 感染Tn5细胞后培养上清 3.未感染细胞培养上清
图8WesternBlot方法检测P2代病毒上清结果
3 讨论
随着人们对肿瘤免疫机制的进一步认识,以肿瘤特异靶抗原为基础的肿瘤疫苗研发越来越受重视。单跨膜蛋白AEG-1与多种恶性肿瘤的发生、发展密切相关,因此AEG-1作为肿瘤疫苗抗原具有特异性高,广谱性好等优点,有望成为一种应用前景非常好的新肿瘤免疫治疗候选靶点。相关研究制备AEG-1核酸疫苗[8,9],小鼠体内试验证实该疫苗可显著刺激机体产生细胞免疫反应,抑制肿瘤细胞生长,说明AEG-1作为肿瘤疫苗靶点具有可行性,但DNA疫苗在患者中具有较低的接受程度,探索免疫原性强的AEG-1疫苗制备新策略仍具有较大意义。
病毒样颗粒(VLPs)是利用病毒的结构蛋白可在细胞内自行装配成一个不含核酸成份的病毒粒子的特性开发而成的一种新型疫苗研发技术平台。目前常用的病毒结构蛋白有HBVs,HPV[10],SIV gag蛋白,HIV gag蛋白,Ebola病毒VP40蛋白[11]等。gag基因编码的蛋白可被蛋白水解酶裂解成能够自我装配成核心颗粒的基质(MA)、衣壳(CA)及核衣壳(NC)[12]三个结构蛋白,此3个结构蛋白以出芽方式分泌到胞外时可获得包膜及膜蛋白。
近年来,抗肿瘤VLPs疫苗的研发突飞猛进并取得了巨大成功。随着人们对肿瘤免疫认识的进一步深入,以肿瘤特异靶抗原为基础的治疗性VLPs疫苗研发越来越受到人们重视,已有多种肿瘤特异性靶抗原用于VLPs疫苗研究,展现了较好的应用前景。肿瘤特异性抗原VLP的制备策略中合理选择病毒结构蛋白为首要问题。
逆转录病毒的结构蛋白gag可在真核细胞中自行装配成病毒样颗粒,在VLPs组装过程中gag蛋白的三种结构域各自发挥不同功能,以出芽形式形成VLPs过程中获得包膜及膜蛋白。研究表明,可以利用gag的此特性将外源性的跨膜蛋白锚定在gag的包膜上获得VLPs。
在疫苗的研发过程中,通过添加免疫佐剂的方式增加免疫原性已被广泛应用。细菌鞭毛由基础小体、钩状体和丝状体三个部分组成,鞭毛蛋白(Flagellin)是细菌鞭毛丝状体的主要结构蛋白,可以被Toll样受体-5(TLR5)识别并激发机体固有免疫应答,通过活化NF-κB信号转导通路,包括IL-1β、IL-8、TNF-α等促炎细胞因子及各种适应性免疫应答效应因子的转录活化,促进机体免疫应答的激活[13-15],且使用较低剂量(1-10 μg)的Flagellin即可诱导机体产生较强的免疫应答效果[16,17]。研究表明,引入Flagellin作为流感病毒疫苗的免疫佐剂制备嵌合型病毒样颗粒(Virus like particles,VLPs)疫苗可增强机体免疫应答[18],其作为肿瘤疫苗佐剂虽有报道[19,20],但用于肿瘤特异性抗原VLPs疫苗的研究目前未见报道。
本研究首先从鼠伤寒沙门杆菌基因组DNA中扩增出鞭毛蛋白Flagellin并构建其克隆载体,结合AEG-1肺归巢域的特点,以及gag蛋白组装形成完整的病毒样颗粒的优势,利用重叠PCR的方法构建带有SIV env gp41的信号肽区域和跨膜区的AEG-1 C端与Flagellin的融合基因,成功构建了AEG-1 C-Flic融合表达载体。利用Bac-to-Bac杆状病毒表达系统,将构建的AEG-1C-Flic重组质粒转化E.coliDH10Bac大肠杆菌感受态细胞,通过转座获得重组杆粒Bacmid,将其转染粉纹夜蛾细胞后,产生重组杆状病毒。在后续实验中,我们拟将AEG-1C-Flic rBv与SIV gag rBv共感染制备VLPs,并进一步通过动物实验评价该疫苗激发机体产生体液免疫及细胞免疫应答水平,分析其抑瘤作用, 期望最终研发出组装效率高、免疫原性强的AEG-1C-Flic 嵌合VLPs 疫苗,并为其它肿瘤抗原疫苗的设计提供一个全新思路和方法。
致谢感谢第四军医大学唐都医院临床实验与检验科实验室的老师和同事在课题开展中给予的技术指导和支持。
