稳态强磁场的细胞生物学效应∗
2018-10-29田小飞张欣
田小飞 张欣
1)(中国科学院合肥物质科学研究院,强磁场科学中心,合肥 230031)
2)(中国科学技术大学,合肥 230036)
(2018年3月2日收到;2018年4月8日收到修改稿)
随着科学技术的发展以及稳态强磁场在医疗诊断中的广泛应用,人们接触到1 T以上稳态强磁场的机会越来越多,稳态强磁场对人体健康的潜在影响也备受关注.虽然目前由于实验条件的限制,稳态强磁场对动物以及人体的研究报道依然有限,但是细胞作为生物体的基本单位,其研究相对较多.然而由于实验中磁场参数、细胞类型等各种因素的不同,使得稳态强磁场对细胞的影响在不同的研究中存在着差异.因此,本文不仅总结和分析了国内外1 T以上稳态强磁场细胞生物学效应的相关研究,包括细胞取向、增殖、微管和纺锤体等,而且对现有研究结果进行比较和概括,并对可能造成实验差异的因素进行分析,例如磁场强度和细胞类型等,从而为下一步研究稳态强磁场下的细胞生物学效应提供基础和依据.
1 引 言
根据磁场强度和方向与时间的变化关系,磁场可以分为稳态磁场和动态磁场.稳态磁场是指磁场强度和方向不随时间变化的磁场,例如众所周知的较微弱的地磁场以及永磁铁周围所产生的不均匀磁场[1];而磁场强度和方向随时间变化的磁场被称为动态磁场,例如生活中50 Hz输电线产生的低频交变磁场和手机等产生的射频磁场等.其中,根据磁感应强度的不同,稳态磁场又可以进行进一步地划分,并且在不同领域中的具体划分有所不同.例如,在物理领域,一般10 T及其以上的磁场才被称为强磁场,而在生物医学领域,1 T及其以上的磁场就可以被称为强磁场.对于生物医学领域,磁场根据其强度可以分为弱磁场(小于1 mT)、中等磁场(1 mT—1 T)、强(高)磁场(1—20 T)和超强(高)磁场(20 T及以上).目前,医院内普遍使用的核磁共振扫描仪(MRI)的主体部分产生的磁场强度一般在0.5—3.0 T之间,我国医院内的MRI一般是1.5 T或者3.0 T.与此同时,7.0 T的高场MRI已经被批准使用于临床,而9.4 T的MRI也已经进入临床前实验阶段[2−4].由于磁场强度的升高可以提高成像分辨率和信噪比,因此人们在不断地提高MRI的磁场强度.最近的一篇综述总结了近几年来人们建造并应用于动物研究的高达14—20 T的MRI[5].
为了对大众日益关注的磁场安全问题提供理论和实验依据,以及进一步探索磁场在生物医学中的潜在应用,进行稳态强磁场下的细胞生物学效应研究十分必要.现有的实验数据显示,稳态强磁场不仅可以改变细胞的取向,影响细胞的形态,并且对细胞的增殖、凋亡、有丝分裂等细胞行为均有不同程度的影响,然而由于磁场强度、曝磁时间、细胞类型和细胞密度等实验条件的不同,稳态强磁场对细胞行为的影响往往存在一定程度的差异.因此,本文旨在总结国内外该领域的相关研究进展,对1 T及其以上的稳态强磁场的细胞生物学效应进行概括,并对造成实验结果差异性的可能因素进行分析,以期为今后稳态强磁场下的细胞生物学研究提供基础和借鉴.
2 稳态强磁场的细胞生物学效应
相对于动态磁场而言,稳态磁场较少的可变参数使其成为科学研究的重要工具.随着科学技术的进步和需求,稳态强磁场(以下简称“强磁场”)应运而生,而探索强磁场下的细胞生物学效应也引起了研究者日益增多的关注.从细胞分子水平看,细胞内的很多内容物和生物大分子均能够响应强磁场,例如早在1978年和1979年的两篇《PNAS》文章中,Worcester[6]和Pauling[7]就提出了肽键本身,以及由肽键构成的特定规律性结构(例如α螺旋等)赋予了蛋白质的抗磁各向异性,如图1(a)—(c)所示;而由组织结构良好的微管蛋白构成的微管也表现出较强的抗磁各向异性,如图1(d)所示[8,9].最近,Zablotskii等[10]又从理论水平上计算分析了高梯度磁场(空间上不均匀的稳态磁场)对生物样品的作用,并指出不同的细胞内容物具有不同的磁化率,对于特定细胞的确切影响需要具体分析(图2).此外,从细胞整体水平看,强磁场能够不同程度地影响一些细胞的形态[11]、取向[12]、增殖[13,14]和凋亡[15,16]等.但由于强磁场对细胞的生物学影响不仅与磁场本身的强度、梯度和方向等各种参数以及细胞类型相关,并且与曝磁时间和方式等各种实验条件相关,所以目前有关强磁场对细胞影响的研究结果差异较大,结论也不统一.因此,本文从强磁场对细胞取向、形态以及增殖和凋亡等生物学效应方面讨论强磁场对细胞的影响,并从磁场参数和细胞类型等方面综合分析造成实验差异性的可能因素.
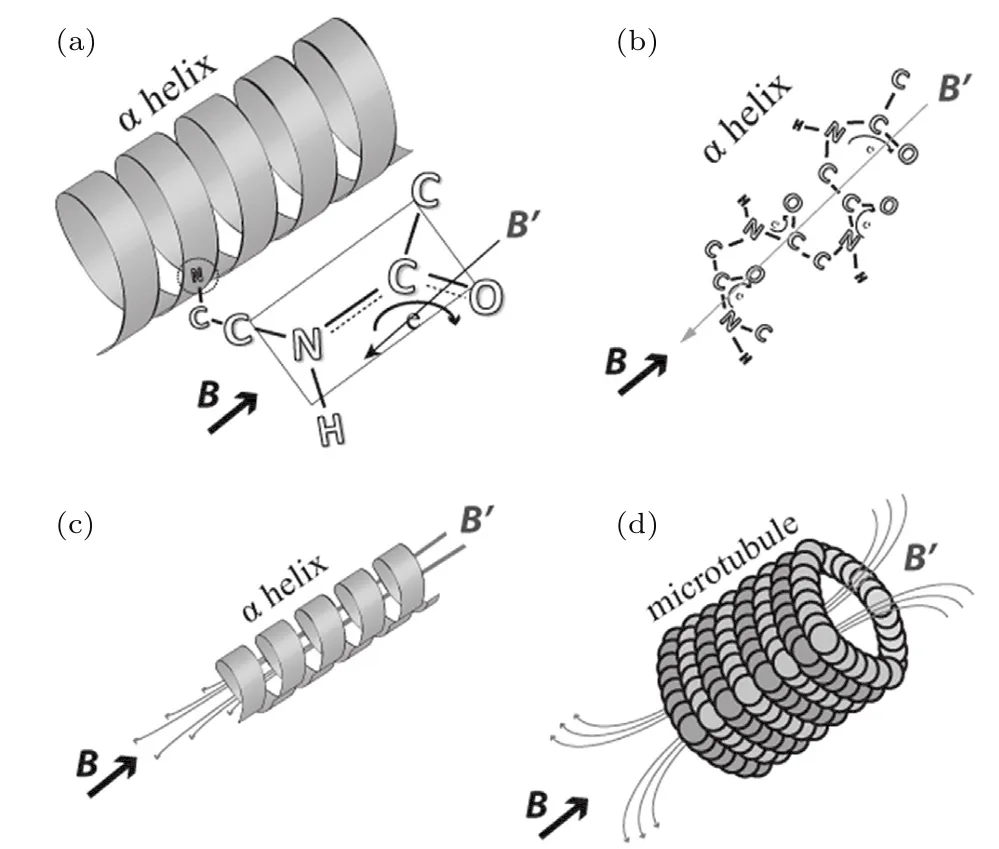
图1 生物结构中的抗磁各向异性 (a)α-螺旋中存在的平面肽键使其具有较大的抗磁各向异性;(b)和(c)显示螺旋结构产生的磁矢量(磁矩);(d)微管分子中肽键沿着α-螺旋轴向平行排列,然后被组装成环形结构,从而增加了磁各向异性的量级,即在外磁场B中产生的抗磁场B′是每个分子抗磁场的总和(图片摘自文献[9].版权©2016 Published by Elsevier Ltd)Fig.1.Diamagnetism anisotropy in biological structures:(a)Planar peptide bonds present in α-helix give it large diamagnetic anisotropy;(b)and(c)show the magnetic vector generated by the helical structures;(d)in microtubules,the parallel alignment of the peptide bonds with the α-helix axis and their assembly internally to the circular structure increase the magnitude of the magnetic anisotropy as a summation of each secondary magnetic fields B′(Figure is reprinted from Ref.[9].Copyright©2016 Published by Elsevier Ltd).
2.1 细胞取向
细胞在稳态强磁场中的取向改变是稳态强磁场细胞生物学效应中研究最多的问题之一.由于细胞内生物大分子的抗磁各向异性,往往会导致细胞平行或者垂直于磁场排列.然而对于一种特定细胞,其是否会被强磁场改变取向,如何改变取向,以及所需磁场强度等,是由多方面因素所决定,例如,细胞形状、内部组成以及外部环境等.
目前,已有多项研究发现多种细胞可以平行于外加强磁场的方向排列.例如,1993年,Higashi等[17]研究发现8 T强磁场会影响正常红细胞在磁场中的取向,使红细胞的圆盘平面平行于磁场排列(图3[18]);在随后的研究中,他们发现包括跨膜蛋白和脂质双分子层在内的细胞膜成分可能是造成红细胞在磁场中取向变化的主要原因[19],而与细胞膜结合的高铁血红蛋白的顺磁性在其中起到了重要的作用[20,21].
强磁场除了可以影响正常红细胞的排列,也会使其他一些细胞平行于磁场方向排列,如成骨细胞、平滑肌细胞和施万细胞等.例如,Kotani等[22,23]在2000年和2001年的报道表明,8 T强磁场不仅能使成骨细胞平行于磁场方向排列,而且会使成骨细胞沿着磁场的方向生长.2001年,Umeno等[12]利用8 T强磁场处理平滑肌细胞3 d,发现平滑肌细胞也会沿着磁场方向排列.2003年,Iwasaka等[11]发现14 T强磁场处理平滑肌细胞60 h后不仅使平滑肌细胞沿着磁场方向生长,而且3d后观察到细胞集落也沿着磁场方向延伸.同年,Eguchi等[24,25]发现8 T强磁场在处理施万细胞60 h后也能使其平行于磁场方向排列,并且进一步研究发现,小分子鸟苷三磷酸酶(GTPase)Rho蛋白激酶抑制剂可以抑制施万细胞在8 T强磁场中的重新排布,表明强磁场诱导施万细胞的重新排布是依赖于Rho蛋白调节肌动蛋白纤维实现的.2012年,Sakurai等[26]发现鼠源的成肌细胞C2C12暴露在6 T和10 T强磁场下6 d,细胞会沿着磁场方向分化为肌管,但是3 T的强磁场却没有此种效应,说明存在磁场强度依赖的现象.

图2 高梯度磁场(HGMFs)和胞内效应物的潜在作用示意图(图片摘自文献[10].版权©2016,Zablotskii.)Fig.2.A schematic illustration of the possible applications of high gradient magnetic fields(HGMFs)and intracellular effectors(Figure is reprinted from Ref.[10].Copyright©2016,the Authors).
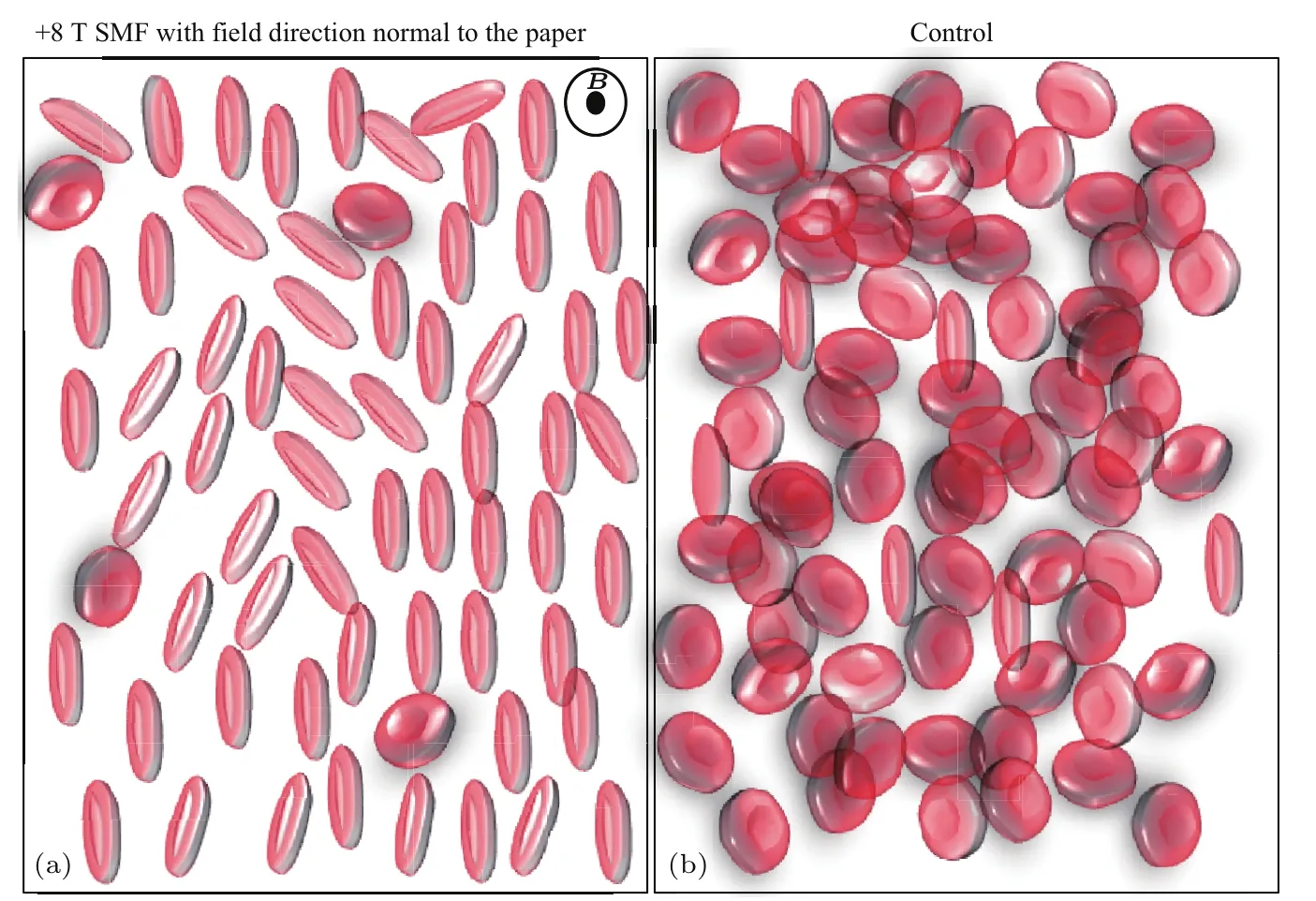
图3 红细胞被8 T稳态强磁场平行排列 (a)处于8 T稳态磁场中的红细胞,磁场方向垂直于纸面;(b)无外加磁场下的红细胞(该示意图摘自专著[18],基于文献[17]实验结果)Fig.3.Red blood cells were aligned by an 8 T SMF(static magnetic field):(a)Red blood cells in an 8 T SMF,the field direction was perpendicular to the paper;(b)red blood cells in control condition,with no SMF(Figure is reprinted from Ref.[18],which was drawn based on results from Ref.[17]).
强磁场不仅能使细胞平行于磁场方向排列,也可以使一些特定的细胞垂直于磁场排列.例如,2003年,Emura等[27]发现1.7 T的强磁场可以使整个公牛精子和精子头部均垂直于磁场方向排列.而且,在外加抗磁性胶原纤维的影响下,原本对磁场不敏感的人脑胶质瘤细胞A172细胞也可以随着胶原纤维而垂直于强磁场排列,而原本平行于磁场排列的成骨细胞也随着胶原纤维而垂直于强磁场排列[24,28].但是对于多种形状无明显各向异性的细胞,其取向并不会被强磁场影响,更多信息可参见表1以及磁场生物学效应书中的第四章[18,29].
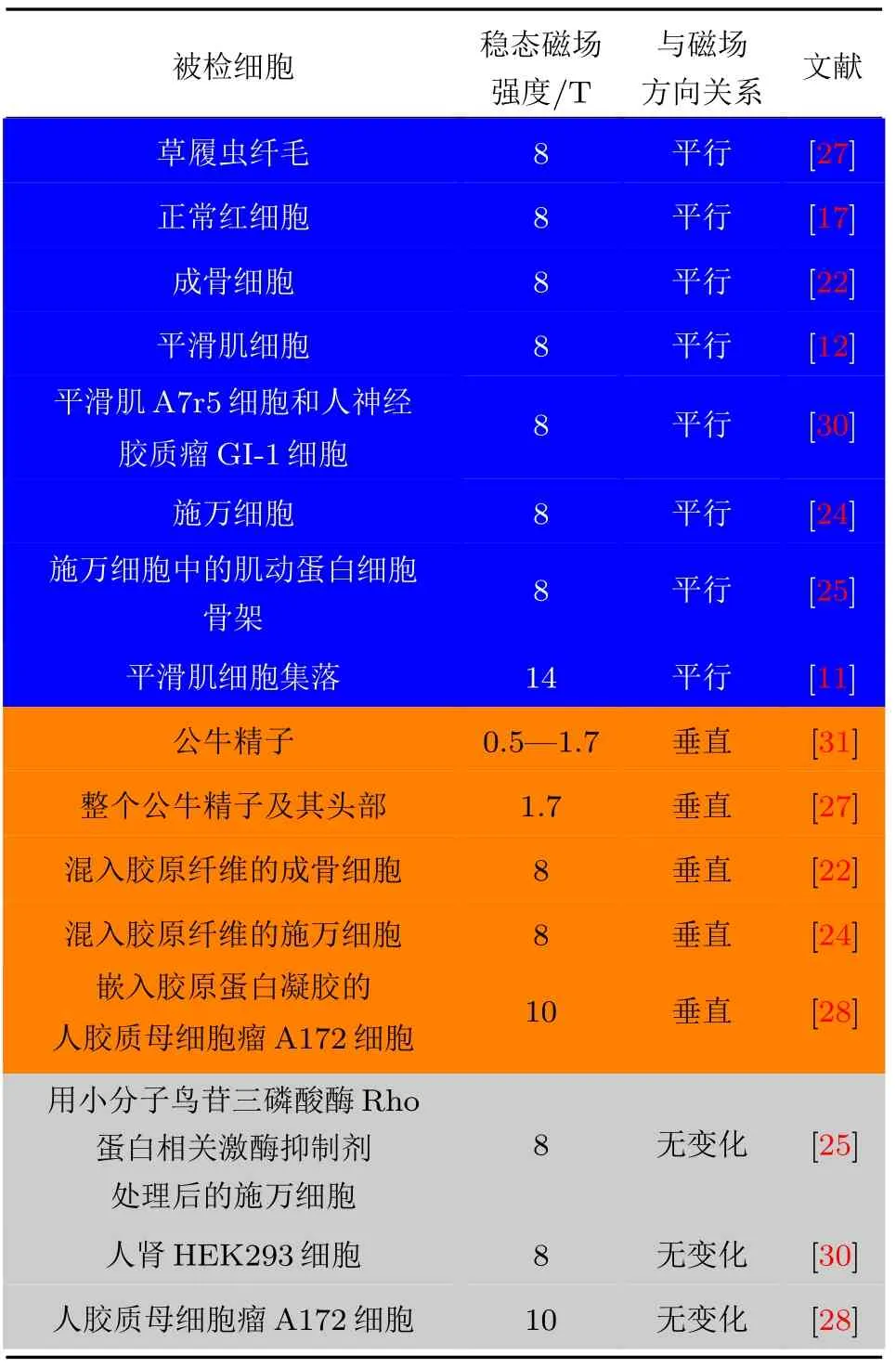
表1 不同研究中稳态强磁场导致的细胞取向变化;蓝色代表强磁场诱导细胞或组分平行于磁场方向排布;橘黄色代表强磁场诱导细胞或组分垂直于磁场方向排布;灰色代表强磁场对细胞取向无影响Table1.SMF-induced cell orientation in Different studies:blue color indicates that SMF induces cells to align along the field direction;orange color indicates that SMF induces cells to align perpendicular to the field direction.Grey color indicates that SMF does not affect cell orientation.
2.2 细胞增殖
稳态强磁场对细胞增殖的影响与磁场强度、细胞类型和细胞状态等因素密切相关.多项证据表明,强磁场对多种肿瘤细胞的增殖有抑制作用,而对非肿瘤细胞影响相对较小.除此之外,强磁场还会影响成骨、破骨和软骨细胞的增殖,以及一些神经和胚胎细胞的增殖.
不少研究表明强磁场可以抑制多种细胞的增殖.1996年,Raylman等[32]发现7 T强磁场作用64 h能减缓黑色素瘤细胞(HTB63),卵巢癌细胞(HTB77IP3)以及淋巴瘤细胞系(CCL86)的增殖.2008年,Hsieh等[15]发现3 T强磁场抑制体外培养的人软骨细胞的生长,可能与强磁场诱导凋亡蛋白P53,P21,P27以及Bax的表达有关.2015年,我们课题组发现EGFR/AKT/mTOR信号通路参与了强磁场抑制肿瘤增殖的过程[33],9 T强磁场处理CNE-2Z和HCT116肿瘤细胞可以在3 d明显抑制其增殖[13](图4);2016年,我们课题组[13]进一步研究发现强磁场直接改变EGFR激酶结构域蛋白的排列方向可能是强磁场抑制CNE-2Z和HCT116等肿瘤细胞增殖的主要原因,同年,我们发现1 T稳态磁场处理同步化的HeLa细胞3 d也能明显抑制HeLa细胞的增殖,进一步的细胞周期实验证明,强磁场导致同步化的HeLa细胞有丝分裂发生阻滞,进而减少了细胞数目[34].
然而,也有一些研究报道强磁场并不影响特定细胞的增殖.例如,Short等[35]在1992年研究发现,2.0 T和4.7 T强磁场处理人恶性黑色素瘤细胞和人正常纤维细胞24—72 h,并未影响细胞的增殖和活力.2002年,Nakahara等[36]发现10 T强磁场处理中国仓鼠卵巢细胞4 d后,也不影响其增殖.2005年,Gao等[37]将希瓦氏菌MR-1暴露在由核磁共振仪(NMR)产生的14.1 T的强磁场中12 h,发现磁场也不会影响希瓦氏菌MR-1的菌落生长.2012年,Sakurai等[26]也发现鼠源的成肌细胞C2C12暴露在3,6 T和10 T强磁场下6 d均不会影响细胞的增殖.此外,2015年,Reddig等[38]发现无论是7 T强磁场单独作用还是与不同梯度磁场联合作用均没有影响未分化的单核血细胞的增殖.最近,Iachininoto等[39]研究了1.5 T和3.0 T梯度磁场对人造血干细胞的影响,发现磁场处理72 h后,人造血干细胞增殖并没有明显的变化.由此可见,由于不同细胞之间的内部组成和性质有着巨大的差异,因此,稳态磁场对细胞增殖的影响可能与细胞的类型密切相关.

图4 人鼻咽癌细胞CNE-2Z和人结肠癌细胞HCT116的细胞增殖被稳态磁场抑制(图片摘自文献[13].开源期刊)Fig.4.Human nasopharyngeal cancer CNE-2Z and colon cancer HCT116 cell proliferation could be inhibited by SMFs(Figure is reprinted from Ref.[13].Open access).
2.3 微管和纺锤体
早在20世纪80年代,人们就发现体外纯化的微管是稳态磁场的一个作用靶点,在强磁场作用下,微管会沿着磁场方向排列[40],并在随后的几十年中被进一步证实[41,42].微管是细胞内纺锤体的基本单位,纺锤体的排列方向是决定细胞分裂方向的主要因素,也是决定胚胎发育和肿瘤发生等多种生理病理过程的关键步骤.那么细胞内的微管和纺锤体是否会和体外纯化的微管一样受磁场影响呢?其实,早在1998年,Denegre等[43]便发现了16.7 T的大梯度强磁场能够影响非洲爪蛙卵的分裂方向(图5),并且8 T强磁场也可以改变蛙胚卵裂过程的卵裂面形成[44].后来在2002年,Valles[45]从理论上推测了强磁场可能会影响微管/纺锤体的排布,并于同年进行了实验证实[46].因此,对于非洲爪蛙卵而言,强磁场可以通过改变微管的取向而改变整个细胞纺锤体以及细胞分裂的方向.
对于人体细胞而言,近年来也有一系列的研究发现,强磁场可以改变其微管和纺锤体.2005年,Valiron等[47]将人成纤维NIH-3T3细胞暴露于7—17 T强磁场中1 h发现,处于间期中的细胞内微管和微丝的排列发生了紊乱.2015年,我们课题组发现1 T磁场处理HeLa细胞7 d后,有丝分裂异常纺锤体数目和有丝分裂指数(处于有丝分裂期细胞的百分比)均增加,而且这种现象与时间有关[34].而在2017年,我们课题组发现1 T磁场处理人鼻咽癌细胞CNE-2Z和人视网膜色素上皮细胞RPE1 3 d或者27 T强磁场处理4 h,均未发现间期内细胞(非分裂状态)的微管有异常,这可能与磁场作用的时间和细胞类型有关.然而非常有趣的是,我们发现CNE-2Z和RPE1细胞分裂期内的纺锤体方向却能被27 T强磁场作用4 h后就发生改变,并且纺锤体的取向由微管和染色体共同决定[48].

图5 平行于卵轴的稳态磁场中的第三卵裂沟随磁场强度增高的变化俯视图(a),(c),(e),(g),(i)和平视图(b),(d),(f),(h),(j)展示了卵轴方向磁场中的八细胞胚胎,显示了其第三卵裂方向的变化;(k)每个胚胎中水平第三卵裂沟的平均数与磁场强度的关系(图片摘自文献[43].版权©1998,National Academy of Sciences,USA)Fig.5.Changes of the third cleavage parallelling to the egg axis with the increasing intensity of SMF.Top(a),(c),(e),(g),(i)and side(b),(d),(f),(h),(j)views of eight-cell embryos in SMF from the egg axis direction,showing the change of third cleavage orientation.(k)the average number of horizontal third cleavages per embryo as a function of field strength(Figure is reprinted from Ref.[43].Copyright©1998,National Academy of Sciences,USA).
因此,强磁场可以改变细胞内微管和纺锤体的排列方向,这可能是磁场诱导细胞分裂发生改变的根本原因,也是其导致多种细胞数目减少,以及诱导胚胎发育过程变化的主要原因之一.
2.4 强磁场的其他影响
有研究表明,稳态强磁场对细胞形状的改变具有一定的差异性.例如,1992年,Sato等[49]用1.5 T磁场处理HeLa细胞96 h,未发现细胞形态有明显变化;2003年,Iwasaka等[11]发现8 T磁场处理大鼠平滑肌细胞60 h,也不会影响平滑肌细胞的形状,然而,将大鼠的平滑肌细胞分别置于12 T和14 T的强磁场中60 h后,发现12 T和14 T强磁场不仅影响平滑肌细胞的组装形态,而且会诱导细胞集落沿着磁场方向生长.而磁场若与磁性纳米颗粒联合使用,1 T稳态磁场就能加剧细胞形态的变化.例如,2016年,Muroski等[50]和Cheng等[51]的研究发现,在无外加磁场的情况下,可旋转的圆盘状磁性粒子本身并未对神经胶质瘤U87细胞的形态产生显著性影响,但是在1 T、20 Hz极低频旋转磁场作用下,内化的磁性粒子会产生强大的机械力,从而破坏细胞膜,导致细胞形态发生改变,进而诱导细胞程序性死亡.同年,Hapuarachchige等[52]将带有磁性氧化铁纳米粒子标签的乳腺癌MDAMB-231细胞置于由9.4 T MRI产生的梯度磁场中发现,内化的磁性氧化铁纳米粒子在梯度磁场产生的机械力的作用下也会使乳腺癌MDA-MB-231细胞形态发生明显改变进而诱导乳腺癌细胞死亡.不仅如此,磁性纳米颗粒在磁场的作用下产生的机械力还可以进一步刺激细胞的分化[53,54].
另外,少数研究报道表明强磁场与DNA的损伤和突变有关.例如,2004年,Takashima等[55]用0—14 T不同梯度强磁场处理果蝇24 h,发现DNA复制修复缺陷型果蝇体细胞重组频率显著上升,而核苷酸切除修复缺陷型果蝇和DNA修复完整型果蝇曝磁后的体细胞重组频率无明显变化,而且在用0.5—2.0 T磁场处理果蝇期间,发现稳态磁场对DNA的损伤程度呈现场强依赖的关系,但是超过2 T场强后直到14 T场强DNA的损伤程度未再增加.然而,目前大多数研究却表明强磁场不会诱导DNA的损伤.例如,2007年,Schwenzer等[56]将人白血病细胞HL-60和人急性骨髓白血病细胞KG-1a置于3 T强磁场中2 h,发现3 T强磁场并不能诱导HL-60和KG-1a两种细胞的DNA双键的断裂,对DNA的完整性也没有影响.同样,2015年,Redding等[38]将人外周血单核细胞单独暴露于7 T强磁场中,或置于联合不同梯度磁场和脉冲磁场中1 h,发现无论是单独的7 T强磁场组还是磁场联合组均未发现细胞DNA双键的断裂.次年,Fatahi等[57]也发现分离的人体淋巴细胞在7 T强磁场中暴露1—72 h,并未发现DNA双键的破坏以及细胞微核率的改变.
除此之外,还有一些研究表明强磁场对细胞周期的影响也存在差异性.例如,2003年,Schiffer等[58]将HL60和EA2置于MRI产生的1.5 T和7.0 T强磁场中2—24 h,发现G0/G1期或者G2/M期的细胞百分比均没有变化.然而,2010年,Zhao等[59]将同步化的人原发性皮肤纤维细胞AG1522置于13 T强磁场中3 h,发现AG1522细胞G0/G1期细胞百分比减少,S期细胞百分比增加,细胞周期被改变.2016年,我们课题组也发现1 T磁场影响同步化的HeLa细胞周期的改变[34].而在2017年,我们课题组用1 T磁场处理HCT116,CNE-2Z,A549等癌细胞和RPE1、CHO等正常细胞2 d,发现对其细胞周期均没有明显的影响[60].并且,我们将CNE-2Z细胞置于27 T超强磁场中处理4 h,也未发现CNE-2Z细胞周期有明显的变化.因此,目前的证据表明,强磁场可以对一些同步化细胞的周期产生影响.
3 影响稳态强磁场细胞生物学效应的多种因素
从以上的结果来看,稳态强磁场对细胞取向、细胞增殖、微管排列以及细胞形态等均有不同程度的影响,然而,由于实验条件,如磁场强度、细胞类型的不同或者实验手段的不同,使得稳态强磁场下的细胞生物学效应的结果缺乏一致性.本部分将从磁场强度、细胞类型以及细胞密度等方面比较分析造成差异性的多种因素,从而帮助我们更好地理解稳态强磁场的细胞生物效应.
3.1 磁场强度
多项研究表明,不同磁场强度会导致不同的细胞生物学效应,并且在很多情况下,细胞效应与磁场强度呈正相关.例如,1993年,Higashi等[17]发现在1 T磁场下红细胞的圆盘平面仅有部分平行于磁场方向,而在8 T强磁场下红细胞的圆盘平面会100%平行于磁场方向.1998年,Bras等[41]也发现强磁场可以使微管沿着磁场方向排列,而且微管方向发生偏转的角度随着磁场强度(0—11 T)的升高而增加(图6).2003年,Iwasaka等[11]将平滑肌细胞置于8,12 T和14 T强磁场中60 h,发现12 T和14 T强磁场可以改变平滑肌细胞的形态,而且平滑肌细胞的集落会沿着磁场方向生长,而在8 T强磁场中未观察到此种效应.此外,Prina-Mello等[61]2006年的报道发现,2 T和5 T强磁场处理大鼠皮质神经元细胞1 h后,细胞内p-JNK的表达增加,而0.75 T和1 T磁场组中未发现此种现象.另外,2012年,Sakurai等[26]发现鼠源的成肌细胞C2C12暴露在6 T和10 T强磁场下6 d,细胞会沿着磁场方向分化为肌管,但是在3 T强磁场下却没有此种效应.2016年,我们课题组对比了1 T和9 T磁场对肿瘤细胞CNE-2Z和HCT116的影响,加磁3 d后,与对照组相比,发现1 T磁场组肿瘤细胞减少了约15%,9 T磁场组肿瘤细胞减少了约30%,而0.05 T组对细胞数目并没有影响[13].
由上可知,多数情况下磁场强度越高越能产生更强更明显的效果,但是,也有一些例外.例如,上文提到的Prina-Mello等[61]发现较低的0.75 T磁场处理大鼠皮质神经元细胞1 h可以引起细胞内的p-ERK水平升高,而1 T,2 T或5 T强磁场处理组却没有此种效应,并且2 T强磁场处理组细胞内p-ERK的水平反而降低.再如,2017年,Yang等[62]分别用500 nT,0.2 T和16 T稳态磁场处理成骨细胞MC3T3-E1 48 h发现,500 nT和0.2 T磁场通过抑制碱性磷酸酶活性、矿化作用以及钙沉积抑制成骨细胞的分化,而16 T强磁场却能促进其分化,而且在成骨细胞分化的过程中,500 nT处理组铁水平含量升高,0.2 T处理组铁水平含量无明显变化,16 T处理组铁水平含量降低.
综上所述,不同的磁场强度在细胞效应方面起着重要的作用,即使对于同一种细胞不同强度的稳态磁场也可能会产生完全不同的细胞效应,但由于细胞本身就是一个极其复杂的生命体系,目前还缺乏细胞与磁场强度一一对应的响应曲线,所以具体的实验结果仍需具体分析.
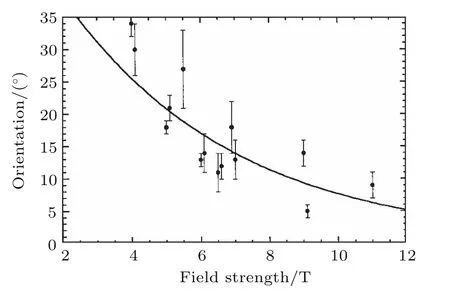
图6 不同场强下的微管排列与磁场方向之间的夹角关系(图片摘自文献[41].版权©1998 The Biophysical Society.Published by Elsevier Inc)Fig.6.Angle between the microtubule arrangement and the magnetic field orientation under Different field strengths.(Figure is reprinted from Ref.[41].Copyright©1998 The Biophysical Society.Published by Elsevier Inc).
3.2 细胞类型
除了磁场强度以外,由于不同细胞存在遗传背景的差异性,以及培养细胞的活化状态、代谢状态等不同,使得不同细胞对于同一条件下磁场的响应也存在差异.例如,2004年,Ogiue-Ikeda和Ueno[30]将平滑肌细胞A7r5(梭形)、人神经胶质瘤细胞GI-1(梭形)和人肾细胞HEK293(多边形)置于8 T强磁场中60 h,发现平滑肌A7r5细胞和人神经胶质瘤GI-1细胞沿着磁场方向排列,而人肾HEK293细胞却没有此响应,这可能是由于细胞形状不同所导致.此外,细胞类型的不同会导致细胞对磁场响应的快慢也不同,如成骨细胞、平滑肌细胞、施万细胞等贴壁细胞在强磁场下通常要处理几天才能使细胞沿着磁场方向排列,而红细胞等悬浮细胞在相同磁场下处理几秒就会发生抗磁性力矩旋转[17].除此之外,强磁场对细胞周期的影响也有细胞依赖性.例如,2010年,Zhao等[59]用13 T强磁场处理中国仓鼠卵巢细胞(CHO)、DNA双链断裂修复缺失突变体XRS-5细胞和人原发性皮肤AG1522细胞3 h,发现13 T强磁场不影响CHO细胞和DNA双链断裂修复缺失突变体XRS-5细胞的细胞周期分布,但是AG1522细胞的G0/G1期细胞百分比降低,S期细胞百分比增加,这表明强磁场可能对原代细胞周期的影响要大于永生化细胞.
然而有趣的是,从目前的研究结果来看,肿瘤细胞的磁场敏感性似乎高于非肿瘤细胞.例如,1992年,Short等[35]将人恶性黑色素瘤细胞PS1273和人正常纤维细胞DMD-A置于4.7 T强磁场中24,48和72 h,发现4.7 T强磁场降低了PS1273细胞的粘附能力,而对正常纤维细胞却没有影响.相似地,2003年,Aldinucci等[63]发现4.75 T磁场处理人外周血单核细胞PBMC和Jurkat白血病细胞24 h和48 h后并未影响PBMC的细胞增殖,但是却抑制了Jurkat的增殖.2006年,Ghibelli等[16]也发现1 T磁场处理3.5 h可以促进白血病细胞U937和Jurkat的凋亡,而对正常外周血单核白细胞PBML却没有影响.最近,我们课题组用9 T强磁场处理人鼻咽癌细胞CNE-2Z、结肠癌细胞HCT116和CHO 3 d,发现9 T强磁场明显抑制CNE-2Z和HCT116的增殖,而对CHO细胞却没有影响[13].
3.3 其他原因影响稳态强磁场的细胞生物学效应
除了磁场强度和细胞类型外,还有一些其他的原因也会影响稳态强磁场的细胞生物学效应,例如,细胞本身所处的状态.1993年,Higashi等[19]发现红细胞中血红蛋白的状态可以直接影响红细胞的磁性,即当血红蛋白处于含氧状态时红细胞具有抗磁性,而当血红蛋白处于脱氧还原状态时红细胞具有顺磁性.另外,疟疾感染后不同时期的红细胞也会具有不同的磁性.例如,1792年,Hackett等[64]发现疟原虫感染红细胞后,可以将大约60%的宿主红细胞的血红蛋白转化为不溶性的疟原虫色素,以防止血红素对细胞的损伤,而疟原虫色素会使感染后的红细胞磁化率显著增加(图7).
除了细胞状态外,细胞的生长密度也会影响细胞对强磁场的响应.2004年,Ogiue-Ikeda和Ueno[30]用8 T强磁场处理平滑肌细胞A7r5(梭形)和人神经胶质瘤细胞GI-1(梭形)60 h发现,当细胞密度处于中等密度和增殖状态时,A7r5和GI-1细胞会沿着磁场方向排列,然而当细胞处于汇合状态,此时细胞密度过高并处于非增殖状态,A7r5和GI-1细胞便不会沿着磁场方向排列.我们课题组也于2017年发现细胞的铺板密度在磁场的细胞生物学效应中起着重要的作用.我们用1 T磁场处理HCT116,A431,A549,PC3,MCF7和EJ1多种实体瘤肿瘤细胞2 d,发现1 T磁场可以抑制高密度肿瘤细胞的增殖,而对低密度肿瘤细胞无明显影响,这可能与肿瘤细胞内的EGFR-AKT-mTOR信号通路相关[60].

图7 疟原虫感染的红细胞(RBCs)中铁的磁化率 (a)转化为疟原虫色素的细胞铁比例vs成熟的寄生虫密度比例;(b)各种标准品中铁的摩尔磁化率散点分布:氧合血红蛋白(Oxy—?),正铁红素(h—◢),高铁血红蛋白(Met—?)以及疟疾感染的红细胞培养皿中的磁性(Mag—•)和非磁性(Non mag—N)部分(图片摘自文献[64].版权©2008 Elsevier B.V)Fig.7.Magnetic susceptibility of iron in malaria-infected red blood cells(RBCs):(a)Percentage of cellular iron converted to haemozoin vs.mature parasite density;(b)scatter plot of the molar magnetic susceptibility of iron in standard samples of oxyhaemoglobin(Oxy–?),haematin(h–◢),methaemoglobin(Met–?),and for magnetic(Mag–•)and non-magnetic(Non-mag–N)fractions of malaria-infected red cell cultures(Figure is reprinted from Ref.[64].Open access.Copyright©2008 Elsevier B.V).
4 展望与总结
稳态强磁场对细胞的影响是多方面的,除了文中提到的可以影响细胞取向、细胞增殖、细胞形态和细胞周期等,还有许多其他方面的影响,譬如基因的表达[65]、活性氧簇(ROS)的含量[66]、钙离子通道[16,63]、细胞迁移[67,68]以及ATP的合成与代谢[69]等.然而目前有关强磁场对于细胞各种效应的影响大多没有统一的结论.究其原因,一方面是由磁场本身参数不同导致的,包括磁场强度、曝磁位置和曝磁时间等;另一方面是由研究对象不同造成的,例如,细胞类型(贴壁、悬浮)、细胞形态(梭形、多边形)和细胞状态等因素都会导致细胞对强磁场的响应不同.所以,我们仍需更深入地研究其存在的共性和差异性才能更好地理解强磁场对不同细胞造成不同影响的原因,并在此基础上从物理学的角度研究生物学问题[70,71],深入探索强磁场影响细胞的可能分子机制,才能为以后强磁场下细胞生物学效应的研究提供理论基础,并为强磁场在生物医学领域的应用提供一定的理论依据.
