互花米草入侵对长江河口湿地CH4排放的影响
2018-10-29布乃顺杨亚利赵忆惠方长明闫卓君
布乃顺,杨 骁,郭 昊,杨亚利,赵忆惠,马 放,李 博,方长明,闫卓君
互花米草入侵对长江河口湿地CH4排放的影响
布乃顺1,2,3,杨 骁1,郭 昊1,杨亚利1,赵忆惠1,马 放3,李 博4,方长明4,闫卓君5*
(1.辽宁大学环境学院,辽宁 沈阳 110036;2.华东师范大学河口海岸学国家重点实验室,上海 200062;3.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090;4.复旦大学生命科学学院,上海 200438;5.辽宁大学化学院,辽宁 沈阳 110036)
为了探讨互花米草入侵对长江河口湿地CH4排放的影响以及入侵至不同潮位对CH4排放影响程度的差异及其可能机制,采用邻近互花米草与土著植物群落相配对的试验设计,在长江口东滩湿地的高潮滩和低潮滩各设置1条样线.结果表明,与土著植物相比,互花米草入侵显著增加了长江河口湿地的植物生物量,显著增加了土壤含水量、土壤有机碳含量、总氮含量、微生物碳和氮含量.高潮滩互花米草群落年均CH4排放强度为(0.68±0.08)mg/(m2·h),显著高于芦苇群落(0.21±0.01)mg/(m2·h),低潮滩互花米草和海三棱藨草群落年均CH4排放速率分别为(8.31±0.50)和(3.93±0.18)mg/(m2·h),前者显著高于后者.此外,高潮滩互花米草与芦苇群落之间年均CH4排放强度的差异为(0.47±0.08)mg/(m2·h),显著低于低潮滩互花米草与海三棱藨草群落之间年均CH4排放强度的差异(4.37±0.48)mg/(m2·h).上述结果表明,互花米草入侵通过改善CH4产生所需底物的质和量,增加土壤含水量和微生物的量,从而显著增加了长江河口湿地CH4排放量.互花米草入侵至低潮滩增加的CH4排放量是互花米草入侵至高潮滩的10倍左右,表明互花米草入侵至长江河口湿地对CH4排放的影响程度可能会有很强的空间异质性,互花米草入侵至更厌氧的土壤环境可能会对CH4排放的影响程度更大.本研究可为准确估算互花米草入侵对中国海岸带湿地CH4排放的影响程度,科学管理和合理利用海岸带湿地资源以及应对全球气候变化提供理论依据和科技支撑.
生物入侵;CH4排放;互花米草;长江河口湿地
生物入侵在全球陆地生态系统中广泛发生,已成为全球环境问题和全球变化的重要组成部分[1].随着人口数量和人类活动扰动的增加,以及全球贸易和经济一体化过程的深入,生物入侵的态势及其对入侵区的生态环境、社会经济和人类健康的危害将日趋严重,正侵蚀着人类赖以生存的自然和人工生态系统[2].海岸带广泛分布于海陆交界地带,其面积约占地球表面积的19%,居住着世界人口的60%左右,产生着重要的生态、经济和社会效益[3-4],因此,海岸带的生态系统健康与人类福祉息息相关.海岸带湿地在为社会发展提供丰富资源的同时,也遭受到了多重压力胁迫干扰[5],加之海岸带湿地处于陆地、海洋和河流交汇处,极易遭受生物入侵[6].海岸带湿地是世界上单位面积生产力和生态系统服务价值最高的生态系统之一[3],亟需深入评估生物入侵对海岸带湿地的生态影响.
CH4是仅次于CO2的重要温室气体,在100年的时间尺度上,1g CH4的温室效应是1g CO2的25倍左右[7].湿地面积仅占陆地面积的4%~6%,其CH4排放量约占排放总量的20%~39%[8].海岸带湿地作为湿地的重要组成部分,生物入侵会通过改变海岸带湿地的物种组成、土壤性质、群落结构等[9],显著影响CH4产生和排放,进而对大气组成、全球气候变化和生态系统服务功能产生重要影响.在全球气候变化背景下,深入探讨生物入侵对海岸带湿地CH4排放的影响及其机制无疑是评估入侵影响的重要内容.
目前关于入侵对CH4排放影响的研究尚不多,原位试验监测研究较少,入侵能增加、降低,也可能不影响CH4排放.互花米草入侵九段沙湿地,取代海三棱藨草群落,显著增加了CH4排放量[10].在闽江河口湿地,互花米草入侵后CH4的排放量显著高于土著种芦苇群落[11].淡竹入侵日本北海道沼泽湿地显著降低了CH4的排放量[12].而芦苇入侵新英格兰盐沼湿地对CH4排放无影响[13].模拟盐沼实验研究表明,相同土壤理化性质和淹水条件下,互花米草模拟盐沼CH4排放量显著高于芦苇模拟盐沼[14]和盐地碱蓬模拟盐沼[15].从上述研究来看,入侵对CH4排放影响的结果相对复杂,仍然缺乏深入系统的原位试验监测研究.海岸带湿地蓝碳生态系统具有高效的固碳能力,在应对全球变化中具有极其重要的地位[16].在全球变化的背景下,亟需深入系统的探讨入侵对海岸带湿地CH4排放的影响及其可能的机制.
互花米草(C4植物)原产于北美洲的大西洋沿岸,近年来, 由于有意或无意的人类活动, 互花米草的分布区域已经从其原产地扩展到欧洲、北美西海岸、新西兰与中国沿海区域,并成功入侵[17].1979年,中国学者出于保护沿海滩涂、防风固堤和促淤造陆的目的,从美国将互花米草的种子和根状茎带入中国[17].此后,经多次人工引种,互花米草在中国海岸带湿地大面积扩散,成为中国海岸带湿地(包括长江河口湿地)生态系统中最重要的入侵植物[18].长江河口湿地主要土著种为芦苇和海三棱藨草(均为C3植物),其中芦苇群落主要分布于高潮滩,海三棱藨草群落主要分布于低潮滩.互花米草被引入长江河口湿地后迅速扩散,取代了大面积芦苇和海三棱藨草群落,成为优势植物群落之一.互花米草入侵显著影响了底栖动物群落结构[19],改变了土壤微生物多样性和群落结构[20],影响了食物网结构[21],改变了土壤理化性质[22],导致了土著生态系统的显著变化.这些研究暗示着互花米草入侵对海岸带湿地CH4排放有重要潜在影响,然而,目前对互花米草入侵如何影响海岸带湿地CH4排放及相关机理尚缺乏深入理解.
本研究采用配对试验设计,在长江河口湿地建立2条研究样线,高潮滩样线为互花米草和芦苇群落配对,低潮滩样线为互花米草和海三棱藨草群落配对,通过比较互花米草群落与相应土著植物群落之间组分的差异,探讨互花米草入侵对长江河口湿地CH4排放的影响程度及可能的机制,探索互花米草入侵到长江河口湿地的不同潮位对CH4排放影响的差异,同时探讨互花米草入侵对长江河口湿地植物生物量、土壤理化性质和碳氮含量的影响.以期为评价生物入侵的生态后果,科学管理和合理利用海岸带湿地资源,实现海岸带可持续发展,以及应对全球气候变化提供理论依据和科技支撑.
1 材料与方法
1.1 研究区概况
研究在长江河口崇明东滩湿地(31°25′~31°38′N, 121°50′~122°05′E)进行.长江是世界上第三大河流,所携带泥沙约有50%在河口区域沉积,形成规模大、发育较为完善的海岸带湿地[23].崇明岛是中国第三大岛,也是最大的淤积岛,崇明东滩湿地位于崇明岛的最东端.东滩湿地于2002年被湿地国际秘书处正式列入国际重要湿地名录,于2005晋升为国家级自然保护区,是具有全球意义的生态敏感区[24].
东滩湿地处于亚热带季风性湿润气候区域,温和湿润,年均温为15.3℃,最热为7、8月间,月平均气温27.5℃,最冷为1月,月平均气温2.9℃.年均降水量1022mm,主要集中在4~9月.夏季盛行东南风,冬季盛行西北风,季风气候明显[23].
东滩湿地的物种组成和群落结构相对简单,主要优势物种为互花米草、芦苇和海三棱藨草,各自形成单优势群落[17].互花米草为禾本科微管植物,是原环境保护部公布的中国首批16种外来入侵物种之一,于2001年被人为引入东滩湿地,在潮间带迅速扩散,成为主要优势物种,在从大堤至光滩的不同潮位均有分布[24].芦苇和海三棱藨草为土著植物物种,芦苇为禾本科微管植物,主要分布于高潮滩,海三棱藨草为莎草科植物,主要分布于低潮滩,为潮滩演替的先锋种[24].
1.2 试验设计
2012年1月,在长江口东滩湿地设置2条南北方向的样线,分别位于高潮滩和低潮滩(图1).在每条样线上均选取3个样点,每个样点均采取配对试验设计.高潮滩样线长约1.2km,为入侵种互花米草和土著种芦苇的配对样线,低潮滩样线长约0.7km,为入侵种互花米草和土著种海三棱藨草的配对样线,在进行植物和土壤样品采集以及CH4排放速率测定时,每个样点的每种群落内均设置3个重复.
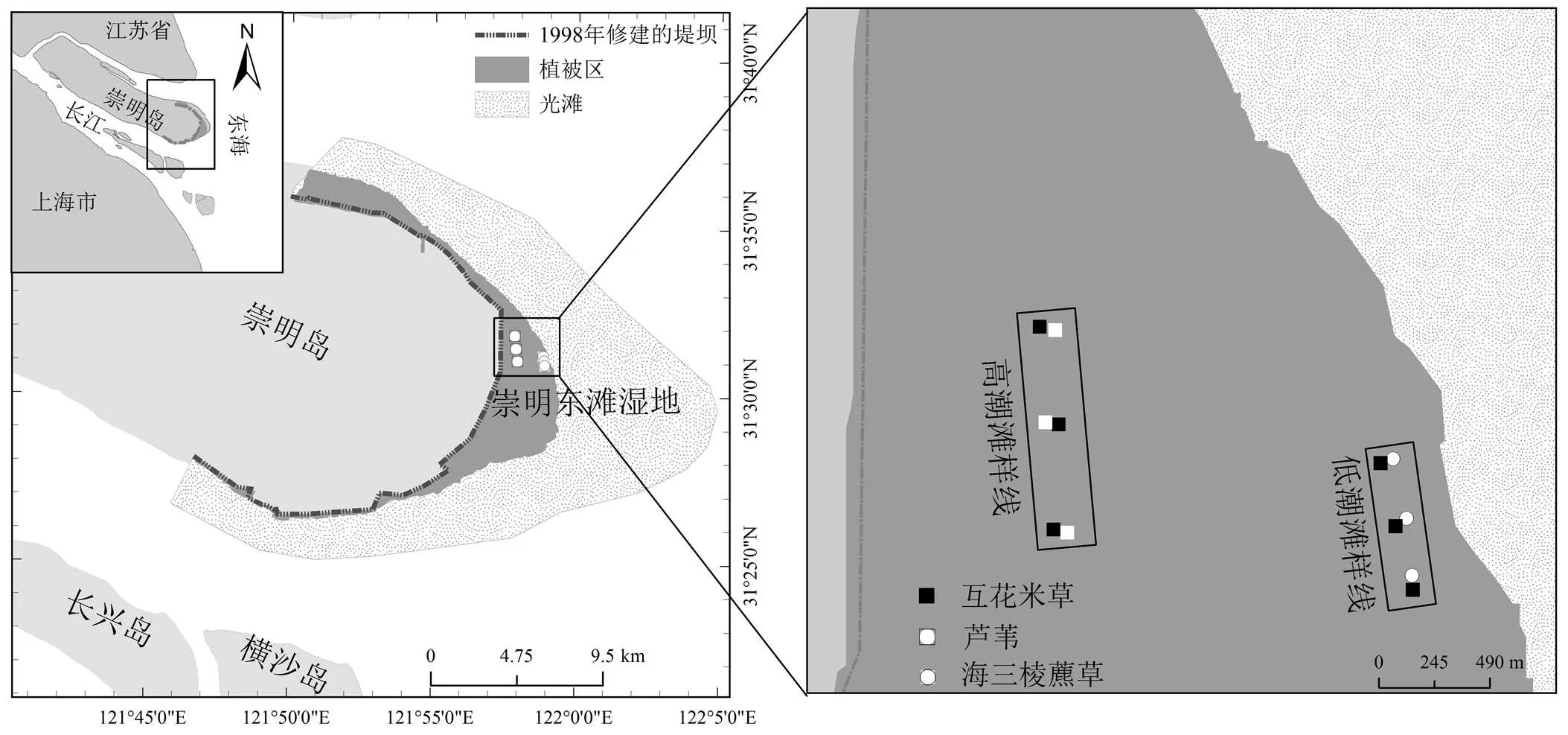
图1 研究样点在长江口崇明东滩湿地的分布示意
1.3 植物和土壤样品采集及分析
于2012年8月中旬收割地上部分生物量,样方面积为0.5m×0.5m.同时使用长为110cm,内径为10cm的不锈钢植物样品采集器采集地下生物量,将取出样品在清水中洗净.将地上和地下植物样品50℃烘干后称重.
于2012年8月采集3层(0~10、10~20和20~ 40cm),将土壤样品风干后研磨过100目不锈钢筛用于测试土壤有机碳和总氮含量.于2012年8月采集0~20cm的土壤,取出部分新鲜土壤样品稍微风干后,过20目不锈钢筛后用于测定微生物碳和氮含量;其余样品风干后,过20目不锈钢筛后用于测定土壤盐度和pH值.土壤样品采集均用长为50cm,内径为3.5cm的不锈钢管进行.
土壤盐度使用电导法测定,采用水土比为5:1提取水溶液后用便携电导率仪(上海仪电科学仪器股份有限公司,中国)进行测定.土壤pH值采用水土比为5:1提取水溶液后使用便携式pH计(上海仪电科学仪器股份有限公司,中国)测定.土壤总氮含量使用元素分析仪(FlashEA 1112Series CN Analyzer, Thermo Fisher Scientific)测定.土壤有机碳含量使用有机碳分析仪(vario TOC, Elementar, Germany)测定.土壤微生物碳和氮含量的分析采用氯仿熏蒸提取法,使用有机碳分析仪(vario TOC, Elementar, Germany)测定提取液中碳和氮含量.
1.4 CH4排放的测定
采用静态箱—气相色谱法测定CH4排放速率.静态箱使用厚度为8mm的有机玻璃制作,由顶箱和延长箱两部分组成,顶箱为没有底面的正方体,其内部长、宽和高分别为:50,50,50cm.在顶箱的顶部安装长针头,在箱外与一个三通阀连接用于气体采集;在顶箱的顶部装有PT1000不锈钢温度探头用于气体采集期间测量箱内气温;箱内侧壁上安装两个风扇用于气体采集期间混匀箱内的气体.延长箱为没有顶面和底面的长方体,其内部长和宽均为50cm,高度分别为50,100,150cm,在采集气体样品时,根据植物生长高度,选择相应规格的延长箱.
样品采集选择在小潮期间,在样品采集前将底座先安置于相应样点.在整个测量周期内,底座一直安放在相应样点,同时在底座相对两侧的侧壁上,贴地面开设2个直径为5cm的孔,以便潮水能自由进出底座,在测量前1d,用橡胶塞将孔密封.样品采集时,将静态箱轻放在底座上,安放完毕后,稳定5~10min后开始计时并采集气体,每次测量的周期为30min,用60mL的医用注射器分别在0,10,20,30min通过三通阀抽取静态箱内50mL气体,注入事先抽好真空的铝箔复合膜采集袋(大连德霖气体包装有限公司,中国)中,样品采集后迅速送回实验室,尽快完成样品中CH4浓度的分析.在样品采集的同时,记录箱内空气温度,并用土壤环刀采集0~5cm的土壤,将土壤样品用自封袋密封带回实验室,用烘箱105℃烘干后,测定土壤含水量.
气体样品中CH4的浓度用Agilent 6890N型气相色谱(Agilent Technologies, Inc., USA)测定.色谱柱采用不锈钢填充柱,填料为13X分子筛(60/80目),柱长2m,内径2mm,载气流速为30mL/min.载气为高纯氮气,柱箱温度为55℃,检测器为氢火焰离子检测器(FID),温度为200℃,助燃气为高纯氢气和高纯空气,流速分别为40,400mL/min.
1.5 数据分析
采用重复测量方差分析比较高潮滩互花米草和芦苇群落之间及低潮滩互花米草和海三棱藨草群落之间CH4排放、土壤温度和土壤含水量的差异.采用单因素方差分析比较高潮滩互花米草和芦苇群落之间及低潮滩互花米草和海三棱藨草群落之间植物生物量、土壤有机碳含量、土壤总氮含量、土壤微生物碳含量、土壤微生物氮含量、土壤电导率和土壤pH值的差异.采用单因素方差分析比较高潮滩互花米草和低潮滩互花米草群落之间植物生物量、CH4排放、土壤有机碳含量和微生物碳的差异.采用单因素方差分析比较互花米草入侵高潮滩改变的CH4排放与入侵低潮滩改变的CH4排放之间的差异.所有统计分析均使用软件SPSS 13.0 (SPSS Inc., USA)完成.
2 结果与分析
2.1 不同植物群落间植物生物量的差异
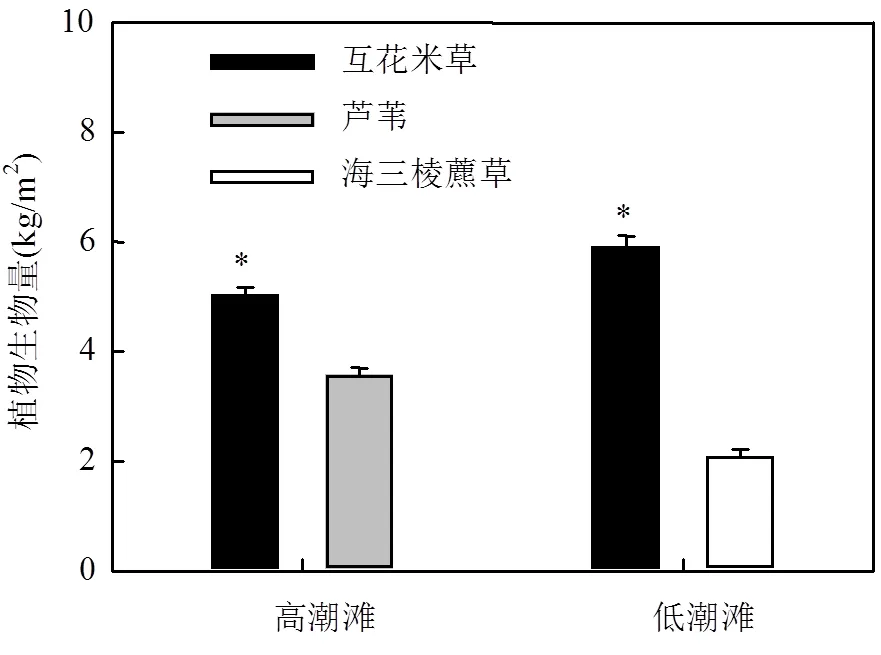
图2 高潮滩和低潮滩不同植物群落的植物生物量
*表示在<0.05水平上有显著差异,下同
高潮滩互花米草群落植物生物量为(5.04± 0.13)kg/m2,显著高于芦苇群落植物生物量(3.58±0.12) kg/m2(<0.01,图2);低潮滩互花米草群落植物生物量同样显著高于海三棱藨草群落植物生物量,分别为:(5.92±0.19)kg/m2和(2.10±0.11)kg/m2(<0.001,图2).此外,低潮滩互花米草群落植物生物量显著高于高潮滩互花米草群落植物生物量(<0.05,图2).
2.2 不同植物群落间土壤理化性质的差异
高潮滩和低潮滩土壤温度呈现出明显的季节变化,且在入侵植物互花米草群落与土著植物群落之间均无明显差异(图3a,b).而高潮滩和低潮滩土壤含水量均是入侵植物互花米草群落显著高于土著植物群落(<0.05,图3c,d).高潮滩和低潮滩土壤盐度以及pH值在入侵植物互花米草群落与土著植物群落之间均无明显差异(表1).东滩湿地高潮滩和低潮滩土壤pH值均在8.0以上(表1),表明互花米草入侵对土壤pH值没有影响.
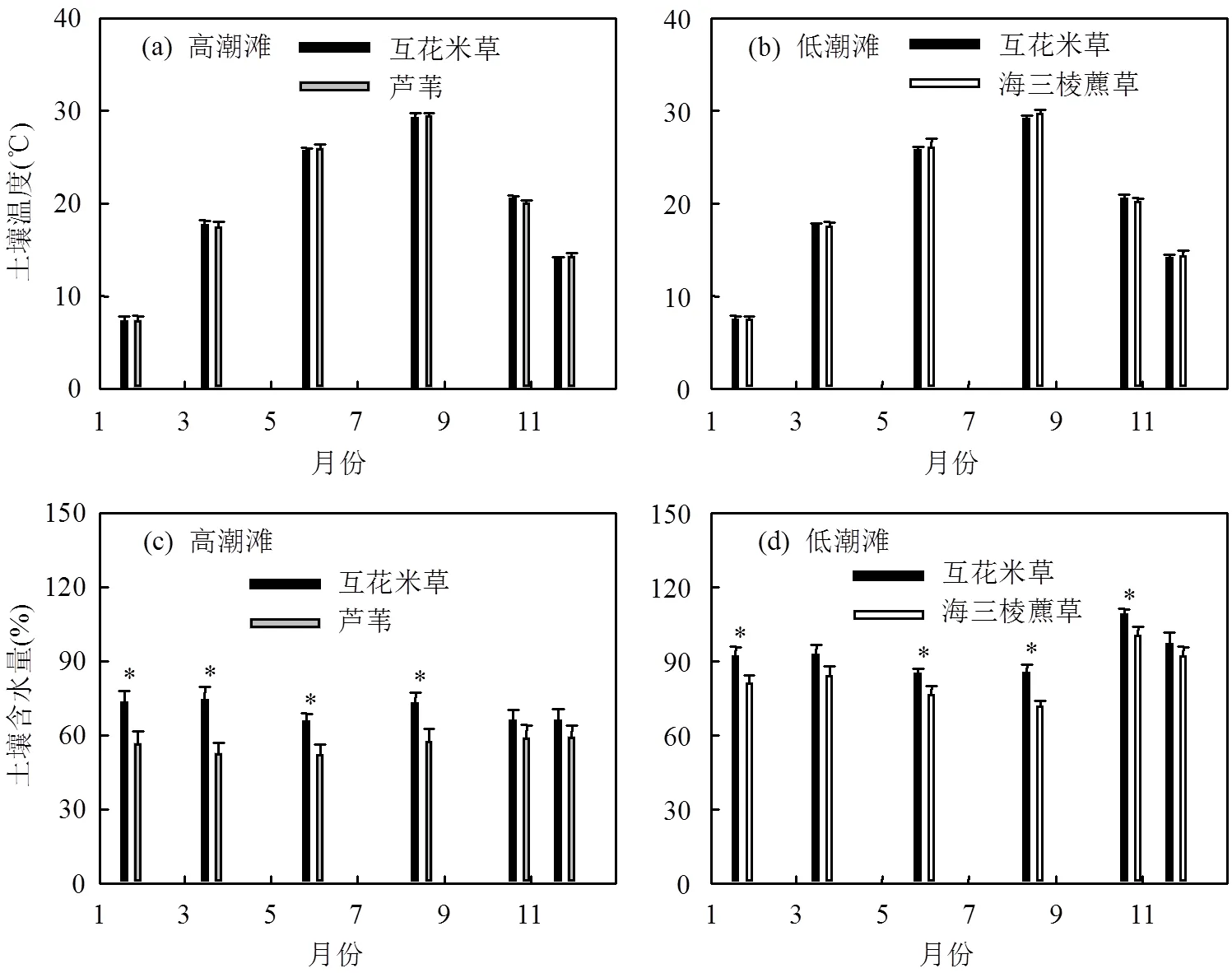
图3 高潮滩和低潮滩不同植物群落的土壤温度与含水量的季节变化(2012年)
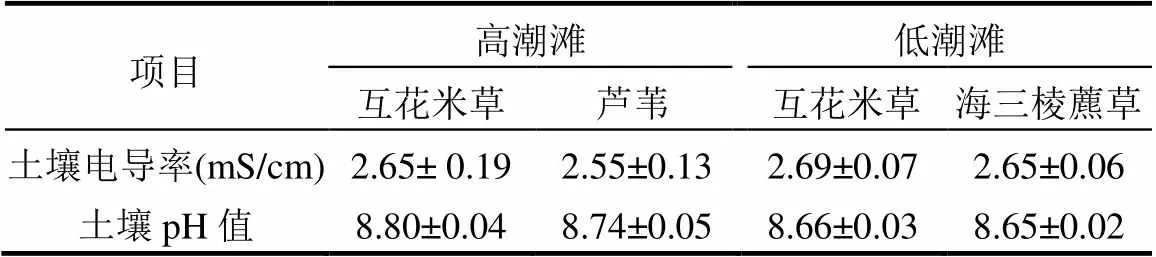
表1 高潮滩和低潮滩不同植物群落下土壤盐度和pH值
2.3 不同植物群落间土壤有机碳和氮含量的差异
高潮滩互花米草群落0~40cm深度土壤有机碳和总氮含量分别为(6.57±0.41),(0.83±0.04)g/kg,显著高于芦苇群落0~40cm深度有机碳含量((5.20±0.46) g/kg)和总氮含量((0.69±0.05g/kg)(<0.05,图4a,c).低潮滩互花米草群落土壤有机碳含量((5.45±0.12) g/kg)和总氮含量((0.68±0.02)g/kg),显著高于海三棱藨草群落土壤有机碳含量((3.18±0.15)g/kg)和总氮含量((0.45±0.02)g/kg)(<0.05,图4b,d).
从0~40cm的土壤剖面来看,高潮滩互花米草群落0~10,10~20,20~40cm土壤层有机碳和总氮含量均显著高于芦苇群落相应土壤层有机碳和总氮含量(<0.05,图4a,c).低潮滩互花米草群落0~10,10~20, 20~40cm土壤层有机碳和总氮含量均显著高于海三棱藨草群落相应土壤层有机碳和总氮含量(<0.05,图4b,d).
高潮滩互花米草群落土壤微生物碳和氮含量分别为(80.99±9.26)和(23.21±2.30)mg/g,显著高于芦苇群落土壤微生物碳和氮含量((56.27±3.39), (11.64±0.64)mg/g)(<0.05,图5),低潮滩互花米草群落土壤微生物碳和氮含量同样显著高于海三棱藨草群落土壤微生物碳和氮含量.低潮滩互花米草和海三棱藨草群落土壤微生物碳含量分别为: (45.65±2.51),(31.63±2.59)mg/g(<0.001,图5),低潮滩互花米草和海三棱藨草群落土壤微生物氮含量分别为:(12.31±0.59),(6.86±0.66)mg/g(< 0.001,图5).
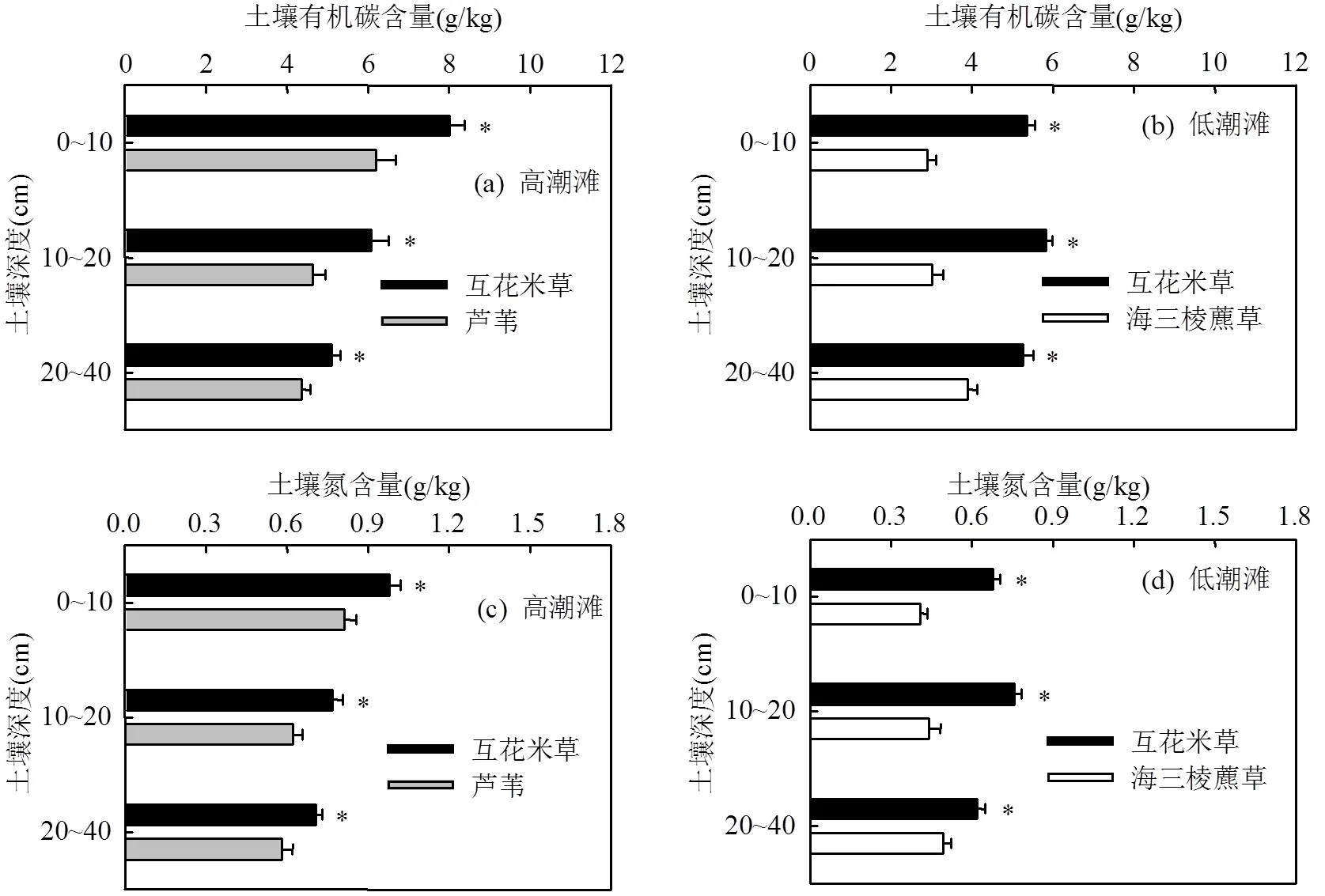
图4 高潮滩和低潮滩不同植物群落下土壤有机碳含量和氮含量
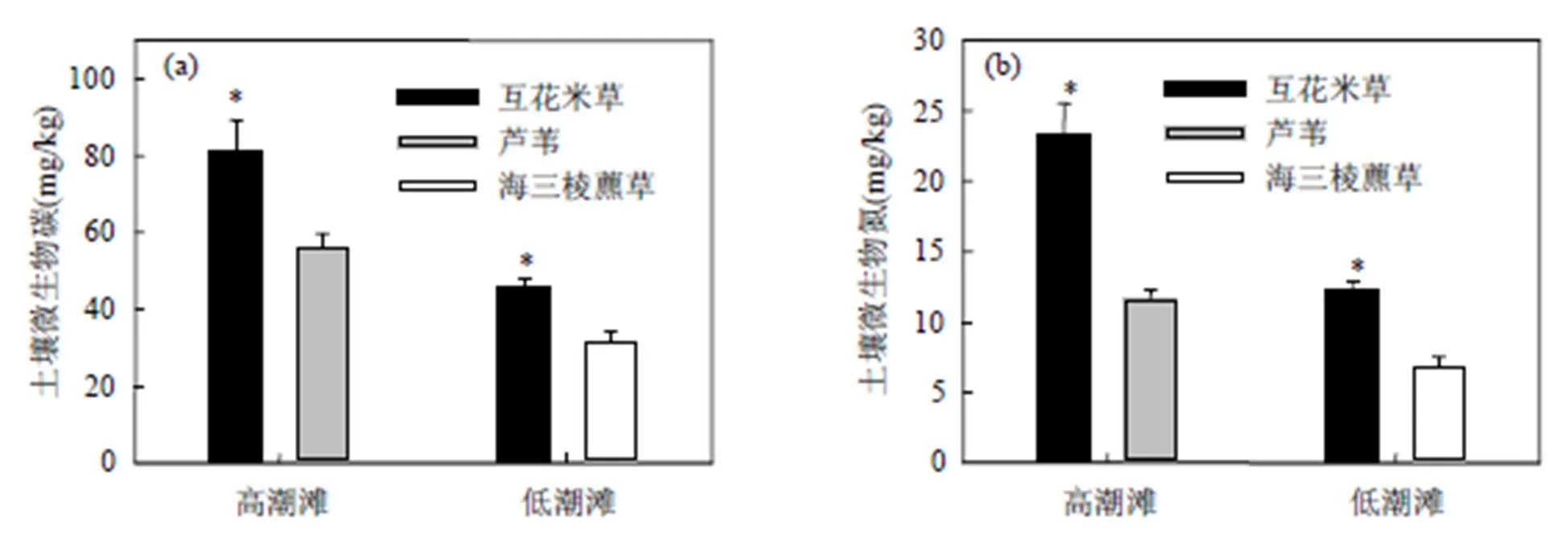
图5 高潮滩和低潮滩不同植物群落下土壤微生物碳和氮含量
2.4 不同植物群落间CH4排放的差异
高潮滩互花米草群落CH4排放显著高于芦苇群落(图6a),年平均CH4排放强度分别为(0.68±0.08), (0.21±0.01)mg/(m2·h).互花米草与芦苇群落之间的差异主要体现在生长季,非生长季CH4排放差异较低.低潮滩互花米草和海三棱藨草群落年平均CH4排放速率分别为(8.31±0.50),(3.93±0.18)mg/(m2·h),前者显著高于后者(图6b),差异同样主要体现在生长季.
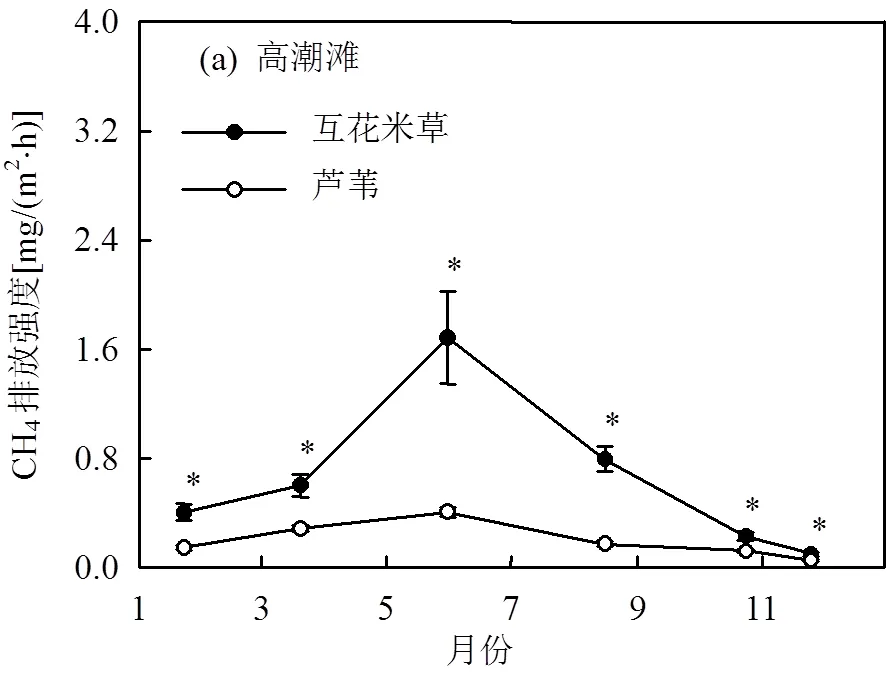
此外,高潮滩互花米草与芦苇群落之间年平均CH4排放强度的差异为(0.47±0.08)mg/(m2·h),显著低于低潮滩互花米草与海三棱藨草群落之间年平均CH4排放强度的差异((4.37±0.48)mg/(m2·h)).
3 讨论
3.1 互花米草入侵对长江河口湿地植物生物量的影响
入侵植物互花米草群落的植物生物量显著高于土著植物群落,此研究结果与在长江河口湿地的研究结果相一致[25-26].与土著植物相比,互花米草有比较优势的生理生态特征如有更高的叶面积指数、净光合速率和较长生长季等[27],进而显著增加长江河口湿地生态系统的净初级生产力.此外,氮素等营养盐是潮滩湿地植物生长的重要限制因子[28],在周期性潮水淹没过程,互花米草群落可以比土著植物群落在潮水中获取更多营养盐如无机氮等[29],从而促进了互花米草在海岸带湿地定植、生长和迅速扩散.本研究还表明互花米草入侵至低潮滩增加的植物生物量显著高于入侵至高潮滩.与土著物种相比,互花米草所具有上述比较优势,导致其入侵显著增加长江河口湿地净初级生产力和碳输入.
受周期性潮汐影响,海岸带湿地除了和其他生态系统一样存在垂向物质通量外,还与周边水域存在明显的横向物质通量和能量转移[30].海岸带湿地通过横向通量,向周边水域输送大量凋落物、当年生植物残体以及颗粒性有机物等陆源有机物质.互花米草入侵海岸带湿地显著增加植物生物量以及凋落物的量[31],尤其在低潮滩互花米草取代海三棱藨草成为先锋种,并表现出良好的生长态势,很可能会增加向周边水域的陆源有机物质输送量,从而对维持周边水域生态系统的生产过程起到重要作用,同时也可能会对周边水域生态系统的生物地球化学循环过程和生态服务功能产生显著影响.
3.2 互花米草入侵对长江河口湿地土壤碳氮的影响
相比于土著植物,互花米草具有比较优势的植物生态特征[27],显著增加了净初级生产力包括地下植物生产力,同时也会增加根系分泌物的量.互花米草入侵所导致的上述改变意味着显著增加了土壤碳输入,进而显著增加了土壤碳含量.值得注意的是,互花米草入侵使0~40cm土壤剖面的碳含量均有显著增加.可能主要由于以下原因;一方面,与土著植物芦苇和海三棱藨草相比,互花米草入侵同时增加了表层和深层地下植物生产力[25],意味着增加了表层和深层土壤碳输入.另外一方面,互花米草比芦苇和海三棱藨草有更强的促淤效应[29],可促进表层土壤更快更深地向深层土壤埋藏,使得深层土壤碳含量同样显著增加.与土著植物相比,互花米草具有比较优势的生理生态特征[27],较高的植物生物量和土壤有机碳含量,能分泌更多的根系分泌物,可为微生物提供更多容易被利用的底物,其入侵显著增加了海岸带湿地土壤微生物碳含量.土壤微生物量的增加可能会对长江河口湿地的生物地球化学过程产生重要影响.
与土著植物群落相比,互花米草群落具有较高的土壤总氮含量,互花米草入侵可能主要通过两种机制影响土壤总氮含量.一种机制是在与潮水交互过程中,互花米草群落比土著植物群落能在潮水中截取更多氮素等营养盐,且比芦苇和海三棱藨草群落有更强的促淤效应[29],对海岸带湿地生态系统的氮素累积起重要作用.另外一种机制是由于腐生固氮微生物的作用,互花米草凋落物在分解过程中氮含量和氮库显著升高,而土著种芦苇和海三棱藨草凋落物在分解过程中氮含量显著降低[31],意味着互花米草凋落物在分解过程中向长江河口湿地生态系统固定了大量氮素.
3.3 互花米草入侵对长江河口湿地CH4排放的影响
长江河口湿地高潮滩互花米草群落CH4排放量是芦苇群落的3倍以上,低潮滩互花米草群落CH4排放量是海三棱藨草群落的2倍以上.本研究与互花米草入侵闽江口湿地芦苇群落[11]和入侵九段沙湿地海三棱藨草群落[10]的原位监测研究,以及与互花米草入侵影响的模拟盐沼实验研究[14-15]的结果相一致.综合上述研究结果表明,互花米草入侵长江河口湿地很可能会显著增加其CH4排放量,进而可能会显著影响海岸带湿地在调节全球气候变化中所起扮演的重要角色.
互花米草入侵长江河口湿地可通过改善CH4产生所需底物的质和量显著增加CH4排放量.首先,与土著植物芦苇和海三棱藨草相比,互花米草有更高的光合作用效率、叶面积指数和更长生长季[27],因此可产生更多光合作用产物通过根系分泌物等途径输送至土壤,而植物光合作用产物是土壤CH4产生的主要底物来源[32].其次,CH4排放与植物生物量之间呈显著正相关关系[33],互花米草入侵通过增加植物生物量和凋落物的量而增加了CH4产生.最后,CH4产生和排放会随着湿地土壤有机质添加而显著增加[34],互花米草入侵显著增了海岸带湿地土壤有机碳和氮含量.互花米草入侵除了影响CH4产生所需底物外,还显著增加了土壤微生物生物量,并增加了产甲烷菌的量[35].此外,维管植物可作为CH4排放通道从土壤内部向大气传输CH4[36].海三棱藨草为非维管植物,互花米草和芦苇为维管植物,但互花米草的植物生物量包括根系生物量、植物密度和植物基部直径均显著高于芦苇[25],互花米草入侵可能会增加从长江河口湿地土壤内部向大气的CH4传输能力.
土壤含水量会通过调节土壤厌氧和好氧环境的相对程度进而影响CH4产生与氧化的比率[37],湿地CH4排放与土壤含水量间呈显著正相关关系[38].与土著植物相比,互花米草入侵显著增加了长江河口湿地的土壤含水量,可能会促进CH4产生,抑制其氧化,进而促进CH4排放.
本研究结果表明,互花米草入侵至低潮滩增加的CH4排放量是互花米草入侵至高潮滩的10倍左右,意味着互花米草入侵至长江河口湿地对CH4排放的影响程度可能会有很强的空间异质性.导致入侵对CH4排放影响程度空间分异的重要原因可能主要是低潮滩土壤含水量显著高于高潮滩土壤,低潮滩土壤环境比高潮滩土壤环境更加厌氧,互花米草入侵至更加厌氧的土壤环境可能会对CH4排放的影响程度更大.
本研究结果可为准确估算互花米草入侵对海岸带湿地对CH4排放的影响程度提供重要依据.首先,在潮水淹没频率高和时间长,以及土壤营养好的环境下,互花米草的生长表现比土著植物有更强的竞争优势[39],互花米草入侵中国海岸带湿地向低潮滩的扩散速度可能比向高潮滩的扩散速度更快[18].因此,在评价互花米草入侵对CH4排放影响时,需考虑互花米草入侵至不同潮滩位置所造成影响的空间分异.其次,海平面上升可能会增加潮水淹没潮滩湿地的时间和频率[40],影响潮水土壤的厌氧环境,进而可能会改变互花米草入侵对中国海岸带湿地CH4排放的影响程度.最后,海岸带区域的快速工业化和城市化向河口和近海海域输入大量营养盐,导致水体富营养化[41],周期性的潮汐淹没会将人类排放的大量营养盐带入海岸带湿地,可能会对互花米草的入侵产生重要影响,进而可能显著改变海岸带湿地CH4产生和排放.
值得注意的是,美国东海岸与中国海岸带湿地相反,芦苇群落入侵并取代大面积互花米草群落,芦苇入侵显著增加了植物生物量[42].目前尚缺乏芦苇入侵美国东海岸湿地对CH4排放影响的原位监测研究.芦苇入侵增加了美国东海岸湿地植物净初级生产力,改善了CH4产生所需底物的质和量,由此推测芦苇入侵可能会显著增加美国东海岸湿地CH4排放.在全球气候变化的背景下,未来开展互花米草入侵对中国滨海湿地影响与芦苇入侵美国东海岸湿地影响异同的比较研究,对深入系统的理解植物入侵对海岸带湿地CH4排放的影响程度及其机制有重要意义.
4 结论
4.1 互花米草入侵显著增加了长江河口湿地的植物生物量,且入侵至低潮滩增加的植物生物量显著高于入侵至高潮滩,意味着入侵增加了长江河口湿地的碳输入,有利于湿地生态系统演替早期的碳累积.
4.2 互花米草入侵显著增加了长江河口湿地的土壤含水量、土壤有机碳含量、总氮含量、微生物碳和氮含量,表明互花米草入侵会增加土壤环境的厌氧程度,改善改善CH4产生所需底物的质和量.
4.3 互花米草群落CH4排放量显著高于土著植物群落,互花入侵通过改善CH4产生所需底物的质和量,增加土壤含水量和微生物的量,显著增加了长江河口湿地CH4排放量.
4.4 互花米草入侵至低潮滩增加的CH4排放量是互花米草入侵至高潮滩的10倍左右,表明互花米草入侵至长江河口湿地对CH4排放的影响程度可能会有很强的空间异质性,互花米草入侵至更加厌氧的土壤环境可能会对CH4排放的影响程度更大.
[1] Van Kleunen M, Dawson W, Essl F, et al. Global exchange and accumulation of non-native plants [J]. Nature, 2015,525(7567):100- 103.
[2] Turbelin A J, Malamud B D, Francis R A. Mapping the global state of invasive alien species: patterns of invasion and policy responses [J]. Global Ecology and Biogeography, 2017,26(1):78-92.
[3] Barbier E B, Koch E W, Silliman B R, et al. Coastal ecosystem-based management with nonlinear ecological functions and values [J]. Science, 2008,319(5861):321-323.
[4] 宁立新,马 兰,周云凯,等.基于PSR模型的江苏海岸带生态系统健康时空变化研究 [J]. 中国环境科学, 2016,36(2):534-543.
[5] 布乃顺,杨 骁,黎光辉,等.互花米草入侵对长江口湿地土壤碳动态的影响 [J]. 中国环境科学, 2018,38(7):2671-2679.
[6] Chapman D, Purse B V, Roy H E, et al. Global trade networks determine the distribution of invasive non-native species [J]. Global Ecology and Biogeography, 2017,26(8):907-917.
[7] 郝小雨,周宝库,马星竹,等.氮肥管理措施对黑土玉米田温室气体排放的影响[J]. 中国环境科学, 2015,35(11):3227-3238.
[8] Nahlik A M, Mitsch W J. Methane emissions from tropical freshwater wetlands located in different climatic zones of Costa Rica [J]. Global Change Biology, 2011,17(3):1321-1334.
[9] Early R, Bradley B A, Dukes J S, et al. Global threats from invasive alien species in the twenty-first century and national response capacities [J]. Nature Communications, 2016,7:12485.
[10] Cheng X L, Luo Y Q, Xu Q, et al. Seasonal variation in CH4emission and its13C isotopic signature fromandsoils in an estuarine wetland [J]. Plant Soil, 2009,327(1/2): 85-94.
[11] Tong C, Wang W Q, Huang J F, et al. Invasive alien plants increase CH4emissions from a subtropical tidal estuarine wetland [J]. Biogeochemistry, 2012,111(1-3):677-93.
[12] Takakai F, Nagata O, Hatano R. Effect ofinvasion on CO2, CH4and N2O fluxes indominated poor fen in Bibai, Hokkaido, Japan [J]. Phyton-Annales Rei Botanicae, 2005,45(4):319-26.
[13] Emery H E, Fulweiler R W.and invasivestands have similar greenhouse gas emissions in a New England marsh [J]. Aquatic Botany, 2014,116(10):83-92.
[14] Cheng X L, Luo Y Q, Chen J Q, et al. Short-term C4plantinvasions change the soil carbon in C3plant-dominated tidal wetlands on a growing estuarine Island [J]. Soil Biology and Biochemistry, 2006,38(12):3380-3386.
[15] Zhang Y H, Ding W X, Cai Z C, et al. Response of methane emission to invasion ofand exogenous N deposition in the coastal salt marsh [J]. Atmospheric Environment, 2010,44(36):4588- 4594.
[16] Mcleod E, Chmura G L, Bouillon S, et al. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Frontiers in Ecology and the Environment, 2011,9(10):552-560.
[17] Wang Q, An S Q, Ma Z J, et al. Invasive: biology, ecology and management [J]. Acta Phytotaxonomica Sinica, 2006, 44(5):559-588.
[18] Zhang D H, Hu Y M, Liu M, et al. Introduction and spread of an exotic plant,, along coastal marshes of China [J]. Wetlands, 2017,37(6):1181-1193.
[19] Quan W M, Zhang H, Wu Z L, et al. Does invasion ofalter microhabitats and benthic communities of salt marshes in Yangtze River estuary? [J]. Ecological Engineering, 2016, 88(3):153-164.
[20] Yang W, Jeelani N, Leng X, et al.invasion alters soil microbial community composition and microbial respiration following invasion chronosequence in a coastal wetland of China [J]. Scientific Reports, 2016,6:26880.
[21] Chen H L, Li B, Hu J B, et al. Effects ofinvasion on benthic nematode communities in the Yangtze Estuary [J]. Marine Ecology-Progress Series, 2007,336(12):99-110.
[22] 布乃顺,胡 悦,杨 骁,等.互花米草入侵对长江河口湿地土壤理化性质的影响 [J]. 长江流域资源与环境, 2017,26(1):100-109.
[23] Yang S L, Li M, Dai S B, et al. Drastic decrease in sediment supply from the Yangtze River and its challenge to coastal wetland management [J]. Geophysical Research Letters, 2006,33(6):272-288.
[24] Li B, Liao C Z, Zhang X D, et al.invasions in the Yangtze River estuary, China: an overview of current status and ecosystem effects [J]. Ecological Engineering, 2009,35(4):511-520.
[25] Liao C Z, Luo Y Q, Jiang L F, et al. Invasion ofenhanced ecosystem carbon and nitrogen stocks in the Yangtze estuary, China [J]. Ecosystems, 2007,10(8):1351-1361.
[26] Bu N S, Qu J F, Li Z L, et al. Effects ofinvasion on soil respiration in the Yangtze River Estuary, China [J]. PLoS ONE, 2015,10(3):e0121571.
[27] Jiang L F, Luo Y Q, Chen J K, et al. Ecophysiological characteristics of invasiveand native species in salt marshes of Yangtze River estuary, China [J]. Estuarine, Coastal and Shelf Science, 2009,81(1):74-82.
[28] Howes B L, Dacey J W H, Goehringer D D. Factors controlling the growth form of: feedbacks between aboveground production, sediment oxidation, nitrogen and salinity [J]. Journal of Ecology, 1986,74(3):881-898.
[29] Peng R H, Fang C M, Li B, et al.invasion increases soil inorganic nitrogen pools through interactions with tidal subsidies in the Yangtze Estuary, China [J]. Oecologia, 2011,165(3): 797-807.
[30] Yan Y E, Zhao B, Chen J Q, et al. Closing the carbon budget of estuarine wetlands with tower-based measurements and MODIS time series [J]. Global Change Biology, 2008,14(7):1690-1702.
[31] Liao C Z, Luo Y Q, Fang C M, et al. Litter pool sizes, decomposition, and nitrogen dynamics in-invaded and native coastal marshlands of the Yangtze Estuary [J]. Oecologia, 2008,156(3): 589-600.
[32] Tokida T, Adachi M, Cheng W G, et al. Methane and soil CO2production from current-season photosynthates in a rice paddy exposed to elevated CO2concentration and soil temperature [J]. Global Change Biology, 2011,17(11):3327-3337.
[33] Yvon-durocher G, Montoya J M, Woodward G U Y, et al. Warming increases the proportion of primary production emitted as methane from freshwater mesocosms [J]. Global Change Biology, 2011,17(2): 1225-1234.
[34] Vandergon H, Neue H U. Influence of organic matter incorporation on the methane emission from a wetland rice field [J]. Global Biogeochemical Cycles, 1995,9(1):11-22.
[35] Zeleke J, Sheng Q, Wang J G, et al. Effects ofinvasion on the communities of methanogens and sulfate-reducing bacteria in estuarine marsh sediments [J]. Frontiers in Microbiology, 2013,4:342.
[36] Carmichael M J, Bernhardt E S, BR Uer S L, et al. The role of vegetation in methane flux to the atmosphere: should vegetation be included as a distinct category in the global methane budget? [J]. Biogeochemistry, 2014,119(1-3):1-24.
[37] Kutzbach L, Wagner D, Pfeiffer E M. Effect of microrelief and vegetation on methane emission from wet polygonal tundra, Lena Delta, Northern Siberia [J]. Biogeochemistry, 2004,69(3):341-362.
[38] Schaufler G, Kitzler B, Schindlbacher A, et al. Greenhouse gas emissions from European soils under different land use: effects of soil moisture and temperature [J]. European Journal of Soil Science, 2010, 61(5):683-696.
[39] Wang C H, Li B. Salinity and disturbance mediate direct and indirect plant-plant interactions in an assembled marsh community [J]. Oecologia, 2016,182(1):139-152.
[40] Ensign S H, Noe G B. Tidal extension and sea-level rise: recommendations for a research agenda [J]. Frontiers in Ecology and the Environment, 2018,16(1):37-43.
[41] 李俊龙,郑丙辉,张铃松,等.中国主要河口海湾富营养化特征及差异分析 [J]. 中国环境科学, 2016,36(2):506-516.
[42] Gratton C, Denno R F. Restoration of arthropod assemblages in asalt marsh following removal of the invasive plant[J]. Restoration ecology, 2005,13(2):358-372.
Effects ofinvasion on CH4emissions from wetlands of the Yangtze River estuary, China.
BU Nai-shun1,2,3, YANG Xiao1, GUO Hao1, YANG Ya-li1, ZHAO Yi-hui1, MA Fang3, LI Bo4, FANG Chang-ming4, YAN Zhuo-jun5*
(1.School of Environmental Science, Liaoning University, Shenyang 110036, China;2.State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China;3.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China;4.School of Life Science, Fudan University, Shanghai 200438, China;5.College of Chemistry, Liaoning University, Shenyang 110036, China)., 2018,38(10):3949~3958
, an invasive alien species, spreads rapidly in the coastal zones of China. It has become the most important invasive plant in coastal wetlands of China and has significant impacts on ecological structure and function of the key zone to the earth. CH4is an important greenhouse gas and second only to CO2. In order to investigate effects ofinvasion on CH4emission and reveal the potential underlying mechanisms of these effects in coastal wetlands of China, each transect was set up in the high and low marshes of wetlands in the Yangtze River estuary, respectively. A pair-wise experimental design between(invasive plant) and(native plant) stands in the high marsh, andand(native plant) stands in the low marsh, was used at each site of the two transects to minimize the potential effects of background heterogeneities. Compared with native plant stands,invasion significantly increased plant biomass. Invasion-increase in plant biomass was significantly higher in the high marsh than that in the low marsh, which is beneficial to carbon accumulation in the early succession of coastal ecosystem.invasion also significantly increased soil moisture, soil organic carbon content, soil nitrogen content, soil microbial biomass carbon and nitrogen contents of coastal wetlands of China. CH4emission rates were significantly higher underthanstands in the high marsh, with mean values of (0.68 ± 0.08) mg/(m2·h) and (0.21 ± 0.01) mg/(m2·h), respectively. In the low marsh, mean CH4emission rate understands was (8.31 ± 0.50) mg/(m2·h) during the study period, which was significantly higher than that understands ((8.31 ± 0.50) mg/(m2·h)). The difference in mean CH4emission betweenandstands in the high marsh ((0.47 ± 0.08) mg/(m2·h)) was significantly lower than that betweenandstands in the low marsh ((4.37 ±0.48) mg/(m2·h)). Our results indicated that theinvasion significantly enhanced CH4emissions from coastal wetlands of China, probably mainly through improving the quality and quantity of substrates required for CH4production, increasing soil microbial biomass and moisture. The invasion-related CH4emissions were highly spatially variable; this variability may have been driven by the soil’s anaerobic environments, induced by hydrological dynamics. These results can be applied to more reliably estimate and predict invasion-induced changes in CH4emissions from wetlands in the context of global climate change. These results also can provide theoretical basis and scientific support for scientific management and rational utilization of coastal zone resources as well as coping with global climate change.
biological invasion;CH4emissions;;wetlands of the Yangtze River estuary
X171
A
1000-6923(2018)10-3949-10
布乃顺(1982-),男,山东阳谷人,讲师,博士,主要研究方向为温室气体排放与碳氮循环.发表论文10余篇.
2018-04-03
辽宁省教育厅科学技术研究项目(LYB201615);辽宁省博士启动基金项目(20170520069);国家水体污染控制与治理科技重大专项(2015ZX07202-012);国家自然科学基金项目(21704037);河口海岸学国家重点实验室开放基金资助项目(SKLEC-KF201713);城市水资源与水环境国家重点实验室开放基金项目(ES201809);辽宁大学大学生创新创业训练计划项目
* 责任作者, 讲师, zjyan@lnu.edu.cn
