微生物在多孔介质中环境行为研究
2018-10-29张文静秦运琦马添翼厉晓飞
张文静,秦运琦,刘 丹,马添翼,厉晓飞
微生物在多孔介质中环境行为研究
张文静1,2*,秦运琦1,2,刘 丹1,2,马添翼1,2,厉晓飞1,2
(1.吉林大学地下水资源与环境教育部重点实验室,吉林 长春 130021;2.吉林大学新能源与环境学院,吉林 长春 130021)
多孔介质中的致病细菌及病毒等病原微生物迁移研究对保护饮用水资源具有重要意义.在归纳总结国内外已有研究资料的基础上,对微生物在多孔介质中迁移行为进行了分析.研究表明病原微生物作为生物胶体的一种,在迁移过程中受多种迁移机制共同作用.除常见水动力条件和水化学条件外,微生物在迁移过程中还受自身性质,介质颗粒及环境因素的影响.在此基础上,分别讨论了微生物在饱和多孔介质与非饱和多孔介质中的迁移行为,并对近年来研究热点及进展进行了简要概括.目前微生物在地下水中迁移研究日益丰富,但由于地下环境复杂性,微生物的易变异性,对于地下水系统中微生物造成的污染去除修复还需进一步探讨.
微生物;多孔介质;迁移机制;生物胶体;运移和沉积
研究发现,由于污水处理不当使得含水层,地下水和饮用水中都存在大量致病微生物,对土壤及地下水造成严重污染[1-3].胶体由于其具有较大的比表面积及大量吸附位点可作为一种吸附载体.在地下水资源保护方面,胶体可实现对地下水系统中其他微量元素及有机组份的协同迁移,同时对去除污染物也有重要作用[4].病原微生物如病毒, 细菌等属于生物胶体范畴,在地下水系统中不但可以自身迁移,也可作为载体实现与其他污染物的协同迁移.因此探讨微生物在多孔介质中的迁移不仅对地下水资源保护,地下水中病原体风险评估具有重大意义,也对生物修复治理,供水系统设计具有重大意义.
病毒及细菌常被用作生物指示剂,反映生物胶体在多孔介质中的迁移情况.为探究微生物在多孔介质中的运移过程,国内外学者开展了大量室内柱实验及场地试验.孔隙尺度可视化技术的改进为微生物在饱和及非饱和介质中的迁移研究提供了便利[1].随着研究的不断深入,国内外专家在实验设计、理论研究、测试方法、探究内容等方面都有较新进展.我国学者毕永强等[2]发现采油微生物在多孔介质中运移受到平衡吸附和架桥筛分的共同作用.同时唐朱睿等[3]指出胞外呼吸菌在与污染物协同迁移中可以降解污染物,对污染物原位修复上具有重大意义.本课题组主要讨论了不同水动力、水化学条件下,大肠杆菌噬菌体在饱和多孔介质及非饱和多孔介质中的迁移转化,同时对噬菌体与其他胶体的协同迁移展开探讨[4-5].在指示微生物选择方面,相比于常见的陆地微生物, Ghanem等[6]选取了海洋噬菌体探究其在多孔介质中的迁移规律.同时微生物与其他胶体或污染物的协同作用也成为当先研究热点.Walshe等[7]研究发现高岭石胶体的存在可以促进病毒砾石含水层中的迁移.这些研究为保护地下水资源、饮用水资源和评估病原体污染的风险提供了诸多参考资料.
本文在检索国内外相关研究的基础上,主要总结了微生物在多孔介质中迁移的研究现状与研究进展,对其在多孔介质中的沉积与迁移机制进行了总结与讨论.同时对微生物在饱和多孔介质与非饱和多孔介质中的迁移行为进行分析,并总结了微生物在多孔介质中的研究热点,为今后微生物在多孔介质中的迁移研究提供依据与参考.
1 微生物在多孔介质中的迁移机理
微生物在多孔介质中的迁移过程实际上是胶体随水流在孔隙中的运移过程[8].在运移中,胶体会发生运移、释放、沉积.迁移过程受多种机制共同作用,同时也受到胶体粒径、介质颗粒大小、介质形状、表面粗糙程度、孔隙尺寸、孔隙水化学性质等因素影响[9].迁移机理的中文表述目前国内还未统一,这里给出较常用的表述方法.微生物在地下多孔介质运移过程图参照Zhong等[10]对生物表面活性剂增细菌在多孔介质中的迁移研究见图1.
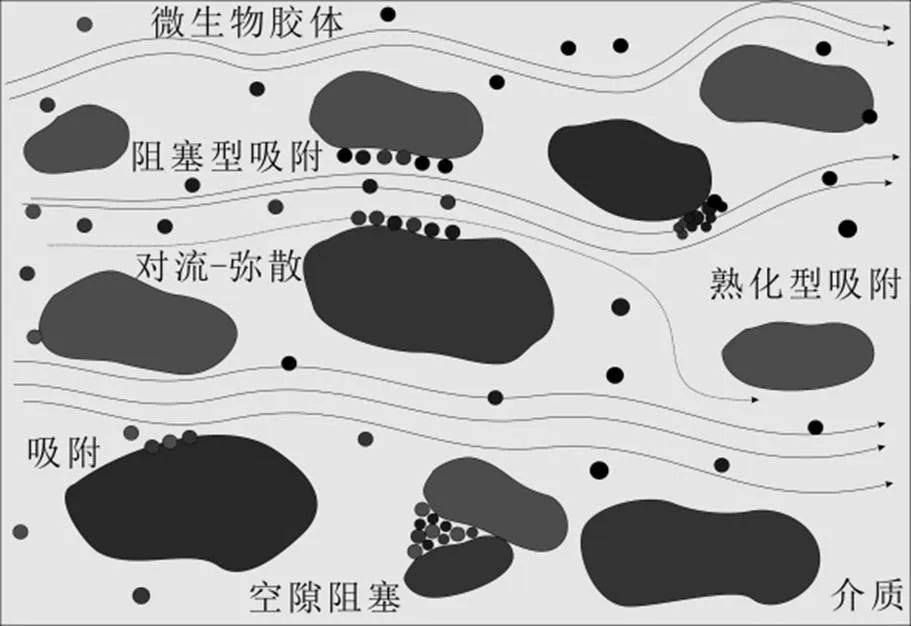
图1 微生物在地下多孔介质中运移过程示意
1.1 对流-弥散
微生物作为生物胶体,在多孔介质中的迁移受地下水水力驱动,与溶质运移基本相似.微生物在随孔隙水运动时会发生对流,受水力梯度,孔隙度和渗透率等影响[11].由于流场的不均一性以及胶体在通过多孔介质时发生扭转,对流过程中也会产生弥散.由于布朗运动引起的扩散与分子或胶体颗粒的质量成反比,因此溶质迁移程度比生物胶体高.流场具有复杂的孔隙网络,粒径较小的微生物更易沿流线运动至滞留区,在滞留区发生沉积.对于较大的微生物,相比于扩散阻塞占主导地位.
1.2 孔隙阻塞
孔隙阻塞同样被认为是自然环境中影响微生物迁移的重要机制[12-13].孔隙阻塞是指多孔介质的部分孔隙由于过小而不能使生物胶体通过的过程[14-15].孔隙阻塞速率系数与胶体和介质直径的比值呈线性正相关[15-16].介质颗粒的形状与大小具有不规则性,其表面粗糙程度也被认为是影响孔隙阻塞发生的重要因素[17-20].自然条件下,由于颗粒组成复杂,多孔介质的孔隙尺寸范围较大[21].同时研究指出物理、化学因素以及流动流体力学因素共同影响多孔介质中的胶体孔隙阻塞[22].
1.3 吸附
在多孔介质中孔隙的尺寸远大于微生物粒径,因此微生物在多孔介质中的主要的沉积行为为吸附[23].静电作用力、范德华力、疏水作用力等共同影响微生物沉积于多孔介质表面[24].基于DLVO 理论,微生物颗粒的吸附过程可以分为可逆吸附和不可逆吸附.可逆吸附是一种微生物与介质之间相对较弱的相互作用,作用强度取决于溶液中离子强度及化学成分.不可逆吸附是一种涉及大量能量的永久相互作用.随着离子强度的增加势垒逐渐消失,微生物在介质表面发生不可逆沉积[8].疏水相互作用是影响细菌粘附的一个重要因素[25].
1.4 沉积
沉积作用同样被认为是影响微生物在多孔介质中沉积的重要影响因素[26].这里介绍两种沉积机制(阻塞型沉积和熟化型沉积).阻塞型沉积是指当微生物沉积于介质表面时会减少其他细胞附着的附着面积[27].国外学者早期研究发现,阻塞型沉积的发生会降低胶体对土壤的整体沉积,并且沉积发生时对介质的覆盖与胶体的类型有关[28].熟化型沉积是指已经沉积于介质的微生物作为额外的收集器为在多孔介质中移动的生物胶体提供沉积位点.当微生物沉积于介质表面时会增加沉积点位进而促进其他胶体粒子的沉积.
2 微生物环境行为研究理论及检测方法
描述微生物在多孔介质中的行为特征与胶体相似,大多采用依据穿透曲线计算胶体质量回收率,对胶体沉积与运移进行判断[29-30].利用DLVO理论,判断胶体在水溶液中的稳定情况,进而判断胶体的沉积与运移为微生物在多孔介质中的运移行为影响提供理论依据[31-32].除此之外随着研究的不断发展,在基本理论基础之上,新的研究理论不断丰富来支撑研究结果.在这里给出几种经典理论及最新理论研究.
2.1 Re及质量回收率
R是生物胶体穿透曲线质心和示踪剂穿透曲线质心的比值,通常反映了在整个实验过程(包括注入和冲洗阶段)流速对微生物迁移的影响[33].微生物(或示踪剂)的质量回收率则表示细菌及病毒在实验过程中的流出端检测到的迁移量占注入胶体总量的百分比,反映微生物在多孔介质迁移过程中沉积量与迁移量的关系.本课题组前期在探究病毒在饱和多孔介质的实验中,选用碘化钾作为示踪剂,并计算R值.结果表明随着离子强度的增加R值随之增加,说明胶体病毒的迁移率逐渐降低[4].
除测量出流处质量回收率外,近期研究中还对沉积在介质上的胶体计算质量回收率. Dong等[34]在迁移实验后,将石英砂分为10份放入带有福尔马林及NaOH的水溶液中震荡30min,使吸附于介质表面的大肠杆菌解吸,计算其质量回收率.这种方法使得沉积量的计算更为精确,但也不排除微生物自身失活等带来的误差.
2.2 胶体过滤理论
胶体过滤理论基于一维对流扩散方程来研究胶体在多孔介质中的迁移规律.经典胶体过滤理论定量比较了生物胶体在介质上的附着情况,用胶体沉积速率常数(att)反映胶体沉积速率的大小[35]. Syngouna等[36]在探究人腺病毒与黏土胶体和二氧化钛纳米颗粒协同迁移的实验中,利用胶体过滤理论判断病毒在多孔介质表面的沉积情况.计算结果表明,在协同条件下碰撞效率随流速增加而增大.说明在较大流速下,病毒在被介质吸附的概率更大.
然而研究表明经典胶体过滤理论也有一定的局限性.Sasidharan等[37]认为依据胶体过滤理论研究细菌在多孔介质中的迁移和滞留时通常假设影响因素与流速无关.然而随着研究发现,流速明显影响胶体过滤理论中的众多参数.
2.3 DLVO理论及XDLVO理论
DLVO理论常被用来描述生物胶体在多孔介质中的稳定性[38].胶体颗粒之间或颗粒与介质之间存在相互吸引的范德华力和相互排斥的静电斥力.两者之间的合力反映胶体颗粒是发生吸附聚沉还是保持分散稳定的状态[33].Syngouna等[39]指出当总的势能为正,表明胶体间为斥力,胶体在悬浮液中较为稳定,不易发生沉积.势垒的变化与介质表面粗糙度密切相关.介质表面越粗糙,微生物与介质之间的势垒越低[40].
研究发现由于存在范德华力及静电力以外的作用力,传统的DLVO理论并不能很好地解释实验结果.随着探究的不断深入,国内外专家学者提出了扩展DLVO(XDLVO)理论. Attinti等[41]用DLVO及XDLVO理论讨论了人类肠道病毒在有针铁矿包覆的砂表面沉积情况.Park等[31]利用DLVO理论与XDLVO理论表征大肠杆菌噬菌体在氧化铁包覆的砂上沉积情况,其计算结果没有明显不同.事实上XDLVO理论中除考虑静电力及范德华力外还考虑疏水作用力,对比可知在沉积过程中疏水作用力不起主要作用.Bai等[42]在讨论在非饱和条件下细菌多孔介质中的沉积发现初级势阱不存在,表明细菌在固-水及气-水界面上不会发生沉积.
2.4 检测方法
微生物在多孔介质中迁移研究除用到上述的理论基础外,还有许多检测手法来表征胶体在多孔介质中的迁移行为.电镜扫描(SEM)是常见测试手法,主要用来观察微观条件下介质颗粒表面特征,微生物自身形状,及胶体在多孔介质中的沉积情况[4].马尔文检测在微生物迁移研究中用来判断不同条件下微生物表面电势及粒径大小[42].这里总结了微生物研究中常见的几种检测方法见表1.
在基础的检测方法上,一些新的检测手段也被广泛用于微生物迁移实验中.磁共振成像被用来研究微生物在微观孔隙中的行为[43].原子力显微镜(AFM)具有高精度以及高灵敏度,被用来探究微生物的立体形态和结构等[44].Wang等[45]用SEM及AFM检测胶体的粒径高度及形态等.在其他物质的行为判断中,一些学者利用三维荧光光谱技术探究如苯乙烯等有机物,以探究污水处理情况[46-47].三维荧光光谱技术在微生物方面的应用有待验证.
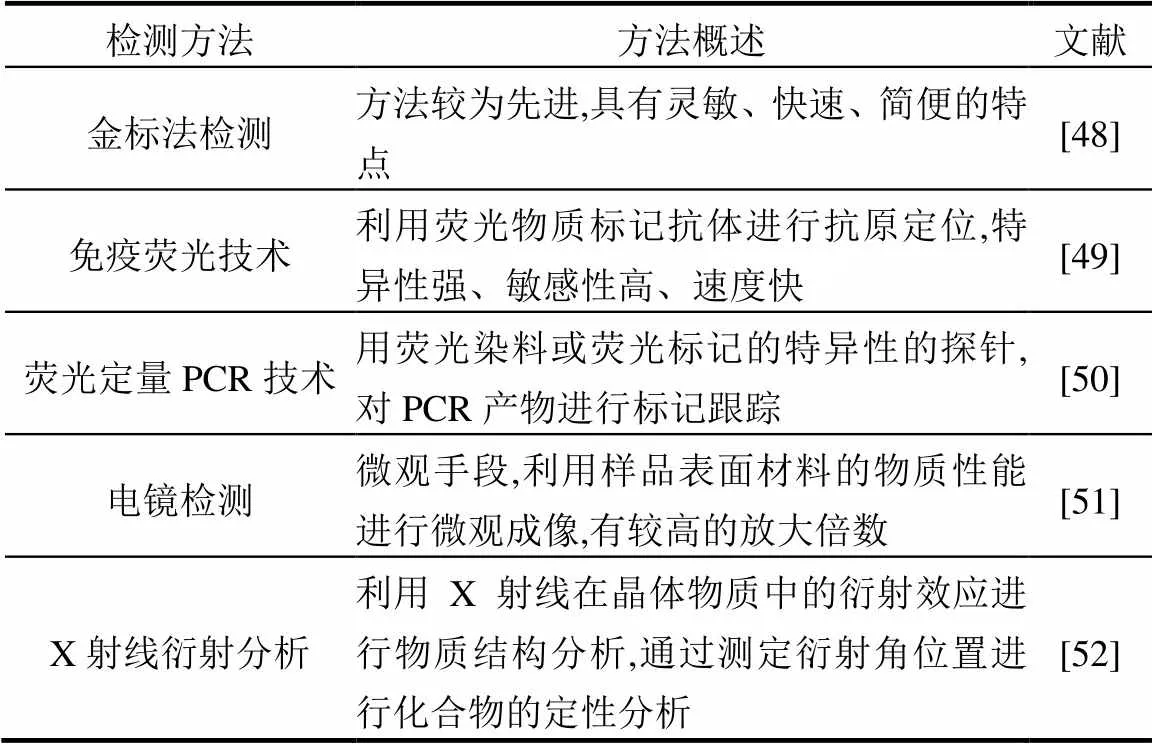
表1 地下水中常见微生物检测方法
3 微生物在多孔介质中迁移影响因素
微生物在多孔介质中迁移受诸多因素影响.除胶体自身性质和介质外,水动力、水化学因素,及环境因素都会对微生物迁移产生影响[38].近年来,国内外专家除对单一因素开展更为细致深入的讨论外,对多种因素协同作用进行了分析研究,同时对微生物与其他胶体及污染物的协同作用也开展了大量探究.尽管如此微生物在多孔介质中的迁移仍是极为复杂的过程,需要不断深入思考.
3.1 胶体自身因素
关于微生物自身性质对其在多孔介质中迁移的影响,随着探究的深入及拓展得到不断发展.一些研究表明微生物自身形态及粒径大小主要影响生物胶体在多孔介质中的阻塞和吸附过程[53-54]. Pelley等[55]指出胶体粒径越大与多孔介质发生碰撞效率的机会越大.关于细胞自身结构探究,早期Gannon等[53]认为细胞在土壤中的迁移与其大小密切相关,与鞭毛的存在无关.近来一些学者通过研究发现,鞭毛可使细胞自身具有运动能力,增加细胞与介质表面的碰撞效率,从而增强细菌的吸附能力[56].其他类型生物胶体则主要靠水流或布朗运动向介质表面移动[57].
在病毒研究方面,除常见的大肠杆菌噬菌体(MS2,T-3,ΦX174)外,人腺病毒(hAdVs)也用作探究对象来研究病毒微生物在多孔介质中的迁移. Kokkinos等[58]指出相同孔隙水流速实验条件下,人腺病毒的质量回收率都小于大肠杆菌噬菌体.近些年海洋噬菌体作为新的指示剂来探究微生物在多孔介质中的迁移.Ghanem等[6]通过5种海洋噬菌体及两种常见大肠杆菌噬菌体探究噬菌体大小,形态及表面性质对其在多孔介质中迁移的影响.
3.2 水动力及水化学因素
微生物在多孔介质中迁移受水动力条件影响,迁移行为随扰动强度的变化而变化.此外, Vasilladou等[59]研究发现较高的孔隙水速度会导致细菌在介质中的停留时间缩短,从而降低细菌吸附的可能性.Masciopinto等[60]指出裂隙流的扰动会导致病毒的再悬浮,土壤的不均一性也会使在裂隙水流中产生较强的瞬时解吸.
近年来,对水动力因素研究更为细致,研究发现,流速影响众多参数变化.Sasidharan等[61]从介质表面的相互作用能、细胞停留时间和转矩平衡等方面讨论孔隙水流速影响大肠杆菌在多孔介质中迁移行为.研究发现随着滞留时间的增加及流速的减小,细胞与介质表面的粘滞力增加.
微观角度及生物化学角度应用于解释水化学条件对微生物迁移的影响.pH值的增加会导致细胞壁中羧基和氨基基团的离解,从而使细胞表面带负电荷.使微生物在多孔介质中的沉积量降低[62]. Zhang等[63]认为离子强度的增加会促进细菌及病毒的吸附,主要原因是由于离子强度的增加会在生物沉积过程中使势垒衰减.多价阳离子具有增强细胞吸附和减少细胞迁移的能力[64-65].与单价阳离子相比,二价离子(如Mg2+和Ca2+)的存在明显减弱了细菌的转运[66].
由于地下水环境的复杂性,对其他盐溶液也进行了讨论研究.在考虑离子强度对细菌迁移影响的同时,探讨多种因素的协同作用机制.Dong等[34]研究表明悬浮液中的硅酸盐存在使细菌在无铁包覆的石英砂中迁移量减少.相比之下,在有铁矿物包覆砂中迁移量增加.原因推测为硅酸盐离子会与细菌争夺有铁矿物包裹砂上的吸附点位.
3.3 介质颗粒因素
介质颗粒大小及介质表面性质同样影响微生物在多孔介质中的迁移.Chrysikopoulos等[67]认为MS2和ΦX174在石英砂上的沉积主要取决于石英砂的粒径大小,噬菌体的沉积与介质颗粒的大小呈负相关.
多孔介质表面结构复杂多样.一些多孔介质表面含有金属氧化物等矿物改变介质表面电荷,对微生物的吸附和迁移具有影响[31,62].Yang等[68]研究发现附着在多孔介质表面的有机物会增加阳离子交换能力,从而影响细菌的迁移.同时Dong等[69]指出在硅酸盐会与大肠杆菌争夺铁矿包覆砂上的吸附点位,促进细菌的迁移.Bozorg等[70]研究发现,相比于单一的玻璃珠,有生物膜包裹的玻璃珠对微生物的吸附量更大.
天然环境下,由于粘土颗粒的比表面积较高,使微生物与土壤颗粒间的作用力较强[59,71-72].Balkhair等[73]指出,相比于农业土壤,粪便细菌在城市土壤的沉积量更多,推测可能由于城市土壤大多为粒径较小的砂,介质面积更大有利于细菌的沉积.同时相比于农业环境,城市中水流速较低同样有利于细菌沉积.
3.4 其他因素
微生物浓度同样影响生物胶体在多孔介质中的迁移和沉积[74].Zhang等[75]认为,病毒在介质表面沉积量是浓度的函数,增加注入病毒的浓度可以增加胶体在介质表面的沉积.温度是决定吸附动力学和热力学的关键因素.温度影响细胞表面疏水性、细胞外聚合物在细菌表面的构造[23,76-77].同时温度对微生物的活性也具有影响[8].Chrysikopoulos等[67]指出,在静态条件下,温度对石英砂吸附病毒有显著影响.
表面活性剂具有修饰细菌细胞和多孔介质表面性质的能力成为研究热点.Grna等[78]和Zhang等[79]指出表面活性剂降低了细菌的表面疏水性,增强了细菌在多孔介质中的迁移能力.由于细胞表面存在羧基和磷酸盐等阴离子表面基团,细菌细胞表面带负电荷.离子表面活性剂可以通过附着在细胞表面改变细菌细胞表面电荷,来中和或增强细胞表面的原始表面电荷[80].
4 微生物在多孔介质中的迁移
地下水环境结构复杂,微生物作为生物胶体,既可以独自在多孔介质中迁移,也可与污染物结合通过多孔介质到达地下含水层[81].研究微生物在多孔介质中的沉积迁移情况,对保护地下水资源,实现地下水修复具有重要意义.图2为微生物在对饱和多孔介质及非饱和多孔介质中迁移示意.
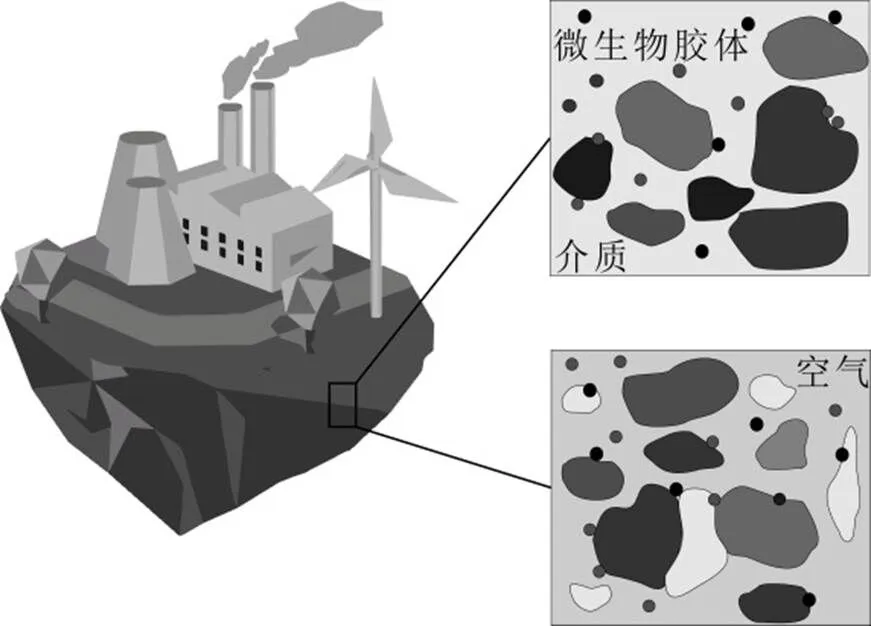
图2 微生物在对饱和多孔介质和非饱和多孔介质中迁移示意
4.1 微生物在饱和多孔介质中迁移
饱和多孔介质主要指地下水系统中的饱水带,又称饱和带.饱水带岩石孔隙全部为液态水充满,且水体是连续分布的,在具有水头差的作用下可发生连续运动.在饱和多孔介质条件下,不同水动力条件及不同水化学条件成为影响胶体迁移的主要影响因素[12,61,82-83].微生物在饱和多孔介质中的沉积和运移行为一直受到众多学者的关注与研究.
从理论上讲,微生物随流体在介质中运移时,受水动力的影响会沿流体的流线方向运动,当流线与介质颗粒表面之间的距离小于微生物的半径时,细菌及病毒被拦截于介质表面.微生物的布朗运动也会使自身接近于介质表面时,发生吸附.微生物还受到重力的影响沉积于介质表面,即重力沉降[29].对微生物在饱和多孔介质中的迁移规律研究大多在实验室利用柱子实验进行.理论研究及实验研究都探讨了孔隙水溶液化学,流体速度,介质结构,温度等诸多条件的作用[61,67,84].微生物的迁移能力与其表面电荷密切相关[85].研究表明, pH值在2~8的范围内,微生物普遍带负电[86].微生物表面负电荷减少,降低微生物与介质间的斥力,抑制了细胞的迁移. Huysman等[87]研究发现表面疏水的细菌及病毒能更有效的吸附于介质表面.微生物的稳定性也受表面疏水性影响[88].若微生物为疏水性胶体则较不稳定,易聚集成大颗粒,影响胶体在饱和多孔介质中的迁移[89].
Syngouna等[36]指出在饱和多孔介质条件下人腺病毒的迁移受黏土及纳米颗粒影响,协同迁移的过程中,随着流速增加,胶体颗粒的碰撞效率也随之增加.Zhang等[90]对饱和条件下病毒与针铁矿间的相互作用开展了室内实验.研究表明,随着溶液pH值的降低,噬菌体在针铁矿上的附着量增加.王芳等[91]指出水体中胶体对铜绿微囊藻生长具有促进作用.朱维晃等[92]探讨了微生物异化还原针铁矿胶体的动力学特征及影响因素为有机物及重金属造成的水环境污染提供参考.
4.2 微生物在非饱和多孔介质中迁移
微生物通常由土壤表面或随污水废水,化粪池系统等进入地下环境.相比于饱和地下水系统,微生物在非饱和系统下的沉积及迁移行为更加复杂[32].除了在饱和多孔介质中发生的沉积机制外,由于气相的存在为胶体沉积提供了新的吸附位点会使病毒的迁移与沉积发生改变[93-94].微生物在非饱和多孔介质中的行为本质上是与空气、水和固体颗粒相互接触的行为.此外,在非饱和多孔介质中,微生物可以在包裹于介质颗粒的薄膜中保留下来[95-96].
微生物在非饱和多孔介质中的迁移同样受到水动力和水化学因素的影响.当非饱和多孔介质存在时,瞬态效应更加复杂.非饱和介质中存在优先流,同时非均匀性会引起流速的较大变化增加扩散.Mitropoulou等[32]研究了不同饱和条件下亲水性乳胶粒的迁移和沉积行为,发现随着含水量的降低,胶体沉积速率增加.地下水中瞬变流的条件,及变饱水度对病毒沉积于固-水界面及气-水界面产生连续再分配.微生物颗粒之间的相互作用可以聚集成团运移或吸附于介质表面,也可以与多孔介质体系中的气泡一同运移.人们生产生活中的农业灌溉,人工回灌及自然界中的降雨入渗,也会对微生物形成再分配进而影响微生物的迁移过程.
国外学者开展了病毒在饱水带和包气带迁移行为研究的室内柱实验,实验表明由于气体的存在,病毒在非饱和介质中的沉积量明显高于饱和介质中的沉积量.并且介质含水量越低,沉积的病毒量越多[30].Torkzaban等[97]和Kim等[98]针对气-水界面在非饱和介质中对微生物沉积的影响展开了实验研究,结果表明静电作用对微生物在气-水界面上沉积的影响比微生物自身的亲疏水性要强.其他探究指出,溶液的离子强度会显著影响生物胶体的沉积和迁移[99].随着离子强度的降低,细菌对带负电荷石英砂的粘附效率和粘附率降低[100].这是由于细菌单收集器表面的双电层厚度增加.
5 微生物在多孔介质中迁移进展讨论与展望
随着研究的不断发展,对微生物在多孔介质中迁移行为的研究更为深入,研究角度更为开阔.由于地下环境中物质的复杂多样性,除常见的影响因素外,一些专家学者考虑到多学科交叉影响,对生物因素也进行了讨论.Zhong等[101]讨论了低浓度的鼠李糖脂对铜绿假单胞菌在理想多孔介质种的迁移影响.实验过程中选取表面亲水及表面疏水的玻璃珠用作填充介质.结果表明表面疏水介质对细菌在多孔介质表面沉积具有重要作用,低浓度的鼠李糖脂促进细菌在介质中的迁移.Dan等[102]还探究了双酚A(Bisphenol A)对细菌在石英沙中迁移的影响,结果表明分子疏水性使双酚A与细菌竞争介质表面的吸附位点增加细菌在多孔介质中的迁移量.袁瑞强等[103]认为在不利的吸附条件下,通过提高环境的pH值可以使吸附在初级势阱中的胶体解吸下来,从而降低胶体的吸附能力.
依据已有的室内实验研究,微生物在多孔介质中的行为在实际场地进行开展.Kvitsand等[52]认为在流速较快的场地条件,寒冷的气候中和氧化物的存在阻碍了病毒的迁移,同时降低了病毒的活性.同时场地环境中存在优先流以及污染物的可逆吸附会增加污染物运移的风险.在低氧环境下微生物的去除是有限的.Hornstra等[104]研究表明,在低氧条件下,迁移时间、垂向迁移距离以及孔隙水流速均对病毒的迁移具有影响.同时微模型及流通池被用来研究细菌及病毒的沉积与解吸[105-107].
对于今后微生物在多孔介质中的迁移研究,应在已有的研究理论基础上继续丰富研究方法和测试手段,为微生物在多孔介质中迁移提供可靠依据.同时多种因素的共同作用对微生物的迁移影响仍需进一步探究.相比于饱和多孔介质,微生物在非饱和多孔介质中的迁移更为复杂.由于气-水界面的存在,对微生物在多孔介质中的迁移有胶体影响.探究不同水动力水化学因素及环境因素对生物胶体在非饱和多孔介质中的迁移影响对地下水污染修复具有重大意义.微生物与其他胶体及污染物的协同迁移同样对地下水污染治理具有重要意义.在修复已污染的地下水过程中,地下水的保护及污染物的源头治理更为重要,应引起广泛关注.
[1] Flury M, Aramark S. Role of air-water interfaces in colloid transport in porous media: A review [J]. Water Resources Research, 2017,53(7): 5247-5275.
[2] 毕永强,俞 理,修建龙,等.采油微生物在多孔介质中的迁移滞留机制 [J]. 石油学报, 2017,38(1):91-98.
[3] 唐朱睿,黄彩红,高如泰,等.胞外呼吸菌在污染物迁移与转化过程中的应用进展 [J]. 农业资源与环境学报, 2017,34(4):299-308.
[4] Zhang W, Li S, Wang S, et al. Transport of Escherichia coli phage through saturated porous media considering managed aquifer recharge [J]. Environmental science and pollution research international, 2018, 25(7):6497-6513.
[5] 李 硕,苏 杰,高 峰,等.地下水酸碱环境对肠道病毒胶体迁移规律的影响 [J]. 吉林大学学报(理学版), 2018,56(2):452-455.
[6] Ghanem N, Kiesel B, Kallies R, et al. Marine Phages As Tracers: Effects of Size, Morphology, and Physico-Chemical Surface Properties on Transport in a Porous Medium [J]. Environmental science & technology, 2016,50(23):12816-12824.
[7] Walshe G E, Pang L, Flury M, et al. Effects of pH, ionic strength, dissolved organic matter, and flow rate on the co-transport of MS2bacteriophages with kaolinite in gravel aquifer media [J]. Water Research, 2010,44(4):1255-1269.
[8] 肖 波,赵允格.病毒在土壤和地下水中迁移研究综述 [J]. 土壤通报, 2006,37(1):177-183.
[9] 赵炳梓,张佳宝.病毒在土壤中的迁移行为 [J]. 土壤学报, 2006, (2):306-313.
[10] Zhong H, Liu G, Jiang Y, et al. Transport of bacteria in porous media and its enhancement by surfactants for bioaugmentation: A review [J]. Biotechnol Adv, 2017,35(4):490-504.
[11] Ginn T R, Wood B D, Nelson K E, et al. Processes in microbial transport in the natural subsurface [J]. Advances In Water Resources, 2002,25(8-12):1017-1042.
[12] Foppen J W, Van H M, Schijven J. Measuring and modelling straining of Escherichia coli in saturated porous media. [J]. Journal of Contaminant Hydrology, 2007,93(1):236-254.
[13] Bradford S A, Simunek J, Walker S L. Transport and straining of E-coli O157: H7in saturated porous media [J]. Water Resources Research, 2006,42(12):150-152.
[14] Bradford S A, Torkzaban S. Colloid transport and retention in unsaturated porous media: A review of interface-, collector-, and pore-scale processes and models [J]. Vadose Zone Journal, 2008,7(2): 667-681.
[15] Foppen J W A, Mporokoso A, Schijven J F. Determining straining of Escherichia coli from breakthrough curves [J]. Journal of contaminant hydrology, 2005,76(3/4):191-210.
[16] Porubcan A A, Xu S P. Colloid straining within saturated heterogeneous porous media [J]. Water Research, 2011,45(4):1796- 1806.
[17] Auset M, Keller A A. Pore-scale processes that control dispersion of colloids in saturated porous media [J]. Water Resources Research, 2004,40(3):114-125.
[18] Bradford S A, Simunek J, Bettahar M, et al. Modeling colloid attachment, straining, and exclusion in saturated porous media [J]. Environmental science & technology, 2003,37(10):2242-2250.
[19] Keller A A, Auset M. A review of visualization techniques of biocolloid transport processes at the pore scale under saturated and unsaturated conditions [J]. Advances In Water Resources, 2007,30(6/7): 1392-1407.
[20] Xu S P, Liao Q, Saiers J E. Straining of nonspherical colloids in saturated porous media [J]. Environmental science & technology, 2008,42(3):771-778.
[21] Santos A, Barros P H L. Multiple Particle Retention Mechanisms during Filtration in Porous Media [J]. Environmental science & technology, 2010,44(7):2515-2521.
[22] Bradford S A, Torkzaban S, Walker S L. Coupling of physical and chemical mechanisms of colloid straining in saturated porous media [J]. Water Research, 2007,41(13):3012-3024.
[23] Stevik T K, Aa K, Ausland G, et al. Retention and removal of pathogenic bacteria in wastewater percolating through porous media: a review [J]. Water Research, 2004,38(6):1355-1367.
[24] Zhong H, Zeng G M, Liu J X, et al. Adsorption of monorhamnolipid and dirhamnolipid on two Pseudomonas aeruginosa strains and the effect on cell surface hydrophobicity [J]. Applied Microbiology & Biotechnology, 2008,79(4):671-677.
[25] Chakraborty S, Mukherji S, Mukherji S. Surface hydrophobicity of petroleum hydrocarbon degrading Burkholderia strains and their interactions with NAPLs and surfaces [J]. Colloids And Surfaces B-Biointerfaces, 2010,78(1):101-108.
[26] Nascimento A G, Totola M R, Souza C S, et al. Temporal and spatial dynamics of blocking and ripening effects on bacterial transport through a porous system: A possible explanation for CFT deviation [J]. Colloids And Surfaces B-Biointerfaces, 2006,53(2):241-244.
[27] Schinner T, Letzner A, Liedtke S, et al. Transport of selected bacterial pathogens in agricultural soil and quartz sand [J]. Water Research, 2010,44(4):1182-1192.
[28] Camesano T A, Unice K M, Logan B E. Blocking and ripening of colloids in porous media and their implications for bacterial transport [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 1999,160(3):291-307.
[29] 张文静,周晶晶,刘 丹,等.胶体在地下水中的环境行为特征及其研究方法探讨 [J]. 水科学进展, 2016,27(4):629-6238.
[30] Torkzaban S, Hassanizadeh S M, Schijven J F, et al. Virus Transport in Saturated and Unsaturated Sand Columns [J]. Vadose Zone Journal, 2006,5(3):877-885.
[31] Park J A, Kim S B. DLVO and XDLVO calculations for bacteriophage MS2 adhesion to iron oxide particles [J]. Journal of Contaminant Hydrology, 2015,181:131-140.
[32] Mitropoulou P N, Syngouna V I, Chrysikopoulos C V. Transport of colloids in unsaturated packed columns: Role of ionic strength and sand grain size [J]. Chemical Engineering Journal, 2013,232(232): 237-248.
[33] 于喜鹏.人工回灌条件下病毒在饱和多孔介质中的迁移规律研究 [D]. 长春:吉林大学, 2016.
[34] Dong Z, Yang H, Wu D, et al. Influence of silicate on the transport of bacteria in quartz sand and iron mineral-coated sand [J]. Colloids & Surfaces B Biointerfaces, 2014,123:995-1002.
[35] Sutton G, Kiyosaki R T. Rich Dad's Advisors®: The ABC's of Writing Winning Business Plans: How to Prepare a Business Plan That Others [J]. Environmental science & technology, 1991,25(1):178-85.
[36] Syngouna V I, Chrysikopoulos C V, Kokkinos P, et al. Cotransport of human adenoviruses with clay colloids and TiO2nanoparticles in saturated porous media: Effect of flow velocity. [J]. Science of the Total Environment, 2017,598:160-167.
[37] Sasidharan S, Bradford S A, Torkzaban S, et al. Unraveling the complexities of the velocity dependency of E. coli retention and release parameters in saturated porous media. [J]. Science of the Total Environment, 2017,603-604:406-415.
[38] Hong Z, Zhao G, Chen W, et al. Effects of solution chemistry on bacterial adhesion with phyllosilicates and goethite explained by the extended DLVO theory [J]. Geomicrobiology Journal, 2014,31(5): 419-430.
[39] Syngouna V I, Chrysikopoulos C V. Interaction between viruses and clays in static and dynamic batch systems [J]. Environmental science & technology, 2010,44(12):4539-4544.
[40] Eric M V Hoek, Subir Bhattacharjee, Menachem Elimelech. Effect of membrane surface roughness on colloid−membrane DLVO interactions [J]. Langmuir, 2003,19(11):4836-4847.
[41] Attinti R, Wei J, Kniel K, et al. Virus' (MS2, phiX174, and Aichi) attachment on sand measured by atomic force microscopy and their transport through sand columns [J]. Environmental science & technology, 2010,44(7):2426.
[42] Bai H, Cochet N, Pauss A, et al. DLVO, hydrophobic, capillary and hydrodynamic forces acting on bacteria at solid-air-water interfaces: Their relative impact on bacteria deposition mechanisms in unsaturated porous media [J]. Colloids & Surfaces B Biointerfaces, 2016,150:41-49.
[43] Olson M S, Ford R M, Smith J A, et al. Quantification of bacterial chemotaxis in porous media using magnetic resonance imaging [J]. Environmental science & technology, 2004,38(14):3864-3870.
[44] 葛 林.原子力显微镜力谱技术及其在微观生物力学领域的应用[J]. 力学进展, 2018,48(1):461-540.
[45] Wang K, Zhao Y, Yang Z, et al. Concentration and characterization of groundwater colloids from the northwest edge of Sichuan basin, China [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2018:537:85-91.
[46] 李海波,孙 晨,刘晓玲,等.三维荧光光谱解析城市污水有机物的去除特征[J]. 中国环境科学, 2016,36(8):2371-2379.
[47] 王佳琴,李卫华,申慧彦,等.污水厂进出水中DOM的三维荧光和FTIR光谱解析 [J]. 环境科学与技术, 2018,(1):71-76.
[48] 胡秀华,何 苗,刘 丽,等.水中轮状病毒实时定量PCR外标准品的构建 [J]. 环境科学, 2008,29(2):380-385.
[49] 全军传染病专业委员会,新突发传染病中西医临床救治课.腺病毒感染诊疗指南[J]. 解放军医学杂志, 2013,38(7):529-534.
[50] 赵高伟,任晓峰.轮状病毒感染机制及防治的研究进展[J]. 世界华人消化杂志, 2013,(1):60-65.
[51] 寇晓霞,吴清平,范宏英,等.水体中诺瓦克病毒RT-PCR检测研究 [J]. 微生物学通报, 2007,34(4):650-653.
[52] Kvitsand H M L, Ilyas A, ØSTERHUS S W. Rapid bacteriophage MS2transport in an oxic sandy aquifer in cold climate: Field experiments and modeling [J]. Water Resources Research, 2015,51(12): 9725-9745.
[53] Gannon J T, Manilal V B, Alexander M. Relationship between cell surface properties and transport of bacteria through soil [J]. Applied & Environmental Microbiology, 1991,57(1):190-193.
[54] Brusseau M L. Factors influencing the transport and fate of contaminants in the subsurface [J]. Journal of Hazardous Materials, 2015,32(2/3):137-143.
[55] Pelley A J, Tufenkji N. Effect of particle size and natural organic matter on the migration of nano- and microscale latex particles in saturated porous media [J]. Journal of Colloid & Interface Science, 2008,321(1):74-83.
[56] Knappett P S, Emelko M B, Zhuang J, et al. Transport and retention of a bacteriophage and microspheres in saturated, angular porous media: effects of ionic strength and grain size [J]. Water Research, 2008, 42(16):4368-4378.
[57] Haznedaroglu B Z, Zorlu O, Hill J E, et al. Identifying the role of flagella in the transport of motile and nonmotile Salmonella enterica serovars [J]. Environmental science & technology, 2010,44(11):4184- 4190.
[58] Kokkinos P, Syngouna V I, Tselepi M A, et al. Transport of Human Adenoviruses in Water Saturated Laboratory Columns [J]. Food & Environmental Virology, 2015,7(2):122-131.
[59] Vasiliadou I A, Chrysikopoulos C V. Cotransport of Pseudomonas putida and kaolinite particles through water-saturated columns packed with glass beads [J]. Water Resources Research, 2011,47(2):2144- 2150.
[60] Masciopinto C, Visino F. Strong release of viruses in fracture flow in response to a perturbation in ionic strength: Filtration/retention tests and modeling. [J]. Water Research, 2017:126:240-251.
[61] Sasidharan S, Bradford S A, Torkzaban S, et al. Unraveling the complexities of the velocity dependency of E. coli retention and release parameters in saturated porous media. [J]. Science of the Total Environment, 2017,603-604:406-415.
[62] Kim H N, Bradford S A, Walker S L. Escherichia coli O157: H7Transport in Saturated Porous Media: Role of Solution Chemistry and Surface Macromolecules [J]. Environmental science & technology, 2009,43(12):4340-4347.
[63] Zhang H, Nordin N A, Olson M S. Evaluating the effects of variable water chemistry on bacterial transport during infiltration [J]. Journal of contaminant hydrology, 2013,150(150C):54-64.
[64] And G C, Walker S L. Role of solution chemistry and ion valence on the adhesion kinetics of groundwater and marine bacteria [J]. Langmuir, 2007,23(13):7162-7169.
[65] Kerchove A J D, Elimelech M. Formation of polysaccharide gel layers in the presence of Ca2+and K+ions: measurements and mechanisms [J]. Biomacromolecules, 2007,8(1):113-121.
[66] Kim H N, Walker S L. Escherichia coli transport in porous media: influence of cell strain, solution chemistry, and temperature [J]. Colloids & Surfaces B Biointerfaces, 2009,71(1):160-167.
[67] Chrysikopoulos C V, Aravantinou A F. Virus attachment onto quartz sand: Role of grain size and temperature [J]. Journal of Environmental Chemical Engineering, 2014,2(2):796-801.
[68] Yang H, Kim H, Tong M. Influence of humic acid on the transport behavior of bacteria in quartz sand [J]. Colloids & Surfaces B Biointerfaces, 2012,91(3):122-129.
[69] Dong Z, Yang H, Wu D, et al. Influence of silicate on the transport of bacteria in quartz sand and iron mineral-coated sand [J]. Colloids & Surfaces B Biointerfaces, 2014,123:995-1002.
[70] Bozorg A, Gates I D, Sen A. Impact of biofilm on bacterial transport and deposition in porous media [J]. Journal of Contaminant Hydrology, 2015,183:109-120.
[71] Vasiliadou I A, Chrysikopoulos C V. Co-transport of Pseudomonas putida and kaolinite colloid particles through water saturated columns packed with glass beads [J]. Water Resources Research, 2011, 47(2): 2144-2150.
[72] Chattopadhyay S, Puls R W. Forces dictating colloidal interactions between viruses and soil [J]. Chemosphere, 2000,41(8):1279-1286.
[73] Balkhair K S. Modeling fecal bacteria transport and retention in agricultural and urban soils under saturated and unsaturated flow conditions [J]. Water Research, 2017,110:313-320.
[74] Haznedaroglu B Z, Kim H N, Bradford S A, et al. Relative transport behavior of Escherichia coli O157: H7 and Salmonella enterica serovar pullorum in packed bed column systems: influence of solution chemistry and cell concentration [J]. Environmental science & technology, 2009,43(6):1838-1844.
[75] Zhang W, Morales V L, Cakmak M E, et al. Colloid transport and retention in unsaturated porous media: effect of colloid input concentration [J]. Environmental science & technology, 2010,44(13): 4965-4972.
[76] Gharabaghi B, Safadoust A, Mahboubi A A, et al. Temperature effect on the transport of bromide and E. coli, NAR in saturated soils [J]. Journal of Hydrology, 2015,522:418-427.
[77] Drobek T, And N D S, Heuberger M. Compressing PEG Brushes [J]. Macromolecules, 2005,38(12):5254-5259.
[78] Grna H, Lawniczak L, Zgoła-grześkowiak A, et al. Differences and dynamic changes in the cell surface properties of three Pseudomonas aeruginosa strains isolated from petroleum-polluted soil as a response to various carbon sources and the external addition of rhamnolipids [J]. Bioresource Technology, 2011,102(3):3028-3033.
[79] Zhang Y, Miller R M. Effect of a Pseudomonas rhamnolipid biosurfactant on cell hydrophobicity and biodegradation of octadecane [J]. Applied & Environmental Microbiology, 1994,60(6):2101-2106.
[80] Chen G, Qiao M, Zhang H, et al. Bacterial desorption in water- saturated porous media in the presence of rhamnolipid biosurfactant [J]. Research in Microbiology, 2004,155(8):655-661.
[81] 席永慧,刘建航.饱和多孔介质中污染物迁移模拟 [J]. 同济大学学报(自然科学版), 2005,(5):644-648.
[82] 袁雪梅,邓仕槐,杨悦锁,等.纳米银在饱和多孔介质含水层中迁移主控机理和影响特征 [J]. 化工学报, 2017,68(11):4154-4160.
[83] Anders R, Chrysikopoulos C V. Transport of viruses through saturated and unsaturated columns packed with sand [J]. Transport in Porous Media, 2009,76(1):121-138.
[84] Sadeghi G, Schijven J F, Behrends T, et al. Systematic Study of Effects of pH and Ionic Strength on Attachment of Phage PRD1 [J]. Groundwater, 2011,49(1):12–19.
[85] Baygents J C, Jr J R G, Albinger O, et al. Variation of Surface Charge Density in Monoclonal Bacterial Populations: Implications for Transport through Porous Media [J]. Environmental science & technology, 1998,32(11):1596-1603.
[86] Schinner T, Letzner A, Liedtke S, et al. Transport of selected bacterial pathogens in agricultural soil and quartz sand [J]. Water Research, 2010,44(4):1182-1192.
[87] Huysman F, Verstraete W. Water-facilitated transport of bacteria in unsaturated soil columns: Influence of cell surface hydrophobicity and soil properties [J]. Soil Biology & Biochemistry, 1993,25(1):83-90.
[88] Brown D G, Al Nuaimi K S. Nonionic surfactant sorption onto the bacterial cell surface: a multi-interaction isotherm [J]. Langmuir the Acs Journal of Surfaces & Colloids, 2005,21(24):11368-11372.
[89] Zevi Y, Dathe A, Gao B, et al. Transport and retention of colloid particles in partially saturated porous media: effect of ionic strength [J]. Water Resources Research, 2009,45(12):69-76.
[90] Zhuang J, Jin Y. Interactions between viruses and goethite during saturated flow: effects of solution pH, carbonate, and phosphate [J]. Journal of contaminant hydrology, 2008,98(1/2):15-21.
[91] 王 芳,朱广伟,许 海,等.太湖梅梁湾水体中胶体对铜绿微囊藻生长的促进效应[J]. 中国环境科学, 2009,29(5):538-542.
[92] 朱维晃,臧 辉,吴丰昌.微生物还原针铁矿胶体的动力学特征及其影响因素[J]. 中国环境科学, 2011,31(5):820-827.
[93] Wan J, Wilson J L. Visualization of the role of the gas-water interface on the fate and transport of colloids in porous media [J]. Water Resources Research, 1994,30(1):11–23.
[94] Sim Y, Chrysikopoulos C V. Analytical models for virus adsorption and inactivation in unsaturated porous media [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 1999,155(2/3):189-97.
[95] And J W, Tokunaga T K. Film Straining of Colloids in Unsaturated Porous Media: Conceptual Model and Experimental Testing [J]. Environmental science & technology, 1997,31(8):2413-2420.
[96] Veerapaneni S, Jiamin WAN A, Tokunaga T K. Motion of Particles in Film Flow [J]. Environmental science & technology, 2000,34(12): 2465-2471.
[97] Torkzaban S, Hassanizadeh S M, Schijven J F, et al. Role of air‐water interfaces on retention of viruses under unsaturated conditions [J]. Water Resources Research, 2006,42(12):2526-2528.
[98] Kim M Y, Kim S, Park S I. Bacteria transport in an unsaturated porous media: incorporation of air–water interface area model into transport modelling [J]. Hydrological Processes, 2010,22(13):2370-2376.
[99] Schäfer A, Ustohal P, Harms H, et al. Transport of bacteria in unsaturated porous media [J]. Journal of Contaminant Hydrology, 1998,33(1/2):149-169.
[100]Gómezsuárez C, Busscher H J, Mei H C V D. Analysis of bacterial detachment from substratum surfaces by the passage of air-liquid interfaces [J]. Applied & Environmental Microbiology, 2001,67(6): 2531-2537.
[101]Zhong H, Liu G, Jiang Y, et al. Effect of low-concentration rhamnolipid on transport of Pseudomonas aeruginosa ATCC 9027in an ideal porous medium with hydrophilic or hydrophobic surfaces [J]. Colloids and surfaces B, Biointerfaces, 2016,139(2):244-248.
[102]Dan W, Lei H, Sun R, et al. Influence of Bisphenol A on the transport and deposition behaviors of bacteria in quartz sand [J]. Water Research, 2017,121:1-10.
[103]袁瑞强,郭 威,王 鹏,等.高pH环境对胶体在饱和多孔介质中迁移的影响[J]. 中国环境科学, 2017,37(9):3392-3398.
[104]Hornstra L M, Schijven J, Waade A, et al. Transport of bacteriophage MS2 and PRD1 in saturated dune sand under suboxic conditions [J]. Water Research, 2018,139:158-167.
[105]Sanya S, Arturo K. Transport of colloids in saturated porous media: A pore-scale observation of the size exclusion effect and colloid acceleration [J]. Water Resources Research, 2003,39(39):1255-1256.
[106]Huang C T, Peretti S W, Bryers J D. Use of flow cell reactors to quantify biofilm formation kinetics [J]. Biotechnology Techniques, 1992,6(3):193-198.
[107]García López L A, Veiga M C, Nogueira R, et al. A technique using a membrane flow cell to determine average mass transfer coefficients and tortuosity factors in biofilms [J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2003,47(5):61-67.
致谢:对课题组所有科研工作人员,及从事污染水文地质的科研人员表示感谢.
Transport behavior of microorganism in the porous media.
ZHANG Wen-jing1,2*,QIN Yun-qi1,2, LIU-Dan1,2, MA Tian-yi1,2, LI Xiao-fei1,2
(1.Key Laboratory of Groundwater Resources and Environment, Ministry of Education, Jilin University, Changchun 130021, China;2.College of New Energy and Environment, Jilin University, Changchun 130021, China)., 2018,38(10):3975~3984
Understanding the fate and transport of pathogenic microorganisms in porous media is of great significance to protect water resources. On the basis of the previous research at home and abroad, the migration behaviour of microorganisms in porous media has been summarized. Several studies have shown that, pathogenic microorganisms as a kind of biocolloid, its transport will be controlled by a series of complex mechanism. In addition to the common hydrodynamic and hydrochemical conditions, microorganisms are also affected by itself characteristics, medium particles and environmental factors during the migration process. On this basis, the migration behaviours of microorganisms in saturated porous media and unsaturated porous media have been discussed, and the research focus in recent years have also been briefly summarized. At present, a great number of related researches about this topic have been published. However, due to the complexity of underground environment and the variability of microorganisms, it is necessary to further discuss the remediation of microorganism pollution in groundwater system.
microorganism;porous medium;migration mechanism;biocolloid;transport and deposition
X172
A
1000-6923(2018)10-3975-10
张文静(1980-),女,山东临沂人,教授,博士,主要从事污染水文地质方面研究.发表论文20篇.
2018-03-24
国家自然科学基金资助项目(41472215,41877175);高等学校学科创新引智计划资助项目(B16020)
* 责任作者, 教授, zhangwenjing80@ hotmail.com
