CT引导下射频消融在肺转移性肿瘤中的临床应用价值
2018-10-26王伟根应碧伟章家铭
王伟根,应碧伟,章家铭
肺脏因是全身血液进行氧合交换的场所,其特殊生理功能常成为恶性肿瘤转移的靶器官,据统计30%~40%的恶性肿瘤在病程发展过程中发生肺转移[1-2]。肺转移瘤的出现常提示病程进入晚期,通常认为是手术切除禁忌。在日常工作中发现部分原发肿瘤已得到控制或可控制范围内,肺部出现单发或散发转移瘤,常规治疗手段多采用放化疗,放化疗敏感性低、副作用大及疗效差,大部分患者化疗后严重影响生活质量。射频消融是一种微创的局部治疗手段,具有微创、并发症少、疗效确切及可重复多次进行手术等优点。射频消融在肝癌和非小细胞肺癌中临床应用较多,对肺转移性肿瘤的应用相关文献较少,本文通过总结分析16例转移性肿瘤共27个病灶进行29次射频消融治疗病例,为肺转移性肿瘤射频消融技术的应用提供临床依据。现报道如下。
1 资料与方法
1.1 病例纳入标准 (1)有原发肿瘤手术病史,病理诊断明确;(2)肺部转移性肿瘤为术后胸部常规检查基线上新近出现病灶并增大进展;(3)病灶个数单侧肺≤3个,双侧肺≤5个;(4)发现病灶30d内病灶无增多或单侧肺野病灶增多≤2个;(5)射频消融术前常规胸部CT增强扫描。
1.2 一般资料 收集2013年10月至2017年5月在浙江省宁海县第一医院进行肺转移性肿瘤CT引导下射频消融治疗病例16例,男11例,女5例;年龄45~81岁,中位年龄69岁;转移瘤直径1.0~5.0 cm,平均2.0cm;单发6例,多发10例,共27个病灶。肺癌术后同侧肺野再发病灶5例,结直肠癌肺转移7例,肝癌肺转移2例,喉癌肺转移1例,乳腺癌肺转移1例。1次手术完成病灶消融6例,2次手术完成病灶消融9例,3次手术完成病灶消融1例,2个病灶进行2次消融。8例根据原发肿瘤病理进行全身静脉化疗,2例肺癌切除术后靶向药物治疗。
1.3 方法 术前禁食6 h,适当使用镇静剂,根据肿瘤所在位置选择相对舒适体位,以方便最佳穿刺路径,通常采用仰卧或俯卧位。采用低剂量CT扫描引导,参数:120 kV、50 mAs、1 mm×16扫描模式,常规软组织算法2 mm层厚连续重建。术前定位扫描全肺,体表放置定位金属点,重复局部CT扫描,范围包括病灶在内局部3~5cm区域,计算进针角度和深度。患者皮肤常规消毒,铺洞巾,以2%利多卡因胸壁全层浸润麻醉,用18G RITA StarBurstTMXL伞状消融电极针穿刺进入,到达肿瘤近进针侧预定区域后针展2 cm加以固定,防止病灶与消融电极针脱离。局部扫描CT并进行三维重建,观察伞针在病灶内分布情况,满意后连接射频消融治疗仪。射频消融治疗仪采用美国RITA1500射频发射器,发射频率460 kHz,最大功率250W。依据病灶大小将电极从2、3、4、5 cm分次从针鞘推出,呈伞状张开分布于肿瘤内进行消融,利用RITA专用软件可同时记录治疗过程中的功率、阻抗及5个消融点的实时温度。初始功率30W,消融过程中监测到实际功率大于设定功率时将设定功率增加10 W,最大至90W,预设靶温90℃给予射频序贯治疗。成功消融为使消融范围超过肿瘤1 cm。消融结束后进行针道消融预防针道种植转移和出血,然后行全肺CT扫描,观察评估气胸及出血等并发症程度。患者返回病房平卧8h,心电图及氧饱和度检测。
1.4 疗效评价标准 (1)近期疗效评价采用WHO实体瘤近期客观疗效判定标准:分为完全缓解(CR)、部分缓解(PR)、无变化(NC)和进展(PD);影像学监测,消融手术后1年内每3个月行1次胸部增强CT检查,之后每半年1次增强扫描,观察肿瘤大小、平扫CT值及增强强化值变化。(2)肿瘤标记物检测时间参照CT随访。(3)随诊观察患者生存期,从第1次射频治疗开始计算,至死亡或末次随访时间结束。病灶控制率=(CR+PR+NC)/总个数×100%。
2 结果
16例27个病灶接受29次射频消融治疗,手术均顺利完成。术中出现并发症:气胸7例,少量气胸无处理自愈6例,经胸腔闭式引流插管1例;术中疼痛5例,难以耐受胸部闷热胀痛2例,追加盐酸右美托咪定注射液和枸橼酸舒芬太尼注射液合用静脉全身麻醉,手术顺利进行;滞针1例,经注水孔少量注入0.9%氯化钠注射液后顺利拔针;术后发热疼痛等症状3例,经相应对症处理后好转。射频消融术后随访时间8~24个月,肺转移瘤射频消融术后12个月随访,病灶逐步缩小呈条状8例(封三彩图2),呈薄壁空洞样3例,呈外形无变化增强无强化3例,消融灶增大5例。术后3、6、9、12、18、24个月病灶控制率分别为92.59%、88.89%、88.89%、81.48%、74.07%及59.26%。见表1。

图2 男性,68岁,左肺上叶鳞状细胞癌经手术左肺上叶切除9个月;A:左上野直径1.4cm实性结节持续增大,边缘饱满,增强后呈明显均匀强化;B:射频消融针布针后三维重建显示,主针及三枚锚针位于结节内;C:射频消融术后结节边界模糊,可见直径范围约4.5 cm磨玻璃密度灶;D:射频消融术后6个月增强扫描复查,显示结节外形缩小
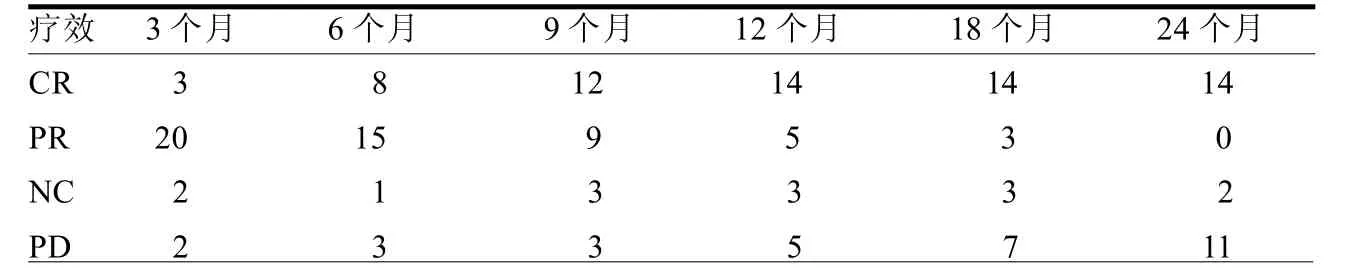
表1 射频消融术后3、6、9、12、18、24个月病灶控制率统计 个
3 讨论
研究表明对符合手术指征的肺转移性肿瘤进行切除,可获得较满意的延迟生存期的作用,但手术适应证窄,应用不广泛[3-4]。自2000年Dupuy等[5]首先将射频消融引入肺癌治疗以来,开启了肺癌射频消融微创治疗肿瘤新时期。射频消融手术对患者心肺肾功能要求相对低,可以最大程度保留患者的正常肺组织和肺功能,并能摧毁病灶[6],为肺癌的微创治疗开启新途径。
射频消融手术是一种相对安全的局部治疗手段,在2007年就有文献指出射频消融手术在治疗肺癌方面具有良好的疗效和安全性[7]。射频消融手术过程中主要并发症是气胸和疼痛[8]。减少气胸并发症的出现关键在于穿刺技术,反复多次的穿刺将使得气胸并发症出现概率明显加大。在穿刺前对患者呼吸进行训练,尤其是下肺病灶受呼吸深度影响大,为保证穿刺成功率,术前对患者进行严格的呼吸训练,确保在相同的潮气量下屏气进行操作。当无导航设备实时引导下,对于病灶处于较深的位置,穿刺路径>7 cm以上,建议采用分步进针法,第1次进针深度设置为过胸膜后穿刺路径的1/2,扫描观察进针的角度,及时调整穿刺方向,这将避免反复穿刺。原则上两侧肺转移瘤严禁同期进行射频消融手术,同侧肺野多发病灶在出现气胸量少的情况可同期多次进行消融。
本研究结果表明,射频消融术后12个月肿瘤的局部控制率为81.48%,笔者认为这与本组病例中病灶较小及射频电极锚针能一次覆盖肿瘤全部有关。本组病例中1例结肠癌肺转移因肿瘤直径达4.8cm且外形不规则,电极针难以覆盖肿瘤各区域,经多点、多角度消融后6个月出现病灶局部进展。当肿瘤直径>3cm以上及肿瘤外形不规则时,每次消融布针后应进行三维重建观察电极锚针在肿瘤内分布情况,一次难以覆盖时需更改消融点和消融针角度,并再次三维重建观察是否有肿瘤遗漏,尽量做到肿瘤内全覆盖,消融后病灶周围可产生磨玻璃晕影,消融灶范围超出肿瘤边缘1cm以上,确保消融有效性。
综上所述,当原发肿瘤已得到控制或可控制范围内,肺部出现转移性肿瘤,单侧肺病灶数≤3个、双侧肺病灶数≤5个、发现病灶30d内病灶无增多或单侧肺野病灶增多≤2个及病灶直径≤4cm,CT引导下射频消融是一种良好的仅次于手术根治的治疗手段,值得在临床中推广。因病例样本原因,本研究未做射频消融联合化疗的对照研究,笔者将在以后的临床工作中做进一步研究。
