抗C1q抗体及补体C3、C4在神经精神性狼疮诊断中的应用价值
2018-10-26罗采南石亚妹孟新艳武丽君
吴 雪 罗采南 石亚妹 孟新艳 武丽君
(新疆维吾尔自治区人民医院风湿免疫科,乌鲁木齐830001)
系统性红斑狼疮(Systemic lupus erythematosus,SLE) 是一种累及全身多个系统的自身免疫性疾病。目前,SLE的发病机制还不清楚,但是越来越多的研究发现 SLE 患者中存在细胞死亡过多、过度凋亡及清除障碍等特点,大量凋亡小体的产生及对凋亡细胞清除障碍导致自身抗原暴露,产生大量自身抗体从而导致疾病的发生。C1q 是固有免疫补体经典途径的始动因子C1的组成成份,它与抗原抗体复合物结合,激活并启动补体经典途径,在清除循环免疫复合物及凋亡细胞碎片中扮演着重要角色[1]。相关研究表明早期补体基因的缺失与系统性红斑狼疮的发生有关,C1q纯合子基因缺乏患者88%发展为SLE,30%发展为系膜毛细血管性肾小球肾炎[2-4]。SLE患者体内存在诸多抗体,抗C1q抗体已被证明与狼疮性肾病相关,但这些补体成份在系统性红斑狼疮其他系统中特别是神经系统疾病中的致病作用并不清楚。近年国外的研究发现血清中C3、C4及抗C1q抗体升高与神经精神性狼疮(Neuropsychiatric systemic lupus erythematosus,NPSLE)相关,但国内相关报道甚少[5-8]。
本文主要目的是分析抗C1q抗体及补体C3、C4与神经精神性狼疮的关系,探讨抗C1q抗体及补体C3、C4在狼疮性脑病中的应用价值。
1 资料与方法
1.1资料
1.1.1研究对象 本实验收集2009年至2017年就诊于新疆维吾尔自治区人民医院风湿免疫科并确诊的SLE患者88例,其中NPSLE患者22例,单纯SLE患者66例。SLE的诊断符合美国风湿病学会1997年修订的SLE分类标准,狼疮脑病患者诊断符合1999年美国风湿协会制定的狼疮性脑病分类标准[9]。分析患者血清C1q抗体与狼疮脑病患者临床表现、其他血清学指标与狼疮性脑病之间的关系,全部患者治疗前抽取外周静脉血分离血清储存待检抗C1q抗体,同期检测各项免疫学指标并记录临床症状。
1.2检测方法 所有患者均抽取外周静脉血经4℃、1 000 g离心10 min后取血清,保存于-80℃待测。采用ELISA法测定抗C1q抗体,仪器为英国Thermo Labsystems-353酶标仪,试剂由亚辉龙生物科技公司生产。采用免疫散射比浊法测定C3、C4,仪器为贝克曼5831全自动生化分析仪及配套试剂,操作均按说明书执行。
1.3统计学处理 所有数据处理均采用SPSS20软件包,数量符合正态分布,所有计量资料两组间比较用t检验,不符合正态分布计量资料采用Mann-WhitneyU秩和检验。计数资料统计采用χ2检验。危险因素分析采用Logistic回归检验。P<0.05为差异具有统计学意义。
2 结果
2.1两组一般资料对比 本研究共纳入88名患者,患者平均年龄为(37.6±12.4)岁,89.8%为女性,10.2%为男性,平均病程为(6.3±5.2)年。病例组22人,对照组66人,病例组平均年龄(29.8±10.4)岁,对照组平均年龄(40.2±12.0)岁,差异具有明显统计学意义(P<0.05)。患者临床表现及各项指标见表1。
2.2NPSLE与非NPSLE流行病学资料及抗体表达水平的比较 NPSLE组与非NPSLE组对比,年龄、性别、病程、抗核抗体、抗SSA抗体、抗核糖体P蛋白抗体、抗C1q抗体、补体C4对比,组间差异存在显著统计学意义(P<0.05)。
2.3补体C3、C4及抗C1q抗体与NPSLE患者临床表现相关性分析 NPSLE患者临床表现见表2,狼疮脑病患者临床表现癫痫(6/22,27.3%)、认知功能障碍(3/22,13.7%)、脑血管意外(12/22,54.5%)、狼疮性头痛(9/22,40.9%)、视神经受累(3/22,13.6%)、记忆力减退(2/22,9.1%)、感觉障碍(1/22,4.5%)。抗C1q抗体、C3及C4与NPSLE临床表现的结果显示:C4降低与NPSLE患者脑血管意外有关,组间对比差异具有显著统计学意义(P<0.05)。而C3、C4及抗C1q抗体与癫癫痫、狼疮性头痛、视神经受累、记忆力减退、感觉障碍组间对比差异无显著统计学意义(P>0.05)。
2.4受试者工作特征曲线(ROC) 采用ROC曲线分析NPSLE与非NPSLE患者抗C1q抗体之间差异,ROC曲线下面成为0.66(P<0.05), 当以21 U/ml为临界值时,其敏感性与特异性分别为63.6%、66.7%,提示其对NPSLE诊断具有一定价值,见图1。
表1患者流行病学数据
Tab.1Epidemiologicaldataofpatients

DataNPSLE SLEPAge29.8±10.440.2±12.00.000Female/Male16/663/30.002SLE disease duration3.6±4.17.1±5.40.002SLEDAI21.5±86 5.1±4.00.000Autoantibodies and complementdsDNA113.5±123102.9±119.20.728ACL14.3±28.28.7±20.80.397B2-GPI 23±4715.5±35.9 0.495Nucleoson(ELISA) 89.4±77.747.0±61.60.011Anti-U1RNP 13(59.1%)29(43.9%)0.218Anti-SM4(18.2%)10(15.2%)0.086Anti-SSA/Ro52 7(31.8%)42(63.6%)0.009Anti-SSB/La 2(9.1%)10(15.2%)0.473Anti-HISTONES 5(22.7%)5(7.6%)0.052Anti-P PROT12(54.5%)13(19.7%) 0.002C318(81.8%)42(63.6%)0.113C419(86.4%)42(63.6%)0.045Anti-C1q54.7±58.422.5±29.00.001
表2神经精神性系统性红斑狼疮脑病患者临床表现
Tab.2Clinicalmanifestationsofneuropsychiatricsystemiclupuserythematosus
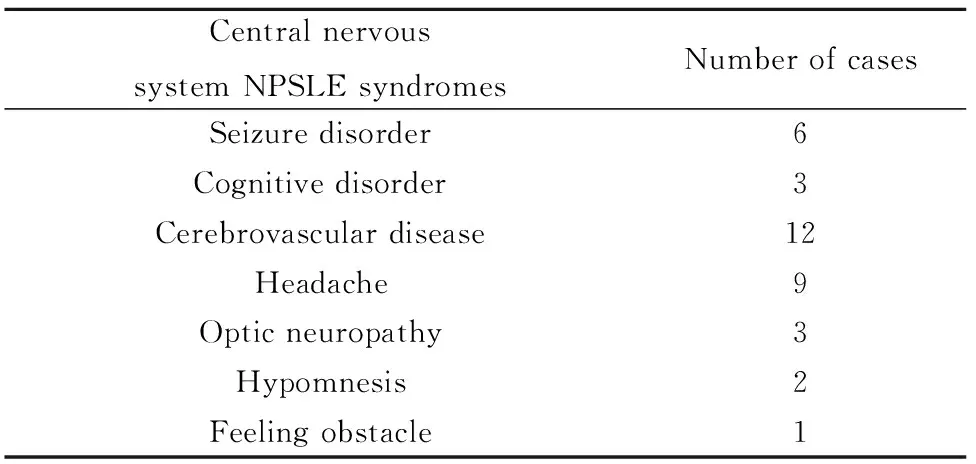
Central nervoussystem NPSLE syndromesNumber of casesSeizure disorder6Cognitive disorder 3Cerebrovascular disease12Headache9Optic neuropathy3Hypomnesis2Feeling obstacle 1
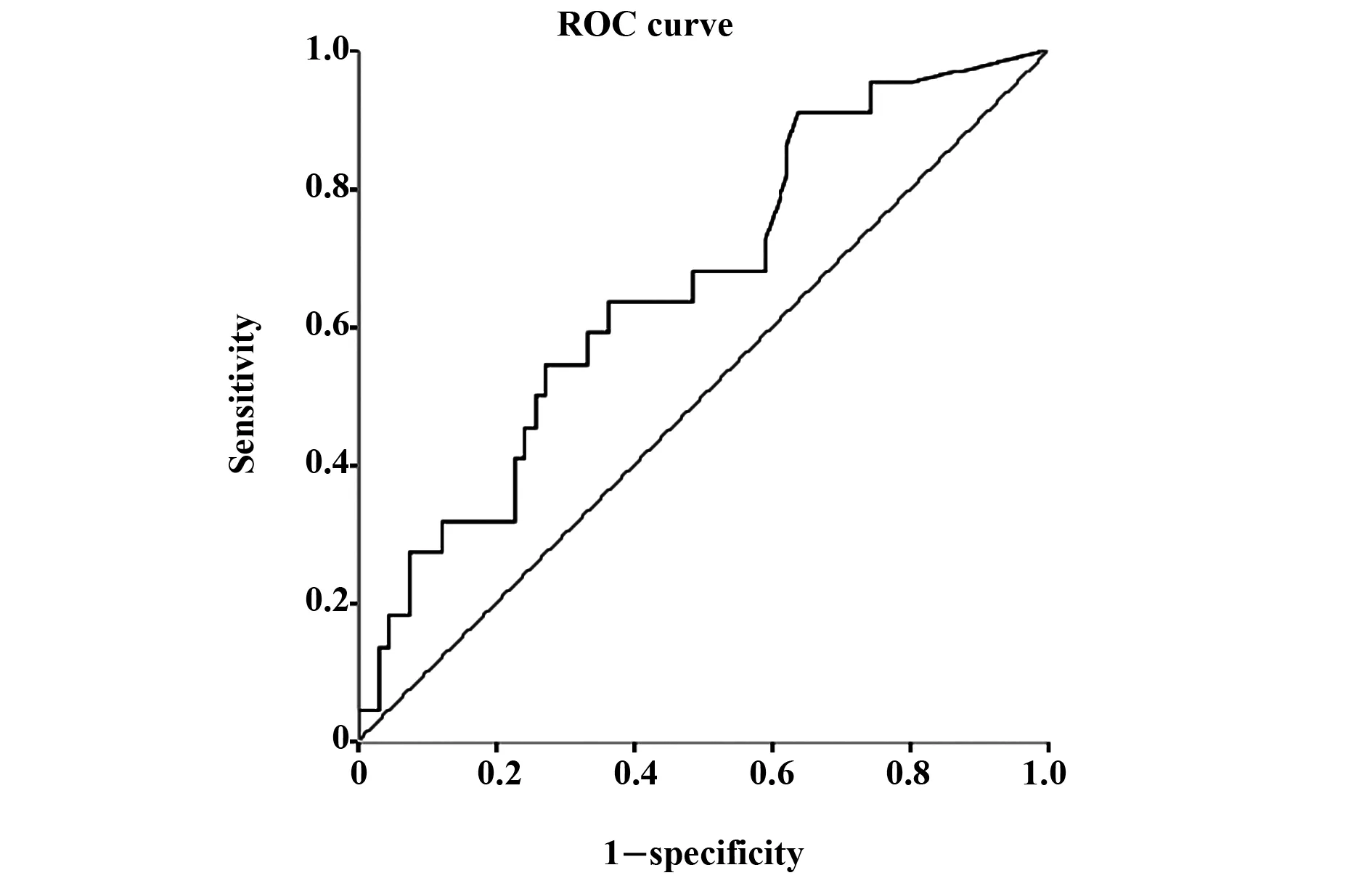
图1 抗C1q抗体ROC曲线Fig.1 ROC curve of anti-C1q antibody
表3单因素及多因素分析狼疮脑病发生的危险因素
Tab.3SinglefactorandmultifactoranalysisofriskfactorsofNPSLE

VariablesUnivariate analysisOR(95%CI)PMultivariate regression analysisOR(95%CI)PdsDNA 0.999(0.995,1.003)0.719ACL0.991(0.972,1.010)0.332β2-GPI 0.996(0.984,1.007)0.996Nucleoson0.991(0.985,0.998)0.0140.994(0.985,1.002) 0.130Anti-U1RNP 1.843(0.692,4.906)0.221Anti-SM 2.613(0.850,8.021)0.153 Anti-SSA0.267(0.095,0.745)0.012 3.197(0.987,10.354) 0.053Anti-SSB0.560(0.113,2.779)0.478Anti-P PROT4.892(0.528,9.031)0.003C30.389(0.118,1.283)0.121C40.276(0.740,1.031)0.0560.673(0.153,2.971)0.602Anti-C1q0.982(0.970,0.994)0.0040.990(0.977,1.003)0.137
2.5神经精神脑病发生的危险因素分析 表3显示了中枢神经系统与各种临床和实验室表的潜在相关性,采用单因素回归分析发现病例组与对照组相比,抗核小体抗体(OR=0.991,95%CI0.985-0.998,P=0.014)、Anti-SSA(OR=0.267,95%CI0.095-0.745,P=0.012)、Anti-P PROT(OR=4.892,95%CI0.528-9.031,P=0.003)、Anti-C1q抗体(OR=0.982,95%CI0.970-0.994,P=0.004)差异有统计学意义。但通过多因素分析后并未发现狼疮脑病发生因素与C1q抗体升高及补体C3、C4降低相关。
3 讨论
SLE患者神经系统受累是一种普遍而严重的并发症,死亡率约为7%~19%[10-12]。目前,SLE引起的中枢神经系统受累的病理机制仍不清楚。补体系统激活与多种风湿性疾病相关,特别是SLE。补体系统异常是导致SLE患者组织损伤的众多因素之一,有关研究证明C1q、C1r、C1s、C4和C2的遗传缺陷与SLE的发展有关[13]。SLE患者体内存在着多种抗体,其中包含抗C1q抗体。抗C1q抗体存在于2%~8%的健康人群中,但在SLE患者中,高达30%~48%[14]。抗C1q抗体的存在往往伴随着经典补体途径的激活及C1q、C4和C2的降低[15]。Thanei等[16]的研究证明,抗C1q抗体可以激活狼疮患者体内补体的经典激活途径和凝集素途径。而两种途径均可合成补体C3,进而生成C5转换酶引起C5-C9的级联激活最终形成膜攻击复合物,造成机体损伤[17]。Jacob等[18]建立的小鼠模型证明,以C3开始的旁路激活途径是SLE患者脑内补体激活的重要机制,选择性地抑制C3a受体,可以减轻SLE小鼠脑内神经元的变性,旁路激活途径中的C3a受体可能作为治疗狼疮脑病的靶点。此外,Mahajan等[19]的研究证明C5a可以诱导狼疮小鼠脑血管内皮细胞的凋亡,C5a/C5aR1信号通路是狼疮脑血管内皮病变的决定因素,C5a/C5aR1信号通路可能是中枢神经系统狼疮治疗靶点。相关研究证实,C1q及C3在神经系统发育、衰老及神经系统病变中发挥着重要作用[20-22]。所以近年来补体在自身免疫系统疾病中的作用得到了越来越多的重视,补体治疗可能成为治疗系统性红斑狼疮的新方法。本文主要研究抗C1q抗体及补体C3、C4与中枢性狼疮性脑病发生的关系。
本研究发现,病例组与对照组相比,发病年龄、性别相比组间差异具有显著统计学意义(P<0.05),其中50%患者在SLE发病初期或确诊两年内发生神经精神性狼疮,这与以往相关研究一致[23,24]。NPSLE患者C4、抗C1q抗体、抗核小体抗体及抗核糖体P蛋白抗体水平与非NPSLE患者相比,组间差异具有显著(P<0.05)。且当C1q水平为21 U/ml时,其诊断NPSLE的敏感性与特异性分别为63.6%、66.7%。其诊断价值明显优于抗核糖体P蛋白抗体,Karassa等[25]进行的一项纳入14项研究,涉及1 537例患者的Meta分析证明,抗核糖体P蛋白抗体诊断NPSLE的敏感性与特异性分别为28%、80%。所以,抗C1q抗体在诊断NPSLE患者中具有一定诊断价值,且优于抗核糖体P蛋白抗体。
本研究还发现狼疮脑病患者脑血管意外的发生与C4降低相关,这与国外研究一致。补体系统激活被认为是导致SLE患者脑缺血疾病发生的重要机制。Lood等[26]的研究证明,C1q、C3d和C4d在血小板上的过多沉积与脑血管炎症和血栓形成有关。Navratil等[27]提出的C4d附着的血小板是诊断SLE的特异性生物标志物,且与狼疮患者血管事件及血栓形成有关,说明补体C4可能参与NPSLE患者脑血管意外事件的发生。
研究还发现病例组与对照组相比,抗C1q抗体、补体C4相比组间差异具有显著统计学意义(P<0.05)。单因素分析显示:抗核小体抗体、抗SSA抗体、抗核糖体P蛋白抗体、抗C1q抗体与NPSLE的发生相关,但多因素Logistic分析并未证明其与NPSLE发生的相关性。这可能是因为本研究纳入中枢性狼疮脑病患者均属于活动期,而补体C3、C4及抗C1q抗体的滴度与狼疮患者活动度明显相关,从而造成病例组患者血清抗C1q抗体、C4及C3与非NPSLE存在差异,另外本研究为横断面研究,部分患者在治疗过程中出现神经系统症状,所以还需要进一步纵向研究探讨补体系统与狼疮脑病发生的关系。
综上所述,抗C1q抗体在狼疮脑病诊断中具有一定诊断价值,补体C4可能参与狼疮脑病脑血管意外的发生。
