结肠癌患者肿瘤浸润性树突状细胞在组织中表达及临床意义
2018-10-26萨仁高娃
萨仁高娃 韩 悦
(呼伦贝尔职业技术学院,呼伦贝尔021000)
结肠癌是中老年人最常见的恶性肿瘤之一,且近些年有年轻化趋势。虽然随着胃肠镜技术的发展,结肠癌早期确诊率有所提高,使得死亡率有所下降,但是部分结肠癌患者仍可在早期即可通过淋巴道、血液等方式转移,肿瘤细胞的转移是结肠癌患者预后不良最重要的影响因素[1,2]。目前,研究已证实免疫系统在肿瘤细胞的生长和转移中发挥了重大作用,肿瘤细胞可以通过多种途径诱导对机体的免疫耐受,从而大量增殖并转移。CD4+T细胞和CD8+T细胞等已被证实与肿瘤细胞的生长和转移有关[3]。树突状细胞(Dendritic cells,DC)是机体的一种抗原呈递细胞,其功能最大,在肿瘤患者中,主要将肿瘤细胞表面分子标志物和代谢产物等呈递给细胞毒性T细胞,进而杀伤肿瘤细胞[4,5]。但目前关于肿瘤浸润性树突状细胞(Tumor infiltrating dendritic cells,TIDC)在结肠癌组织中的表达和临床意义尚不清楚。
1 资料与方法
1.1一般资料 自2016年1月至2017年1月,前瞻性收集我院收治的结肠癌患者117例,纳入标准:①结肠癌;②接受手术治疗;③同意参与本研究;④年龄18~70岁。排除标准:①术前曾接受放化疗或分子生物靶向治疗等特殊治疗;②复发性结肠癌;③溃疡性结肠炎、克罗恩病等重大胃肠道疾病;④合并其他恶性肿瘤;⑤肝肾等脏器功能不全;⑥既往心肌梗死、脑卒中等重大心血管疾病;⑦急性或慢性感染期;⑧ 6月内曾接受免疫调节剂等治疗;⑨原位癌。年龄≥60岁的患者63例,<60岁的患者54例;男性79例,女性38例;肿瘤直径≥5 cm的患者67例,<5 cm的50例;腺癌75例,黏液癌 42例;肿瘤细胞分化程度为中低分的59例,高分化的58例;临床TNM分期Ⅱ期的78例,Ⅲ期的39例。本研究中所有患者均知情同意并签署知情同意书,本研究通过医院伦理委员会批准。
1.2方法
1.2.1研究方法 入院后,完善相关检查,择期行结肠癌切除术,取术中标本,检测肿瘤组织中(肿瘤组织中心部位)和癌旁组织(距离肿瘤边缘5 cm以上)中TIDC及DC的MHCⅡ和CD54表达情况。同时收集患者临床特征包括年龄、性别、肿瘤大小、肿瘤细胞类型、肿瘤细胞分化程度、临床TNM分期、术后6月内复发率等信息。分析结肠癌组织中TIDC及其MHCⅡ和CD54表型与临床特征的相关性。
1.2.2检测方法 取术中组织标本进行免疫组化染色后,根据SABC法,以试剂公司提供的阳性切片作为阳性对照,以PBS代替一抗作为阴性对照(所有试剂均来源于上海基因科技有限公司)。在400倍镜下随机选取10个视野,计算肿瘤浸润性树突状细胞数量,取10个视野的平均值作为该组织的肿瘤浸润性树突状细胞密度。MHCⅡ和CD54:取结肠癌组织和癌旁组织,RPMI1640培养基消化,流式细胞仪检测MHCⅡ和CD54(取1 g标本,脱蜡、水化、胰蛋白酶37℃恒温水浴震动消化30 min,300目尼龙网过滤,800 r/min 5 min离心2次,去除碎片,加入检测管,离心,弃掉上层清液,分别加入相关抗体,混匀,避光30 min,1 ml PBS溶液稀释,离心后去掉上层清液,加入固定液150 μl,上机检测,流式细胞仪型号为:赛默飞Attune NxT)。判定方法:以细胞膜和(或)细胞质中出现棕黄色颗粒或团状视为阳性。参考奥尔雷德评分标准从细胞阳性数(1~4分)及染色强度(0~12分)进行判断,得分越高,阳性率越高。评定时每个标本连续测定3次,在200倍光镜下取5个视野,取平均值。
1.3统计学方法 采用SPSS22.0软件完成数据分析,P<0.05表示差异有统计学意义。两组患者计量资料之间差异采用独立样本t检验分析;两组患者计数资料采用χ2检验。
2 结果
2.1结肠癌肿瘤组织和癌旁组织中TIDC及其表型差异 与癌旁组织比较,肿瘤组织中TIDC数密度显著降低[(12.97±2.89)%vs (9.93±2.25)%,P=0.000];MHC-Ⅱ阳性DC显著降低[(12.16±2.34)% vs (6.62±2.04)%,P=0.000];CD54阳性DC显著降低[(11.98±2.24)%vs(7.58±2.74)%]。见表1,图1。
2.2结肠癌组织中TIDC数密度及其表型与临床特征的相关性 结肠癌组织中TIDC数密度、MHC-Ⅱ阳性DC和CD54阳性DC与年龄、性别、肿瘤直径和肿瘤细胞类型无明显相关性(P>0.05)。与肿瘤细胞为高分化的患者相比,中低分化的患者TIDC数密度显著降低[(11.24±1.99)%vs(8.65±1.70)%,P=0.00]。与临床TNM分期为Ⅱ期的患者相比,Ⅲ期的患者TIDC数密度显著降低[(10.94±1.97)%vs (7.91±1.17)%,P=0.000];MHC-Ⅱ阳性DC显著降低[(7.04±1.96)%vs (5.78±1.96)%,P=0.001];CD54阳性DC显著降低[(8.49±2.62)%vs (5.75±1.99)%,P=0.00]。与术后6月内未复发的患者相比,复发的患者TIDC数密度显著降低[(10.29±1.76)%vs (6.82±1.88)%,P=0.000];MHC-Ⅱ阳性DC显著降低[(9.00±1.78)%vs (5.33±1.94)%,P=0.001];CD54阳性DC显著降低[(10.44±1.87)%vs (5.19±1.98)%,P=0.00]。见表2。
表1结肠癌肿瘤组织和癌旁组织中TIDC及表型差异
Tab.1ColoncancerandadjacenttissueTIDCandphenotypedifferences
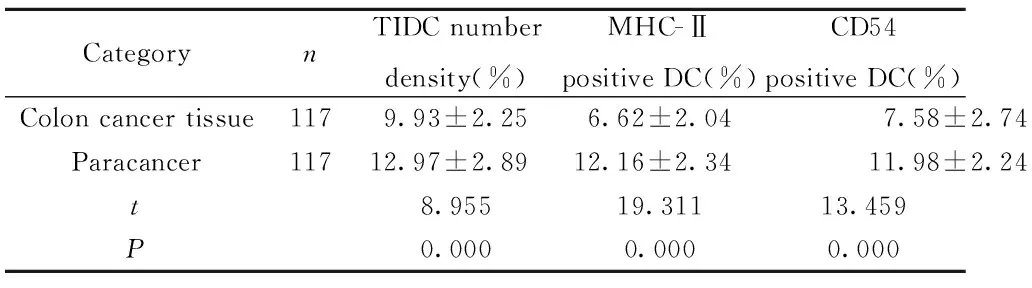
CategorynTIDC numberdensity(%)MHC-Ⅱpositive DC(%)CD54positive DC(%)Colon cancer tissue1179.93±2.256.62±2.047.58±2.74Paracancer11712.97±2.8912.16±2.3411.98±2.24t8.95519.31113.459P0.0000.0000.000
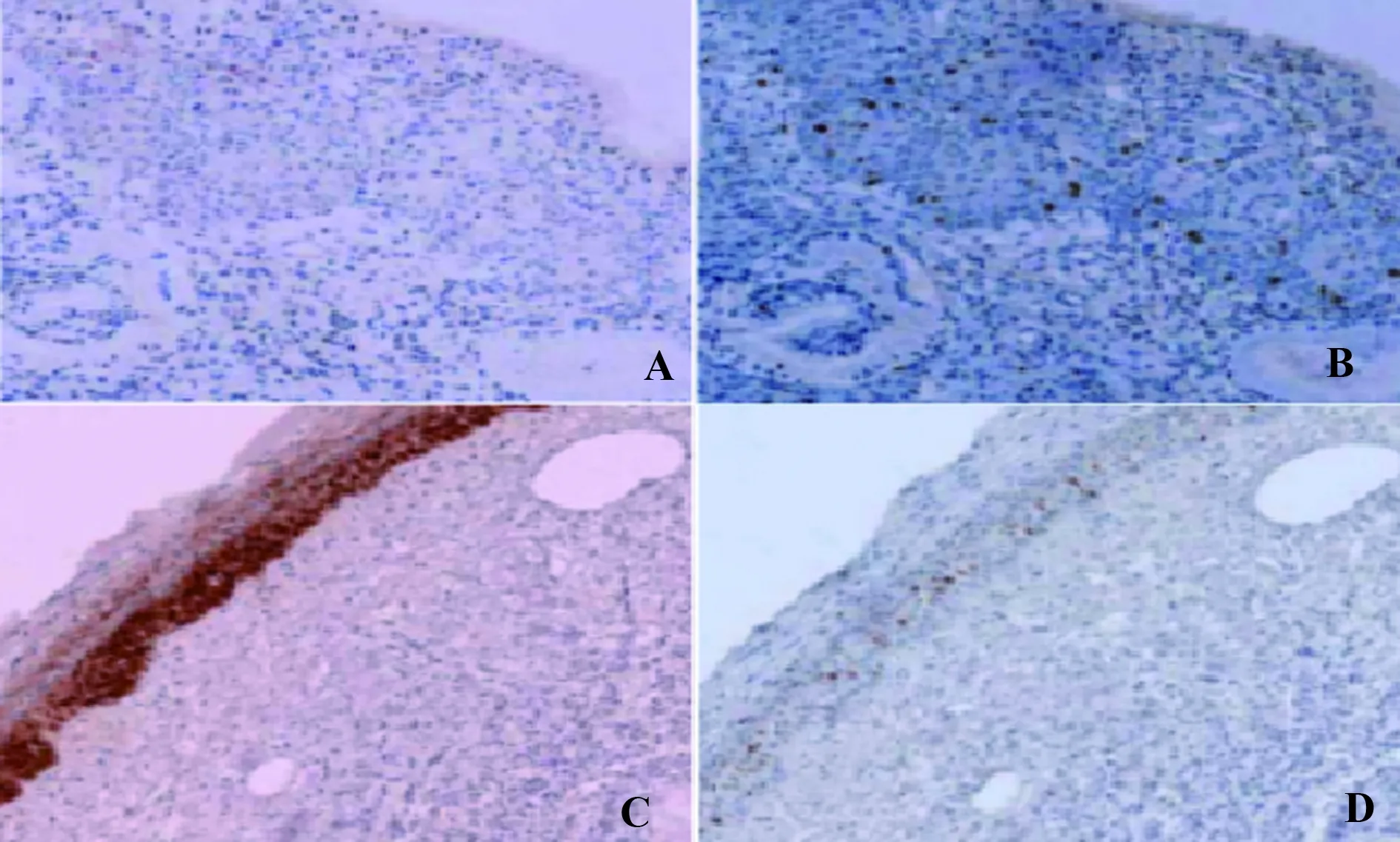
图1 结肠癌组织与癌旁组织免疫组化结果(×200)Fig.1 Immunohistochemical results of colon cancer tiss-ues and adjacent tissues(×200)Note: A.Results of TIDC immunohistochemistry in colon cancer tissue;B.Results of TIDC immunohistochemistry in adjacent tissues;C.Results of immunohistochemistry of colon cancer CD54;D.Results of CD54 immunohistochemistry of adjacent tissues.
表2结肠癌组织中TIDC数密度及其表型与临床特征的相关性分析
Tab.2CorrelationanalysisofTIDCnumberdensityanditsphenotypeandclinicalfeaturesincoloncancertissues
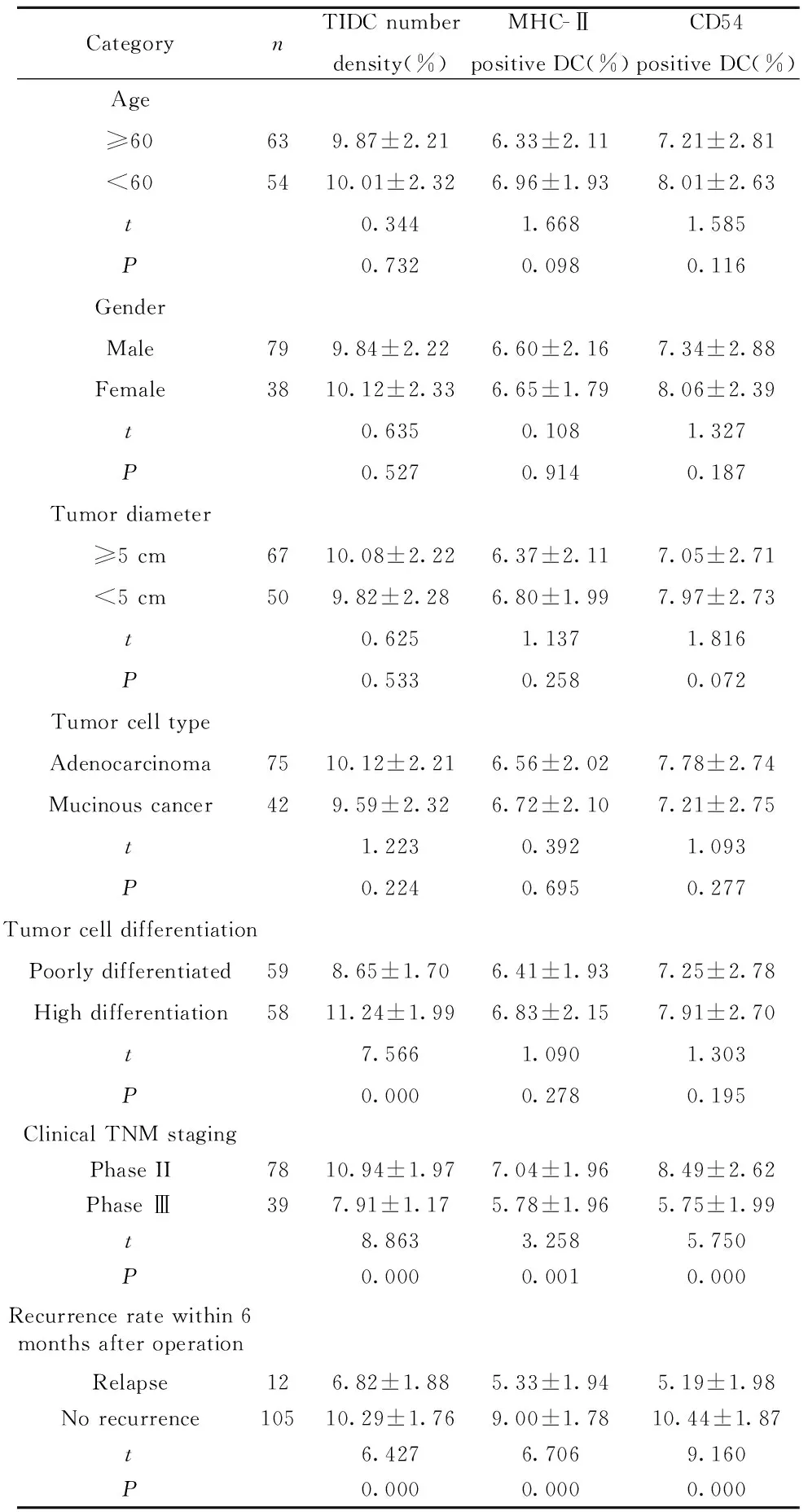
CategorynTIDC numberdensity(%)MHC-Ⅱpositive DC(%)CD54positive DC(%)Age≥60639.87±2.216.33±2.117.21±2.81<605410.01±2.326.96±1.938.01±2.63t0.3441.6681.585P0.7320.0980.116GenderMale799.84±2.226.60±2.167.34±2.88Female3810.12±2.336.65±1.798.06±2.39t0.6350.1081.327P0.5270.9140.187Tumor diameter≥5 cm6710.08±2.226.37±2.117.05±2.71<5 cm509.82±2.286.80±1.997.97±2.73t0.6251.1371.816P0.5330.2580.072Tumor cell typeAdenocarcinoma7510.12±2.216.56±2.027.78±2.74Mucinous cancer429.59±2.326.72±2.107.21±2.75t1.2230.3921.093P0.2240.6950.277Tumor cell differentiationPoorly differentiated598.65±1.706.41±1.937.25±2.78High differentiation5811.24±1.996.83±2.157.91±2.70t7.5661.0901.303P0.0000.2780.195Clinical TNM stagingPhase II7810.94±1.977.04±1.968.49±2.62Phase Ⅲ397.91±1.175.78±1.965.75±1.99t8.8633.2585.750P0.0000.0010.000Recurrence rate within 6months after operationRelapse126.82±1.885.33±1.945.19±1.98No recurrence10510.29±1.769.00±1.7810.44±1.87t6.4276.7069.160P0.0000.0000.000
3 讨论
结肠癌是中老年最常见的恶性肿瘤之一,早期即可通过淋巴结、血液循环等转移,是威胁中老年人身心健康的重要疾病之一[6,7]。目前研究已证实结肠癌的转移与免疫有关,尤其是肿瘤微环境中的免疫功能[8,9]。DC可以作为肿瘤患者的一种抗原呈递细胞,刺激细胞毒性T细胞等的增殖,进而对肿瘤细胞进行杀伤。而DC细胞在特定环境下可以表现为免疫抑制作用,这部分DC细胞是不成熟或分化异常的DC细胞组成,主要表现为MHCⅡ和CD54阳性率低下[10-12]。目前,关于DC细胞在结肠癌组织中的表达及临床意义尚未清楚。本研究显示与癌旁组织比较,结肠癌组织中TIDC及MHCⅡ、CD54阳性率均明显下降,提示TIDC在结肠癌组织中低表达,且多为不成熟的DC细胞,其抗原呈递能力下降,从而介导了肿瘤细胞对机体的免疫耐受。另外,本研究显示,肿瘤细胞分化程度为中低分化的患者TIDC数密度显著低于高分化的患者;TNM分期为Ⅲ期的患者TIDC数密度及MHCⅡ、CD54阳性率均显著低于TNM分期为Ⅱ期的患者。进一步证实了结肠癌组织中TIDC降低,且分化未成熟与患者临床预后恶化有关。
2015年我国学者张子杰等[13]研究显示结肠癌组织中、外周血DC细胞显著降低,该研究支持本研究,但该研究未探讨结肠癌组织中TIDC与患者临床特征的相关性。研究显示TIDC在结肠癌组织中与临床分期、病理分化程度和淋巴结转移有关,与年龄、性别和肿瘤病理组织学类型无关[14]。该研究同样支持本研究,不过本研究还同时探讨了DC细胞的分型,发现肿瘤组织中成熟DC细胞比例下降,因此本文具有一定的临床意义。DC细胞是一种抗原呈递细胞,在肿瘤免疫中发挥重要作用,DC水平降低将导致机体对肿瘤降解产物的呈递能力降低,无法有效刺激细胞毒性T细胞的大量增殖,进而导致肿瘤细胞对机体的免疫耐受[15,16]。另外,本研究显示结肠癌组织中成熟DC细胞比例下降,不成熟的DC细胞具有免疫抑制作用,可以分泌多种免疫抑制细胞因子,促进Th1/Th2细胞免疫向Th2免疫漂移[17,18]。目前,关于DC在结肠癌中的作用尚处于研究阶段。2015年Radej等[19]研究显示结肠癌细胞降解产物可以刺激DC细胞增殖和成熟。DC细胞在结肠癌中的价值为以后的研究提供了新方向。
综上所述,肿瘤浸润性树突状细胞在结肠癌组织中低表达,不成熟的调节性树突状细胞比例增加。
