趋化因子RANTES、IL-17以及TGF-β1在HBV-GN患者应用激素及免疫抑制剂的趋势研究①
2018-10-26王晓玲郝金翠王春燕宋君宇孟莉丹王学敏张颖轩
王晓玲 郝金翠 王春燕 宋君宇 孟莉丹 赵 讯 王学敏 张颖轩
(衡水市哈励逊国际和平医院肾内科,衡水053000)
据世界卫生组织报道,全球约20亿人曾感染乙型肝炎病毒(Hepatitis B virus,HBV),其中2.4亿人为慢性HBV感染者,部分患者慢慢会发展至慢性乙型肝炎(简称乙肝)、重症型肝炎,甚至最后会进展成肝硬化、肝衰竭、肝癌等[1,2]。而肾脏是HBV感染重要的肝外损伤的靶器官,乙型肝炎病毒相关性肾炎(Hepatitis B virus associated glomerulonephritis,HBV-GN)在我国的发病率呈逐年上升的趋势[3]。由于HBV-GN迁延不愈,预后较差,缺乏有效的治疗方案,因此很多HBV-GN患者最终会进入终末期肾衰竭的程度[4]。目前,寻找安全有效的治疗药物成为HBV-GN领域亟需解决的难题。对于部分肾炎患者,糖皮质激素联合免疫抑制剂是最主要的治疗方案,但是可能会促进低表达的HBV再次激活和复制,根据2015年最新颁布的《慢性乙型肝炎防治指南》[2]中指出,慢性HBV感染患者由于合并其他疾病在长期接受免疫抑制治疗时易出现不同程度的乙型肝炎再活动,因此糖皮质激素联合免疫抑制剂治疗疗程不宜过量,需合理控制剂量,密切监测相关因子的表达,以免出现肝炎再燃。有研究显示,免疫功能紊乱是HBV-GN的发病基础,其中调节活化正常T细胞表达和分泌的细胞因子(Regulated on activation normal T cell expressed and screted,RANTES)、白介素-17(Interleukin 17,IL-17)、转化生长因子β1(Transforming growth factor β1,TGF-β1)的变化与机体内环境紊乱密切相关,笔者希望通过观察HBV DNA阴性的HBV-GN患者长期接受糖皮质激素联合免疫抑制剂治疗后RANTES、IL-17、TGF-β1等趋化因子的变化趋势以及与临床疗效的相关性,为RANTES、IL-17、TGF-β1是否可作为糖皮质激素联合免疫抑制剂治疗后临床疗效的预测指标提供实验室参考。现研究报告如下:
1 资料与方法
1.1资料
1.1.1临床资料 选取2012年1月至2016年5月期间在我院肾内科住院接受治疗的HBV-GN患者40例,其中男性患者31例,女性患者9例,年龄21~72岁,平均年龄(45.29±12.62)岁;病程0.5~40个月,平均(7.28±6.96)个月。所有患者HBV-DNA<1.0×103copies/ml,蛋白尿>1 g/24 h所有患者经肾穿刺确诊为继发性HBV-GN患者,均接受糖皮质激素联合免疫抑制剂治疗。本项研究已获得我院伦理委员会的批准。
1.1.2入选标准 (1)所有患者均符合HBV-GN诊断标准[5]:①临床上出现水肿、蛋白尿、血尿等肾病或肾炎综合征的临床指征;②肾组织免疫病理发现HBV抗原;(2)HBsAg、HBeAb阳性;(3)HBV-DNA<1.0×103copies/ml;(4)由患者或患者家属签署知情同意书。
1.1.3排除标准 (1)不符合上述纳入标准的患者;(2)合并乙肝以外的其他组织感染、HBV感染导致的肝硬化、肝衰竭者;(3)既往有免疫抑制剂治疗史;(4)合并其他血液系统、消化系统等疾病或者恶性肿瘤患者;(5)精神障碍患者;(6)依从性差的患者等。
1.2方法
1.2.1治疗方案 所有患者先给予环孢素A治疗剂,量为5 mg/(kg·d),蛋白尿降至0.5 g时逐渐减量,总疗程6个月~1年;并联合使用甲泼尼松龙片[1 mg/(kg·d)],8周后开始逐渐减量,2~3周减原剂量的10%,当减至20 mg/d时,病情易复发,应更加缓慢减量,最后以最小有效剂量(10 mg/d)维持半年左右,直至停药。
1.2.2观察指标 随访6个月,所有患者于治疗前至治疗6个月抽取空腹静脉血以及尿液样本(每4周1次),采用ELISA试剂盒(由上海西唐生物科技有限公司提供,美国R&D公司生产,按照试剂盒说明书进行操作)检测患者血清及尿中RANTES、IL-17、TGF-β1水平,由我院化验室检查患者血清白蛋白(ALB)、丙氨酸转氨酶(ALT)、三酰甘油(TG)、总胆红素(TBIL)、结合胆红素(DBIL)、血肌酐(Scr)、内生肌酐清除率(CCR)、尿素氮(BUN)情况、蛋白尿排泄情况、肝肾功能缓解情况。
1.2.3疗效评定标准 ①完全缓解:临床症状完全消失,尿蛋白<0.3 g/d,肾功能稳定,ALB≥35 g/L,ALT正常;②部分缓解:尿蛋白和ALT较治疗前下降>50%,肾功能稳定,ALB>30 g/L;③治疗失败:临床症状和实验室检查指标均未得到改善,24 h尿蛋白量较之前下降<30%,或ALB<30 g/L,肾小球滤过率下降。
1.3统计学处理 采用SPSS21.0统计学软件进行统计学检验,计量资料采用单因素方差分析;计数资料采用χ2检验或Fisher确切概率法检验。各因子水平与临床效的关系采用Pearson相关性分析,P<0.05表示差异具有统计学意义。
2 结果
2.1实验室检查参数指标变化 自治疗8周起,平均24 h蛋白尿含量、TG较治疗前明显降低(P<0.05),而ALB较治疗前明显升高(P<0.05)。患者ALT直至保持正常值范围。另外,患者Scr和CCR平均水平值基本保持正常,差异无统计学变化(P>0.05)。说明患者肾功能、肝功能以及血脂水平较治疗前有明显改善。见表1、2。
2.2临床疗效分析 经治疗24周,14例(35.0%)患者完全缓解,15例(37.5%)患者部分缓解,治疗总缓解率为72.5%。见表3。
2.3HBV-DNA复燃情况 患者治疗4周后,有1例(2.5%)患者发生HBV-DNA转阳性,治疗24周后,9例(22.5%)患者出现HBV-DNA转阳性,与治疗4周相比,转阳率明显增加,差异有统计学意义(P<0.05)。见表4。
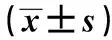
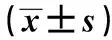
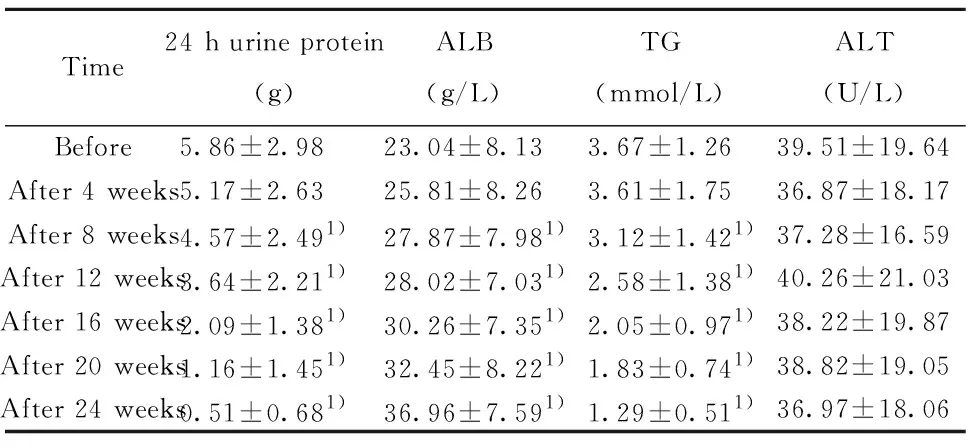
Time24 h urine protein(g)ALB(g/L)TG(mmol/L)ALT(U/L)Before5.86±2.9823.04±8.133.67±1.2639.51±19.64After 4 weeks5.17±2.6325.81±8.263.61±1.7536.87±18.17After 8 weeks4.57±2.491)27.87±7.981)3.12±1.421)37.28±16.59After 12 weeks3.64±2.211)28.02±7.031)2.58±1.381)40.26±21.03After 16 weeks2.09±1.381)30.26±7.351)2.05±0.971)38.22±19.87After 20 weeks1.16±1.451)32.45±8.221)1.83±0.741)38.82±19.05After 24 weeks0.51±0.681)36.96±7.591)1.29±0.511)36.97±18.06
Note:Vs before treatment,1)P<0.05.
表2患者经治疗后肝功能参数指标异常占比[n(%)]
Tab.2Livercharacteristicsofpatientsaftertreatment[n(%)]
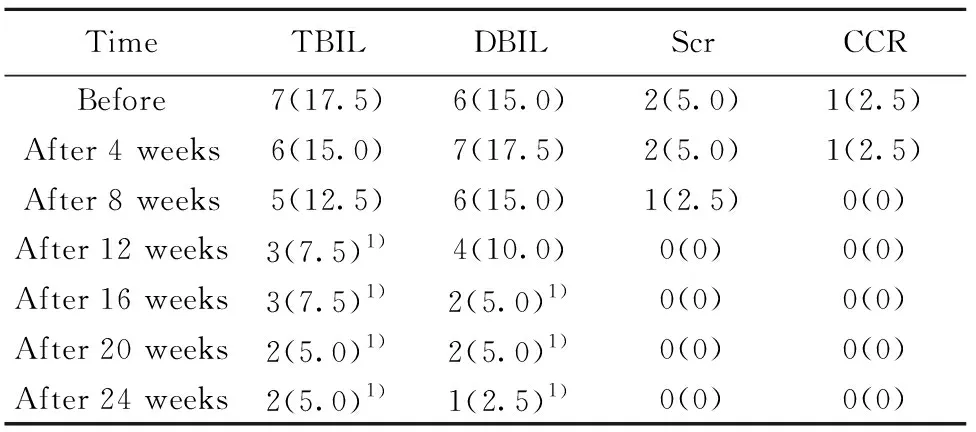
TimeTBILDBILScrCCRBefore7(17.5)6(15.0)2(5.0)1(2.5)After 4 weeks6(15.0)7(17.5)2(5.0)1(2.5)After 8 weeks5(12.5)6(15.0)1(2.5)0(0)After 12 weeks3(7.5)1)4(10.0)0(0)0(0)After 16 weeks3(7.5)1)2(5.0)1)0(0)0(0)After 20 weeks2(5.0)1)2(5.0)1)0(0)0(0)After 24 weeks2(5.0)1)1(2.5)1)0(0)0(0)
Note:Vs before treatment,1)P<0.05.
2.4患者RANTES、IL-17及TGF-β1水平的变化治疗前,所有患者HBV-DNA均为阴性,经治疗后,相同时间点检测HBV-DNA转阳的患者血清中RANTES、IL-17、TGF-β1的含量均高于HBV-DNA一直为阴性的患者,差异有统计学意义(P<0.05)。但是随着治疗时间的延长,HBV-DNA(-)患者血清中平均RANTES、IL-17、TGF-β1的含量均低于治疗前,差异有统计学意义(P<0.05);而HBV-DNA(+)患者血清中平均RANTES、IL-17、TGF-β1的含量均低于治疗4周后,差异有统计学意义(P<0.05)。提示,HBV-DNA转阳后,在肝细胞内复制,可引发一系列免疫反应;而肾炎也存在免疫性炎症介导的病理损伤,经糖皮质激素联合免疫抑制剂治疗后,炎症反应得到一定的控制,趋化因子RANTES、IL-17以及TGF-β1的含量较治疗前有所降低。见表5。
2.5RANTES、IL-17及TGF-β1与临床疗效的相关性分析 经Pearson相关性分析,RANTES、IL-17和TGF-β1水平与HBV-GN患者接受糖皮质激素联合免疫抑制治疗后临床疗效密切相关。RANTES、IL-17和TGF-β1水平越低,患者缓解率越高,可作为临床疗效的评估指标。
表3患者经治疗后肾炎缓解情况[n(%)]
Tab.3ResponseofpatientswithHBV-GN[n(%)]

TimeComplete responsePartial responseProgressive diseaseTotal response rateAfter 4 weeks03(7.5)37(92.5)3(7.5)After 8 weeks3(7.5)3(7.5)34(85.0)6(15.0)After 12 weeks6(15.0)8(20.0)26(65.0)14(35.0)After 16 weeks8(20.0)12(30.0)20(50.0)20(50.0)After 20 weeks12(30.0)13(32.5)15(37.5)25(62.5)After 24 weeks14(35.0)15(37.5)11(27.5)29(72.5)
表4患者经治疗后HBV-DNA复燃情况[n(%)]
Tab.4NumberofpatientswithHBV-DNA(+)[n(%)]
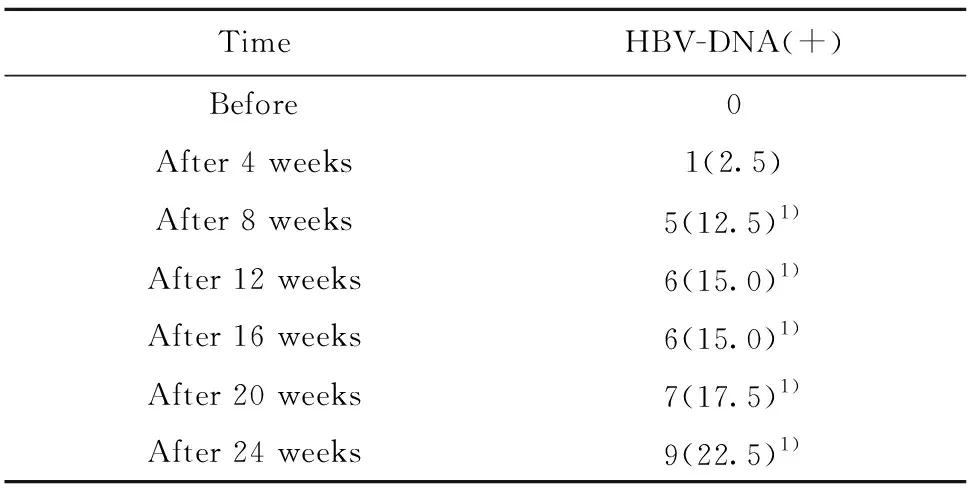
TimeHBV-DNA(+)Before0After 4 weeks1(2.5)After 8 weeks5(12.5)1)After 12 weeks6(15.0)1)After 16 weeks6(15.0)1)After 20 weeks7(17.5)1)After 24 weeks9(22.5)1)
Note:Vs after treatment of 4 weeks,1)P<0.05.
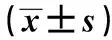
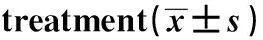
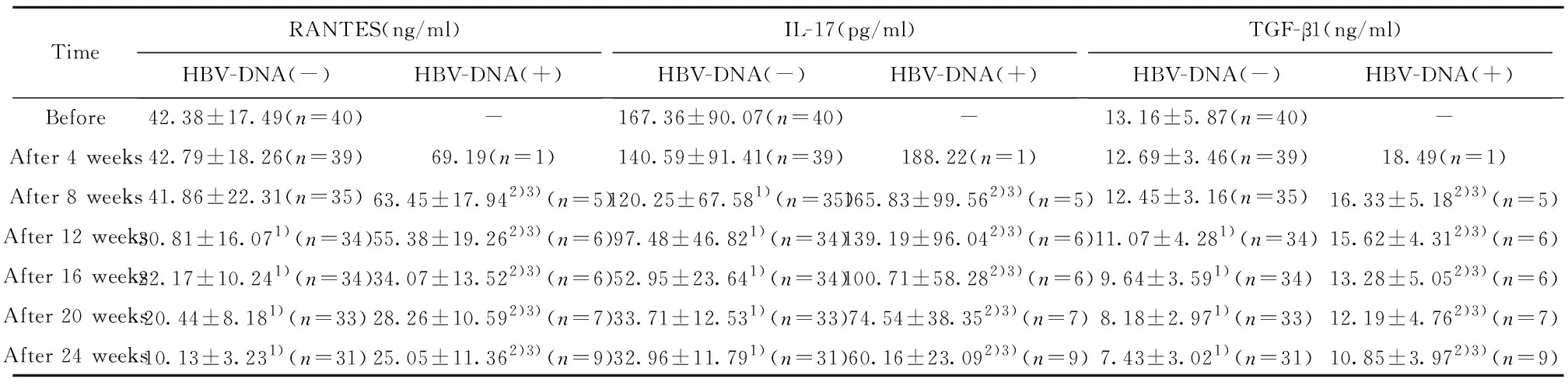
TimeRANTES(ng/ml)HBV-DNA(-)HBV-DNA(+)IL-17(pg/ml)HBV-DNA(-)HBV-DNA(+)TGF-β1(ng/ml)HBV-DNA(-)HBV-DNA(+)Before42.38±17.49(n=40)-167.36±90.07(n=40)-13.16±5.87(n=40)-After 4 weeks42.79±18.26(n=39)69.19(n=1)140.59±91.41(n=39)188.22(n=1)12.69±3.46(n=39)18.49(n=1)After 8 weeks41.86±22.31(n=35)63.45±17.942)3)(n=5)120.25±67.581)(n=35)165.83±99.562)3)(n=5)12.45±3.16(n=35)16.33±5.182)3)(n=5)After 12 weeks30.81±16.071)(n=34)55.38±19.262)3)(n=6)97.48±46.821)(n=34)139.19±96.042)3)(n=6)11.07±4.281)(n=34)15.62±4.312)3)(n=6)After 16 weeks22.17±10.241)(n=34)34.07±13.522)3)(n=6)52.95±23.641)(n=34)100.71±58.282)3)(n=6)9.64±3.591)(n=34)13.28±5.052)3)(n=6)After 20 weeks20.44±8.181)(n=33)28.26±10.592)3)(n=7)33.71±12.531)(n=33)74.54±38.352)3)(n=7)8.18±2.971)(n=33)12.19±4.762)3)(n=7)After 24 weeks10.13±3.231)(n=31)25.05±11.362)3)(n=9)32.96±11.791)(n=31)60.16±23.092)3)(n=9)7.43±3.021)(n=31)10.85±3.972)3)(n=9)
Note:Vs before treatment,1)P<0.05;vs HBV-DNA (-),2)P<0.05;vs HBV-DNA (-) patients after treatment of 4 weeks,3)P<0.05.
表6RANTES、IL-17及TGF-β1水平与临床疗效的相关性
Tab.6CorrelationofRANTES,IL-17andTGF-β1andclinicaleffect
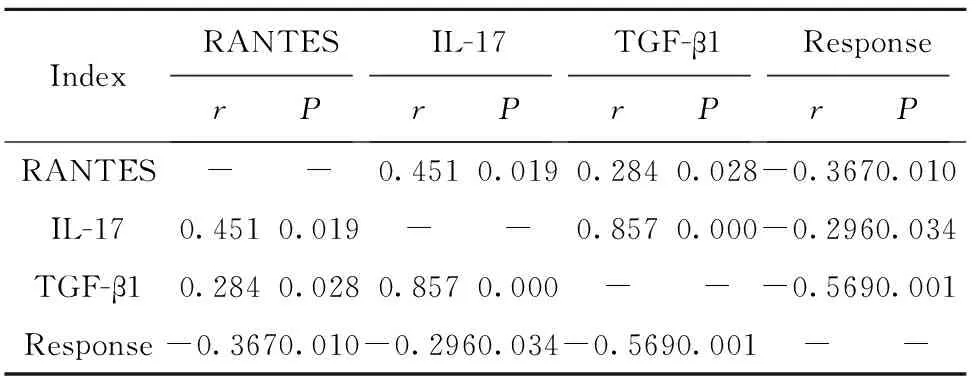
IndexRANTESrPIL-17rPTGF-β1rPResponserPRANTES--0.4510.0190.2840.028-0.3670.010IL-170.4510.019--0.8570.000-0.2960.034TGF-β10.2840.0280.8570.000---0.5690.001Response-0.3670.010-0.2960.034-0.5690.001--
3 讨论
HBV是目前全球最流行的嗜肝病毒之一,除了引起肝损伤以外,还易引发肝外损害,例如肾炎[6]。自上世纪70年代以来,HBV-GN逐渐引起各国的普遍关注,但是其发病机制尚不清楚[7]。近年来,由于肾穿刺活检技术的普及,HBV-GN的确诊率相应增加,但是对于治疗方案的选择一直是困扰临床治疗的难题。糖皮质激素联合免疫抑制剂通常是临床上较为常见的治疗HBV-GN的方案之一[8,9]。由于对于HBV-GN患者的治疗需要同时考虑乙肝和肾炎两个方面的干预,在控制病因、缓解临床症状的同时,还需要保护肝肾功能。2015年,由我国中华医学会肝病学分会和感染病学分会最新颁布的《慢性乙型肝炎防治指南》[5]中指出,对于所有因其他疾病而接受化疗、免疫抑制剂治疗的患者,在起始治疗前都应常规筛查HBsAg、抗-HBc和HBV DNA,并评估接受免疫抑制剂的风险程度。部分抗HBs和抗HBc抗体双阳性的患者在接受中、高危类免疫抑制剂治疗时,可出现HBV再激活,进而导致肝炎复发的情况。因此建议密切监测这类患者HBV血清标志物、所使用的免疫抑制剂药物特性及HBV感染后肝脏疾病状态,综合评估,为患者制定安全有效的治疗措施。因此糖皮质激素虽然抑制了免疫损伤但同时也减弱了对HBV-DNA病毒复制的抑制作用,易引起HBV病毒复制的再度激活,而联合免疫抑制剂治疗后,适当降低糖皮质激素的给药剂量,缩短治疗时间,不仅可以抑制机体的免疫紊乱,对HBV复燃的影响也较小[10,11]。本研究选择HBV DNA阴性的患者进行资料分析,旨在探讨糖皮质激素联合免疫抑制剂治疗,对炎性因子的影响以及引发HBV复燃的风险,为是否需要接受抗病毒治疗提供参考依据。结果证实,小剂量糖皮质激素联合霉酚酸酯治疗HBV-DNA(-)的HBV-GN患者24周后,14例(35.0%)患者完全缓解,15例(37.5%)患者部分缓解,治疗总有效率为72.5%。另外,患者治疗4周后,有5例(12.5%)患者发生HBV-DNA转阳性,治疗24周后,18例(45.0%)患者出现HBV-DNA转阳性,与治疗4周相比,转阳率明显增加,差异有统计学意义(P<0.05)。患者自治疗8周起,平均24 h蛋白尿含量、TG、BUN较治疗前明显降低(P<0.05),而ALB较治疗前明显升高(P<0.05)。自治疗16周起,患者ALT含量较治疗前有明显降低(P<0.05)。说明患者肾功能、肝功能以及血脂水平较治疗前有明显改善。提示对于HBV复制指标为阴性的HBV-GN患者,糖皮质激素联合免疫抑制剂的治疗效果较为理想,但是治疗过程中需密切监测患者的HBV-DNA转阳情况以及肝功能各项指标。对于转阳患者,需及时进行抗病毒治疗。
临床上,HBV-GN以肾病综合征最为常见[12],研究表明,免疫功能紊乱是HBV-GN的发病基础,糖皮质激素可以抑制机体的免疫损伤,免疫抑制剂可以延缓HBV-GN患者肾病的进展[13]。由活化的T细胞产生的趋化因子RANTES主要作用于单核巨噬细胞、T淋巴细胞和嗜酸性粒细胞等,诱导多种炎性因子过量表达,从而促进炎症反应的发生[14]。肾脏和肝脏固有细胞均可分泌RANTES,趋化炎症细胞浸润到局部,加速病情的进展[15]。另外,IL-17属于T细胞诱导的炎症反应的早期启动因子,与炎症反应和免疫紊乱密切相关[16]。而TGF-β1对IL-17的分化具有重要作用。因此这三种炎性因子在HBV-GN患者血清中的表达情况如何是我们研究的关键。患者经治疗后,相同时间点检测HBV-DNA转阳的患者血清中RANTES、IL-17、TGF-β1的含量均高于HBV-DNA一直为阴性的患者,但是随着治疗时间的延长,HBV-DNA(-)患者血清中平均RANTES、IL-17、TGF-β1的含量均低于治疗前,而HBV-DNA(+)患者血清中平均RANTES、IL-17、TGF-β1的含量均低于治疗4周后,差异有统计学意义(P<0.05)。提示,HBV-DNA转阳后,在肝细胞内复制,可引发一系列免疫反应;而肾炎也存在免疫性炎症介导的病理损伤,经糖皮质激素联合免疫抑制剂治疗后,炎症反应得到一定的控制,趋化因子RANTES、IL-17以及TGF-β1的含量较治疗前有所降低。说明RANTES、IL-17、TGF-β1可作为评估HBV-GN预后的检测指标。在糖皮质激素联合免疫抑制剂治疗过程中,若患者RANTES、IL-17、TGF-β1血清含量升高,HBV复燃的风险大大增加,建议立即进行乙肝标志物检查同时给予抗病毒治疗,以免HBV再活动。
综上所述,小剂量糖皮质激素联合免疫抑制剂既有效避免了长时间、大剂量糖皮质激素对HBV-BNA复燃的影响,较理想地控制了肾炎损伤,RANTES、IL-17、TGF-β1可作为临床疗效的评估指标,RANTES、IL-17、TGF-β1水平越高,HBV-DNA患者复燃的可能性越大,建议行乙肝标志物检查,为下一步选择合理的治疗方案提供实验室指标参考。
