尼莫地平联合神经节苷脂治疗高血压脑出血的临床疗效及其对炎性因子、氧化应激的影响
2018-10-25吴兴富
吴兴富
高血压脑出血是指血压急剧升高导致脑血管破裂引起的脑出血,是晚期高血压的严重并发症之一,且其病死率、致残率较高[1]。高血压脑出血起病急,在数分钟或数小时内病情即可发展到高峰,并伴随剧烈头痛、恶心、呕吐、躁动、嗜睡或昏迷,严重威胁患者生命安全。近年来随着我国人口老龄化进程加速及饮食结构改变,高血压脑出血发病率呈逐年上升趋势[2-3]。既往研究表明,炎性因子、氧化应激与脑出血密切相关,且给予抗炎、抗氧化应激治疗后患者预后及神经功能明显改善[4]。尼莫地平属于第二代钙离子拮抗剂,可有效减轻脑组织缺血性损伤及颅内水肿,有效阻止钙离子进入细胞,缓解血管痉挛,降低血压。PASI等[5]发现脑组织损伤后细胞内神经节苷脂含量明显下降,进而引起神经元膜上钙离子内流、肌钙蛋白水解,最终导致神经元凋亡。本研究旨在观察尼莫地平联合神经节苷脂治疗高血压脑出血的临床疗效,并探讨其对炎性因子、氧化应激的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2016年8月—2017年8月成都市天府新区人民医院收治的高血压脑出血患者100例,均符合《高血压合并脑出血的临床诊治分析》[6]中的高血压脑出血诊断标准。纳入标准:(1)有高血压病史,并经颅脑CT/磁共振成像(MRI)检查确诊为脑出血;(2)发病至入院时间<24 h。排除标准:(1)合并脑疝、小脑出血者;(2)有脑出血、脑梗死、颅脑创伤病史者;(3)合并严重心脏、肝脏、肾脏、血液系统、自身免疫系统疾病及恶性肿瘤者;(4)对本研究所用药物过敏者。采用简单随机抽样法将所有患者分为对照组和观察组,每组50例。两组患者性别、年龄、出血量、出血部位比较,差异无统计学意义(P>0.05,见表1),具有可比性。本研究经成都市天府新区人民医院医学伦理委员会审核批准,所有患者自愿参与本研究并签署知情同意书。

表1 两组患者一般资料比较Table 1 Comparison of general information between the two groups
1.2 方法 对照组患者采用常规治疗,包括降血压、降颅内压、脱水、利尿、补液、营养神经、维持水电解质及酸碱平衡等。观察组患者在对照组基础上采用微量注射泵静脉泵注尼莫地平注射液(扬子江药业集团有限公司生产,国药准字H20045275)10 mg,1次/12 h;同时静脉滴注神经节苷脂(长春翔通药业有限公司生产,国药准字H20066833)40 mg,1次/d,两组患者均连续治疗2周。
1.3 观察指标
1.3.1 临床疗效 比较两组患者临床疗效。临床疗效判定标准[7]:以治疗后美国国立卫生研究院卒中量表(NIHSS)评分减少91%~100%为基本痊愈;以治疗后NIHSS评分减少46%~90%为显著进步;以治疗后NIHSS评分减少18%~45%为进步;以治疗后NIHSS评分减少或增加<18%为无变化;以治疗后NIHSS评分增加≥18%为恶化;死亡。
1.3.2 NIHSS评分 比较两组患者治疗前后NIHSS评分,NIHSS包括意识水平、凝视、视野、面瘫、上肢运动、下肢运动、共济失调、感觉、语言、构音障碍、忽视症,总分42分,评分越高表明患者神经功能损伤越严重。
1.3.3 炎性因子 分别于治疗前后采集两组患者静脉血5 ml,3 000 r/min离心5 min(离心半径10 cm),分离血清并置于-80℃环境下保存待测,采用THERMO生产的Multiskan FC全自动酶标仪检测血清白介素6(IL-6)、C反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)水平。
1.3.4 氧化应激指标 采用世诺科技有限公司生产的752可见光分光光度计检测髓过氧化物酶(MPO)、脂质过氧化物(LPO)、丙二醛(MDA)、超氧化物歧化酶(SOD)。
1.3.5 不良反应 观察两组患者治疗期间不良反应发生情况。
1.4 统计学方法 采用SAS 9.3统计学软件进行数据分析,计量资料以(x ±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;计数资料以相对数表示,采用χ2检验;等级资料分析采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 观察组患者临床疗效优于对照组,差异有统计学意义(Z=2.285,P=0.022,见表2)。
2.2 NIHSS评分 治疗前两组患者NIHSS评分比较,差异无统计学意义(P>0.05);治疗后观察组患者NIHSS评分低于对照组,差异有统计学意义(P<0.05,见表3)。
2.3 血清炎性因子水平 治疗前两组患者血清IL-6、CRP、TNF-α水平比较,差异无统计学意义(P>0.05);治疗后观察组患者血清IL-6、CRP、TNF-α水平低于对照组,差异有统计学意义(P<0.05,见表4)。
2.4 氧化应激指标 治疗前两组患者MPO、LPO、MDA、SOD比较,差异无统计学意义(P>0.05);治疗后两组患者MPO、LPO、MDA低于对照组,SOD高于对照组,差异有统计学意义(P<0.05,见表5)。
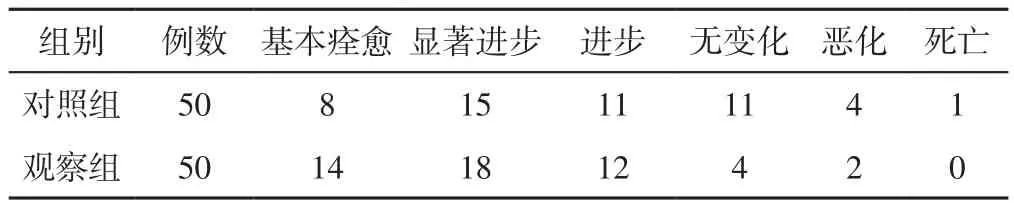
表2 两组患者临床疗效比较(例)Table 2 Comparison of clinical effect between the two groups
表3 两组患者治疗前后NIHSS评分比较(±s,分)Table 3 Comparison of NIHSS score between the two groups before and after treatment
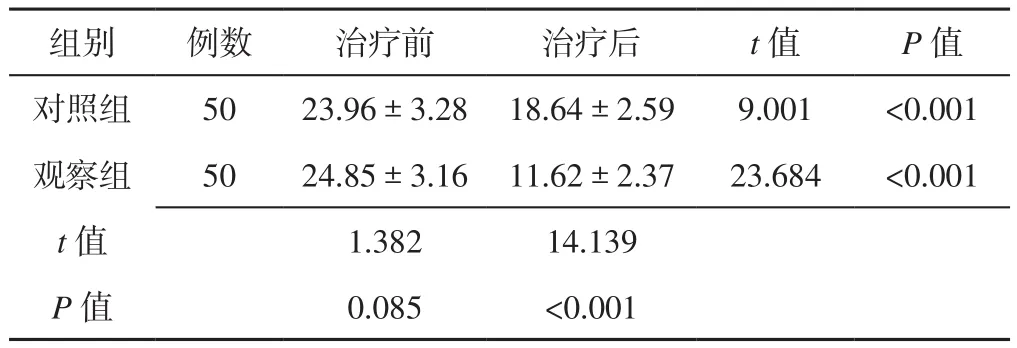
表3 两组患者治疗前后NIHSS评分比较(±s,分)Table 3 Comparison of NIHSS score between the two groups before and after treatment
组别 例数 治疗前 治疗后 t值 P值对照组 50 23.96±3.28 18.64±2.59 9.001 <0.001观察组 50 24.85±3.16 11.62±2.37 23.684 <0.001 t值 1.382 14.139 P值 0.085 <0.001
2.5 不良反应 治疗期间,对照组患者发生呕吐1例、发热1例,不良反应发生率为4.0%;观察组患者发生口唇发绀1例、肢端发绀1例、血小板计数减少1例,不良反应发生率为6.0%。两组患者治疗期间不良反应发生率比较,差异无统计学意义(χ2=0.210,P=0.646)。
3 讨论
高血压脑出血发生时脑部暂时/持续性出血会导致颅内水肿形成并压迫周围脑组织,进而引起脑血流动力学障碍,导致血流减少;血流减少又可激活黄嘌呤反应体系,导致自由基增多、颅内水肿加重,进而引发全身炎症反应;炎性反应又可促进颅内水肿,形成恶性循环,最终导致脑组织功能紊乱[8]。既往研究表明,缺血缺氧、再灌注损伤均可激活氧化应激,导致自由基、过氧化物等大量产生并直接损伤脑组织,进一步加重炎性反应、血管内皮功能损伤等[9-10]。因此,在积极治疗原发病的同时减轻氧化应激及炎性反应对改善高血压脑出血患者预后具有重要意义。
表4 两组患者治疗前后血清炎性因子水平比较(±s)Table 4 Comparison of serum inflammatory cytokines level between the two groups before and after treatment

表4 两组患者治疗前后血清炎性因子水平比较(±s)Table 4 Comparison of serum inflammatory cytokines level between the two groups before and after treatment
注:IL-6=白介素6,CRP=C反应蛋白,TNF-α=肿瘤坏死因子α
IL-6(μg/L) t值 P值 CRP(mg/L) t值 P值 TNF-α(μg/L) t值 P值治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 50 112.46±12.25 56.88±9.07 25.784 <0.001 57.95±6.28 36.12±5.06 19.140 <0.001 90.76±12.02 44.85±9.65 21.060 <0.001观察组 50 113.52±12.54 41.25±8.62 33.583 <0.001 58.74±6.35 27.41±4.22 29.056 <0.001 91.28±12.06 33.16±8.24 28.137 <0.001 t值 0.482 8.833 0.625 9.348 0.216 6.514 P值 0.335 <0.001 0.267 <0.001 0.415 <0.001组别 例数
表5 两组患者治疗前后氧化应激指标比较(±s)Table 5 Comparison of index of oxidative stress between the two groups before and after treatment
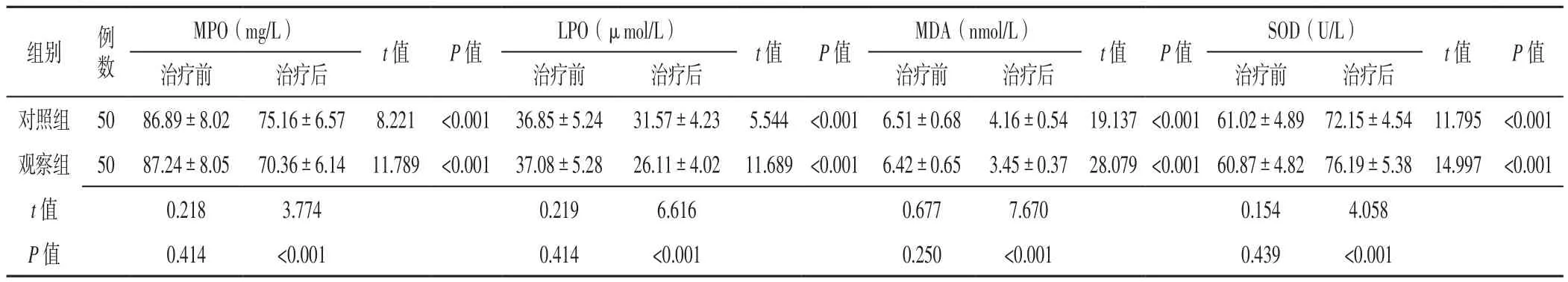
表5 两组患者治疗前后氧化应激指标比较(±s)Table 5 Comparison of index of oxidative stress between the two groups before and after treatment
注:MPO=髓过氧化物酶,LPO=脂质过氧化物,MDA=丙二醛,SOD=超氧化物歧化酶
t值 P值治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 50 86.89±8.02 75.16±6.57 8.221 <0.001 36.85±5.24 31.57±4.23 5.544 <0.001 6.51±0.68 4.16±0.54 19.137 <0.00161.02±4.89 72.15±4.54 11.795 <0.001观察组 50 87.24±8.05 70.36±6.14 11.789 <0.001 37.08±5.28 26.11±4.02 11.689 <0.001 6.42±0.65 3.45±0.37 28.079 <0.00160.87±4.82 76.19±5.38 14.997 <0.001 t值 0.218 3.774 0.219 6.616 0.677 7.670 0.154 4.058 P 值 0.414 <0.001 0.414 <0.001 0.250 <0.001 0.439 <0.001组别 例数MPO(mg/L)LPO(μmol/L)MDA(nmol/L)SOD(U/L)t值 P值t值 P值t值 P值
尼莫地平可透过血-脑脊液屏障减少缺血部位神经元因钙离子聚集而导致的坏死,缓解病灶处血管痉挛,促进脑血流恢复正常。神经节苷脂是由猪脑提取的神经保护物,可促进神经组织重构,抑制损伤后继发性神经退化等;神经节苷脂与缺损神经存在高亲和力,可修复细胞膜,提高Ca2+-ATP酶及Na+-K+-ATP酶活性,纠正水电解质、酸碱失衡,降低颅内水肿发生率;此外,其还有利于细胞再生。
既往研究表明,尼莫地平联合神经节苷脂治疗高血压脑出血的总有效率为94.3%,可有效改善患者临床症状,促进神经功能恢复,减少高血压脑出血后水肿及血肿体积[11-12]。本研究结果显示,观察组患者临床疗效优于对照组,治疗后观察组患者NIHSS评分及血清IL-6、CRP、TNF-α水平低于对照组,提示尼莫地平联合神经节苷脂治疗高血压脑出血的临床疗效确切,可有效促进患者神经功能恢复,降低血清炎性因子水平。MPO、LPO、MDA为氧化物及其代谢产物,SOD为抗氧化物,高血压脑出血后MPO、LPO、MDA大量表达,SOD大量消耗,导致机体氧化/抗氧化机制失衡。本研究结果显示,治疗后观察组患者MPO、LPO、MDA低于对照组,SOD高于对照组,提示尼莫地平联合神经节苷脂可有效减轻高血压脑出血患者氧化应激,与既往研究结果一致[13]。本研究结果还显示,两组患者治疗期间不良反应发生率间无差异,提示尼莫地平联合神经节苷脂治疗高血压脑出血的安全性较高。
综上所述,尼莫地平联合神经节苷脂治疗高血压脑出血的临床疗效确切,可有效促进患者神经功能恢复,降低血清炎性因子水平,减轻氧化应激,且安全性较高,值得临床推广应用。
