海藻糖对虾蛄磷酸化肌原纤维蛋白功能特性的影响
2018-10-25任云霞张坤生陈金玉
吴 鹏,任云霞*,张坤生,陈金玉
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
虾蛄(Oratosquilla oratoria)又称皮皮虾,其肉中含有大量水分,味道鲜美,诱人可口[1]。同时虾蛄也是一种营养价值极高的水产品,蛋白质及维生素含量较高,其中蛋白质含量高达20%,营养成分全面,组成合理,有利于人体消化吸收。但虾蛄具有季节性强及不易保鲜的特点,因此,为使营养价值更加全面地被开发和利用,将其制成成品或半成品是一大研究热点[2]。虾蛄肉中的肌原纤维蛋白(myofibril protein,MP)约占总蛋白含量的50%~55%,MP是一种盐溶性结构蛋白群,对于肌肉的嫩度、收缩性有很大影响,同时还会影响肉品的黏着性、保水性及弹性等流变学特性,在生物学上具有很重要的功能特性[3]。因此,通过研究虾蛄肉中的MP可以为虾蛄制品的产业化发展提供理论基础和技术支撑。添加外源辅料可以加强并改善食品中蛋白质的各种功能特性,从而提高食品的营养价值并延长其货架期,促进行业的发展,因此是目前国际上的一大研究热点。杨 明[4]、 王 有 基[5]、 Luo Yongkang[6]、 赵 春 青[7]、Voutsinas[8]、Elizalde[9]等将马铃薯淀粉和转谷氨酰胺酶等其他外源添加物添加到鱼肉和猪肉等MP中,研究结果表明,这些外源添加物均可以提高MP的功能特性。
蛋白质磷酸化是一种最普遍、也是最重要的控制和调节蛋白质功能和活力的修饰手段。田少君[10]、李阳阳[11]等分别采用三氯氧磷和多聚磷酸钠对大豆分离蛋白进行磷酸化,发现磷酸化修饰显著改善了蛋白质的乳化、理化以及凝胶性质。王诗萌等[12]通过向虾蛄磷酸化MP中添加魔芋胶、黄原胶和卡拉胶,得出3 种食用胶均能提高蛋白质的凝胶保水性。
海藻糖是一种由1,1-糖苷键构成的非还原性天然糖类,大量体内含有海藻糖的生物,当其处在高渗透压、过冷、过热或干燥失水等条件下时,海藻糖会在细胞表面形成一种非常独有的保护膜,它能有效保护蛋白质分子结构,使其不变性失活,从而维持生命体的正常代谢过程,因此海藻糖对多种生物活性物质均具有很强的保护作用[13]。自然界中很多物种体内均含有海藻糖,它们通常在较恶劣的环境中都具有很强的抗逆耐受力,这也证明了海藻糖的优良保护特性,它可以作为维持食品风味、防止劣化、提升品质的独特配料,在食品工业中的应用范围很广[14]。
目前,国内外关于MP磷酸化的报道并不多,关于海藻糖这种优良的海鲜低温保护剂对虾蛄磷酸化MP功能特性的影响更是鲜有研究,希望通过本研究可以促进海藻糖在虾蛄中的应用,为有效改善虾蛄制品的生产及延长货架期提供理论支持。本研究探究添加不同质量浓度的海藻糖对虾蛄磷酸化MP表面疏水性、浊度、乳化性质、起泡性和泡沫稳定性、热稳定性以及凝胶特性的影响,以期为虾蛄肉制品的产业化生产提供理论依据和技术支持,促进食品行业的发展。
1 材料与方法
1.1 材料与试剂
虾蛄购于天津市西青区王顶堤水产批发市场,冻藏于-80 ℃超低温冰箱中,使用前在4 ℃条件下解冻。
海藻糖(食品级) 山东优索化工科技有限公司;牛血清蛋白(bovine serum albumin,BSA) 美国Sigma公司;Na2HPO4、NaH2PO4、H3PO4、NaCl(均为分析纯) 天津市赢达稀贵化学试剂厂;MgCl2(分析纯)天津市天大化工实验厂;9 5%乙醇(分析纯)天津市风船化学试剂科技有限公司;三聚磷酸钠(sodium tripolyphosphate,STP)(分析纯) 天津市光复精细化工研究所;CuSO4和酒石酸钾钠(均为分析纯) 天津市科密欧化学试剂开发中心。
1.2 仪器与设备
Hunter Lab色差仪 美国Hunter Lab公司;HW-S24电热恒温水浴锅 上海一恒科学仪器有限公司;H1650-W台式高速离心机 长沙湘仪离心机仪器有限公司;IKA T10高速组织匀浆机 德国IKA公司;FA2004A电子天平 上海精天仪器有限公司;SMSTA TA-XT plus质构仪 英国Stable Micro System公司;Avanti J-E高效离心机 美国Beckman公司;UV-7504紫外-可见分光光度计 上海欣茂仪器有限公司;Model 2920差示扫描量热仪 美国TA公司。
1.3 方法
1.3.1 虾蛄MP的提取
根据Park[15]、王诗萌[16]、袁程程[17]等的方法,先进行原料预处理,将虾蛄从-80 ℃冰箱中取出,放置于4 ℃条件下解冻,然后去掉甲壳和头,得到虾蛄肉;先向其中加入4 倍体积的MP提取液(0.1 mol/L NaCl、0.002 mol/L MgCl2、0.1 mol/L Na2HPO4/NaH2PO4、0.001 mol/L EDTA,pH 7.0),高速匀浆30 s,在5 000 r/min、4 ℃条件下高速冷冻离心15 min;取沉淀,重复加MP提取液离心步骤2 次,然后再加入4 倍体积的0.1 mol/L NaCl溶液,高速匀浆30 s,在同样条件下(5 000 r/min,15 min,4 ℃)高速冷冻离心3 次,弃上清,最终所得沉淀即为MP。
1.3.2 磷酸化MP的制备
参考王诗萌[16]的方法。取一定量MP,向其中加入适量2% STP溶液,分别制备20、40 mg/mL 2 种质量浓度的蛋白溶液;严格控制反应温度在30 ℃,搅拌速率在中档,时间2 h;搅拌完成后静置一段时间,直至pH值稳定后,即可得磷酸化MP。
质量浓度为20 mg/mL的MP溶液用来测定乳化活性和乳化稳定性、浊度、表面疏水性、起泡性和泡沫稳定性以及进行差示扫描量热法(differential scanning calorimetry,DSC)扫描确定蛋白质的热稳定性;质量浓度为40 mg/mL的MP溶液用来测定凝胶特性。
1.3.3 海藻糖的添加
用0.4 mol/L的NaCl溶液将质量浓度为20 mg/mL的磷酸化MP溶液稀释至10 mg/mL,添加海藻糖,使其质量浓度分别为0.0、0.2、0.4、0.6、0.8、1.0 mg/mL,搅拌均匀,使海藻糖充分分散,35 ℃条件下水浴0.5 h,4 ℃保存备用,进行相关指标测定。向质量浓度为40 mg/mL的磷酸化MP溶液中添加海藻糖,使其质量浓度分别为0.0、0.2、0.4、0.6、0.8、1.0 mg/mL,搅拌均匀,在80 ℃条件下水浴0.5 h,快速冷却,4 ℃保存备用。实验前需将所制备的凝胶样品取出,放置于室温中30 min,再测定相关指标。
1.3.4 指标测定
1.3.4.1 蛋白质含量
参照曹云刚[18]、周非白[19]、李明清[20]等的方法,采用双缩脲法测定从虾蛄中提取出的MP含量。
双缩脲试剂的配制:称取酒石酸钾钠6 g和硫酸铜1.5 g,溶解于500 mL水中;边搅拌边加入300 mL质量分数为10%的NaOH溶液,然后用蒸馏水将溶液稀释到1 000 mL,保存备用。
标准曲线的绘制:配制质量浓度为10 mg/mL的BSA溶液,分别吸取0.0、0.2、0.4、0.6、0.8、1.0 mL于试管中,加蒸馏水补足到1 mL,然后添加双缩脲试剂4 mL,振荡均匀后,放置30 min,在540 nm波长处测定吸光度。以BSA的质量浓度为纵坐标,吸光度为横坐标,绘制标准曲线。
样品蛋白质含量测定:用0.5 mol/L NaOH溶液将待测样品稀释5 倍,向试管中加入1 mL稀释样品溶液,再向其中加入4 mL双缩脲试剂,经上述同样条件处理后比色,再将样品溶液的吸光度代入标准曲线,可求出样品的蛋白质含量。
1.3.4.2 磷酸化程度
参考周景丽[21]、彭倩[22]等的方法。将MP溶液在4 ℃条件下透析24 h后,采用钼蓝比色法测定蛋白磷酸化程度。
1.3.4.3 乳化活性和乳化稳定性
参考Agyare等[23]的方法。向50 mL烧杯中加入16 mL稀释的MP溶液及4 mL大豆油,使用均质机高速匀浆2 min;均质后在0 min与10 min时分别从底部吸取100 μL混合液,加入到含有10 mL 0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液的烧杯中,振荡混匀;以0.1% SDS溶液为空白对照,在500 nm波长处测定吸光度。样品的乳化活性(用乳化活性指数(emulsifying activity index,EAI)表示)和乳化稳定性(用乳化稳定性指数(emulsifying stability index,ESI)表示)按照公式(1)~(2)计算。

式中:ρ为溶液的蛋白质质量浓度/(g/mL);A0为0 min时乳状液的吸光度;A10为10 min时乳状液的吸光度;φ为油相体积分数(φ=0.2);n为稀释倍数。
1.3.4.4 表面疏水性
参照Chelh[24]、吴菊清[25]等的方法。取稀释的MP溶液2 mL并向其中加入400 μL质量浓度1 mg/mL的溴酚蓝溶液,混合均匀;离心(4 000 r/min,20 min),取上清液,并将其稀释10 倍,以对应的磷酸缓冲液为空白对照,在595 nm波长处测定吸光度。表面疏水基含量按照公式(3)计算。

式中:A对照为对照组的吸光度;A样品为处理组的吸光度。
1.3.4.5 浊度
参照Benjakul等[26]的方法。向试管中加入5 mL稀释的MP溶液,将其放置于60 ℃的水浴锅中水浴30 min,取出后冷却,再将溶液稀释5 倍,在600 nm波长处测定吸光度(以不加MP的NaCl溶液为空白对照)。
1.3.4.6 起泡性和泡沫稳定性
参照李明清[20]的方法。取30 mL磷酸化MP溶液(V0)于100 mL量筒中,高速匀浆60 s,快速读取泡沫的总体积(V1);之后将泡沫在室温下静置,分别读取10、20、30 min时的泡沫总体积(Vt)。起泡性(foaming characteristics,FC)和泡沫稳定性(foam stability,FS)按照公式(4)~(5)计算。

1.3.4.7 凝胶保水性
参照Foegeding[27]的方法。取适量所制备的凝胶在4 ℃、80 000 r/min条件下离心10 min,按照公式(6)计算MP凝胶的保水性。
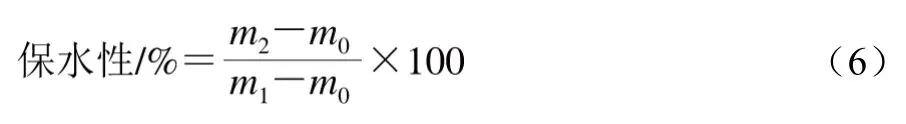
式中:m0为离心管质量/g;m1为离心前蛋白凝胶与离心管总质量/g;m2为离心后去掉上清液后蛋白凝胶与离心管总质量/g。
1.3.4.8 凝胶硬度
蛋白凝胶的硬度采用TA-XT plus型质构分析仪来测定。参数设置为:探头:P/0.5;测前速率2.0 mm/s,测后速率1.0 mm/s,测试速率1.0 mm/s;触发力5.0 g;触发类型:自动。每个样品做3 组平行。
1.3.4.9 凝胶弹性
参数设置为:探头型号:P/0.5;测前速率2.0 mm/s,测后速率1.0 mm/s,测试速率1.0 mm/s;触发力5.0 g;压缩比50%。每个样品做3 组平行。
1.3.4.10 凝胶白度值
参照袁程程等[17]的方法。采用全自动便携式色差计测定蛋白的凝胶白度,记录亮度值(L*)、红度值(a*)和黄度值(b*)。按照公式(7)计算凝胶白度值。每个样品做3 组平行。

1.3.4.11 DSC扫描
通过Model 2920差示扫描量热仪分析经不同处理导致的MP热稳定性差异。称取10 mg/mL稀释样品16~18 mg,记录其准确数值后,密封于铝坩埚中,以空盒为空白,以10 ℃/min的升温速率加热,记录30~75 ℃的DSC曲线[28]。加热过程中MP的最大转变温度(Tmax)通过TA公司提供的Universal Analysis 软件(版本1.2 N)进行分析。
1.4 数据处理
采用SPSS 18.0软件对数据进行显著性分析,并采用Origin pro 8.0软件和Excel 2010软件处理数据并作图。
2 结果与分析
2.1 标准曲线的绘制
蛋白质含量计算标准曲线方程为y=0.046 6x+0.011 8(R2=0.999 3),磷酸化程度计算标准曲线方程为y=8.361 0x+0.014 4(R2=0.999 8)。
2.2 不同海藻糖添加量对磷酸化MP乳化活性和乳化稳定性的影响
由图1可知:当海藻糖的添加量不断增加时,磷酸化MP的乳化活性呈现先增加后逐渐降低的趋势,当海藻糖的添加量为0.4 mg/mL时,磷酸化MP的EAI达到最大,为28.92 m2/g;当海藻糖的添加量不断增加时,乳化稳定性则呈现逐渐增加的现象。这可能是由于当海藻糖溶于MP溶液后,通过与溶液中体系充分结合,会在蛋白质表面形成一种极为独特的保护膜,能有效保护蛋白质分子结构,使其不变性失活,同时在均质后体系中距离较大的乳化微粒之间也可以起到某种乳化剂的作用,从而促进蛋白质的乳化活性及稳定性[29]。当海藻糖达到一定添加量时,由于其易于结晶,且结晶性能良好,使乳化膜的厚度逐渐增大并最终扩展至整个溶液,溶液中的海藻糖结晶会使乳化微粒之间的距离变得越来越小,降低乳化活性,而乳化稳定性则继续增大[14]。

图 1 海藻糖对虾蛄磷酸化MP乳化活性和乳化稳定性的影响Fig. 1 Effect of trehalose on emulsifying activity and emulsion stability of phosphorylated MP
2.3 不同海藻糖添加量对磷酸化MP表面疏水性的影响
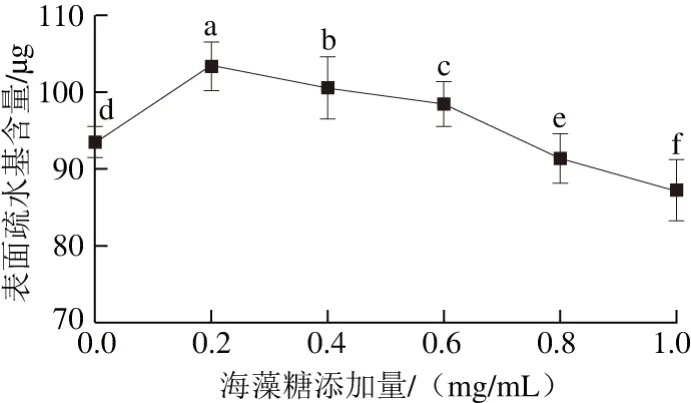
图 2 海藻糖对虾蛄磷酸化MP表面疏水性的影响Fig. 2 Effect of trehalose on surface hydrophobicity of phosphorylated MP
由图2可知,虾蛄磷酸化MP的表面疏水性随着海藻糖添加量的增加呈现先增加后降低的趋势,当海藻糖添加量为0.2 mg/mL时,表面疏水基含量最高,为103.34 μg。通过表面疏水性来评价MP的功能特性是目前非常普遍的一种途径,具有重要的参考意义。虾蛄磷酸化MP螯合溴酚蓝的量越大,则表明其对应的表面疏水性越高,这是由于溶液中蛋白质的空间结构受MP分子间的相互作用以及蛋白质分子与水分子之间相互作用的直接影响,可能会导致磷酸化MP的功能性质变得不稳定。蛋白质的表面疏水性也可以同时反映其分子内部疏水基团的暴露程度,MP的表面疏水性越大,则表示蛋白质分子内部疏水基团暴露的越多。磷酸化MP在溶解的过程中也可能会由于分子间的聚合而发生不可逆变性,当海藻糖添加量较低时,磷酸化MP在加热条件下与海藻糖作用发生变性,在蛋白质分子外部暴露大量表面疏水性基团,大量的溴酚蓝聚合在一起,随着海藻糖添加量的逐渐增大,磷酸化MP的变性程度相对逐渐降低,表面疏水性下降[24]。
2.4 不同海藻糖添加量对磷酸化MP浊度的影响
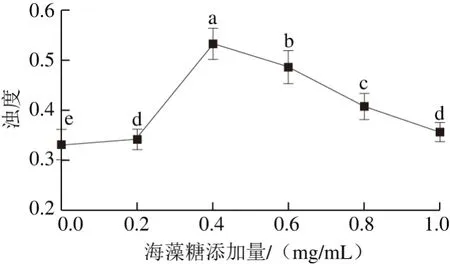
图 3 海藻糖对虾蛄磷酸化MP浊度的影响Fig. 3 Effect of trehalose on turbidity of phosphorylated MP
浊度表示溶液中悬浮粒子的大小和数量,可以较为准确地反映蛋白质的聚集状态。由图3可知,当海藻糖的添加量不断增加时,虾蛄磷酸化MP的浊度先增加,然后逐渐降低,当海藻糖添加量为0.4 mg/mL时,MP的浊度达到最大,继续增大海藻糖的添加量,浊度会逐渐下降。这可能是由于海藻糖具有较强的结晶性,当加入蛋白溶液时会产生一定量的结晶,同时阻止蛋白溶液之间的相互交联,影响蛋白质的溶解性,导致蛋白质的吸光度逐渐增大[14]。当海藻糖的添加量逐渐增大时,其结构中的羟基可能与蛋白质结构中的极性残基形成氢键,促进蛋白质的溶解性,吸光度逐渐降低。
2.5 不同海藻糖添加量对磷酸化MP起泡性和泡沫稳定性的影响
蛋白质的起泡性与蛋白质分子表面的极性和分子大小相关,是蛋白质重要的功能特性之一,常用FC和FS来表示,它还与糖类的种类、盐的种类和蛋白质的性质有关。
由图4~5可知,随着海藻糖添加量的增加,MP的FC和FS均呈现先增加后降低的趋势。当海藻糖的添加量为0.4 mg/mL时,FC达到最大,为71.67%;继续增大海藻糖添加量,FC和FS均呈下降趋势。这可能是由于刚开始添加海藻糖时,糖类会与蛋白质发生特殊作用,形成特殊的稳定复合体,这种复合体可以提高蛋白质的起泡性和泡沫稳定性[20]。同时随着海藻糖添加量的增加,溶液的黏度也会增大,也增大了蛋白质的起泡性。当海藻糖添加量增大到一定值时,由于其晶体析出性,会阻碍MP的起泡性和泡沫稳定性,导致蛋白质的起泡性和泡沫稳定性逐渐降低[14]。

图 4 海藻糖对MP起泡性的影响Fig. 4 Effect of trehalose on foaming capacity of MP

图 5 海藻糖对MP泡沫稳定性的影响Fig. 5 Effect of trehalose on foam stability of MP
2.6 不同海藻糖添加量对磷酸化MP凝胶保水性的影响
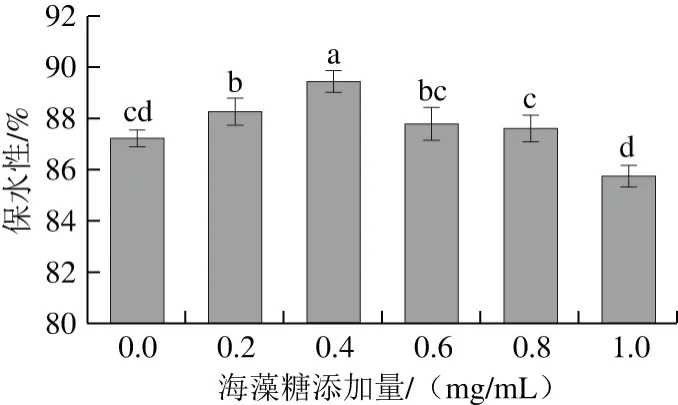
图 6 海藻糖对虾蛄磷酸化MP凝胶保水性的影响Fig. 6 Effect of trehalose on water-holding capacity of phosphorylated MP gels
由图6可知,磷酸化MP的凝胶保水性随着海藻糖添加量的增大呈现先增加后降低的趋势。当海藻糖添加量在0~0.4 mg/mL范围内时,随着海藻糖添加量的增大,凝胶保水性逐渐增加,并在添加量为0.4 mg/mL时达到最高,为89.46%;继续增加海藻糖添加量,MP的凝胶保水性开始呈现逐渐降低的趋势。这可能是由于海藻糖作为一种非还原性天然糖类,其结构为2 个葡萄糖分子通过1,1-糖苷键所连接,对很多生命体,尤其是海鲜具有很强的保护作用,会使凝胶网络更好,孔隙更多,孔隙直径更小,保水性也越来越好。因此,刚开始添加海藻糖时会提高磷酸化MP的凝胶保水性,当其添加量达到一定值时,海藻糖结构中的羟基可能会与MP结构中的极性残基形成氢键,蛋白凝胶特性受氢键的影响非常大,可能会增强MP凝胶的硬度和破裂强度,但降低内聚性,导致蛋白凝胶变得更加疏松,凝胶保水性逐渐降低[14,30]。
2.7 不同海藻糖添加量对磷酸化MP凝胶硬度和弹性的影响

图 7 海藻糖对虾蛄磷酸化MP凝胶硬度和弹性的影响Fig. 7 Effect of trehalose on hardness and springiness of phosphorylated MP gels
蛋白凝胶的硬度和弹性是衡量肌肉蛋白质凝结状况的重要参数。由图7可知,随着海藻糖添加量的不断增大,磷酸化MP凝胶的硬度先增加后逐渐降低,而弹性呈现逐渐增大的趋势。当海藻糖添加量在0~0.4 mg/mL之间时,磷酸化MP凝胶的硬度随着海藻糖添加量的增大而逐渐增加,并在添加量为0.4%时达到最大,为77.74 g,随后呈现逐渐下降的趋势;而磷酸化MP凝胶的弹性则随着海藻糖添加量的增大而持续增加。这可能是由于海藻糖对于生命体,尤其是海产品具有非常强的保护作用,因此可以作为一种有效的低温保护剂应用于海产品的研发、生产和运输中,当其添加量在一定范围内时,在蛋白质、水界面绝对抑制水的官能度时会持续增加MP的弹性、硬度和凝胶力[29]。同时,海藻糖结构中的羟基可能会与MP结构中的极性残基形成氢键。蛋白质的凝胶特性受多种作用力的影响,其中氢键是主要作用力,它会使凝胶的硬度和破裂强度增大。继续增加海藻糖的添加量,由于其具有较强的晶体析出性,会阻碍MP产生交联,使之不能充分聚合形成三维蛋白网络结构,影响凝胶形成,降低凝胶的硬度。
2.8 不同海藻糖添加量对磷酸化MP凝胶白度的影响

图 8 海藻糖对虾蛄磷酸化MP凝胶白度的影响Fig. 8 Effect of trehalose on whiteness of phosphorylated MP gels
由图8可知,虾蛄磷酸化MP凝胶的白度随着海藻糖添加量的增加呈现先增加后降低的趋势。当海藻糖添加量为0.4 mg/mL时,MP凝胶的白度值达到最大,为46.85,随后白度值开始逐渐下降。总体上,与对照组相比,添加海藻糖之后凝胶的白度上升。这可能是由于海藻糖呈白色粉末状态,且性质特别稳定,不会引起美拉德反应,当海藻糖的添加量达到一定值时,其结构中的羟基可能会与MP结构中的极性残基形成氢键,导致凝胶保水性降低,白度值随之降低[31]。
2.9 磷酸化MP的DSC扫描结果

图 9 添加海藻糖后的磷酸化MP的DSC扫描曲线Fig. 9 DSC of phosphorylated MP with added trehalose
DSC是评价蛋白质结构变化的重要途径,图9为磷酸化MP在30~75 ℃的DSC扫描曲线图。在37 ℃和73 ℃左右,每条曲线均分别出现2 个较为明显的峰,这表明虾蛄磷酸化MP在这2 个温度点发生了明显变性。DSC扫描曲线中的峰向上表示吸热,向下表示放热。根据任丽娜[32]的研究可知,DSC扫描图中从左至右的第1个峰和第2个峰与MP中肌球蛋白的变性相关,其分别代表肌球蛋白的球状头部和杆状尾部。随着海藻糖添加量的增加,每条DSC曲线上第1个热吸收峰所对应的温度点逐渐右移,从海藻糖添加量为0 mg/mL时的35.14 ℃右移至1.0 mg/mL时的36.48 ℃,其变性温度越来越高,说明海藻糖的添加促进了磷酸化MP结构的稳定。添加海藻糖后,肌球蛋白尾部的热吸收峰先变大后逐渐减小,而肌球蛋白头部的热吸收峰变化却不明显。当海藻糖添加量为0 mg/mL时,没有明显的肌球蛋白尾部热吸收峰,但当海藻糖添加量在0.2~0.6 mg/mL之间时,肌球蛋白尾部的热吸收峰均较为明显,说明添加适量的海藻糖对磷酸化MP结构的稳定有非常大的促进作用[18-19,28,32]。
3 结 论
当海藻糖的添加量为0.4 mg/mL时,虾蛄磷酸化MP的乳化活性达到最大,乳化稳定性则随着海藻糖添加量的增加而逐渐增大,并在1.0 mg/mL时达到最大。虾蛄磷酸化MP的表面疏水性随着海藻糖添加量的增加呈现先增加后降低的趋势,并在0.2 mg/mL时达到最大。当海藻糖的添加量逐渐增大时,虾蛄磷酸化MP的浊度先增加后逐渐降低,在0.4 mg/mL时达到最大。MP的FC和FS随着海藻糖添加量的增加均呈现先增加后降低的趋势。当海藻糖的添加量为0.4 mg/mL时,FC达到最大,继续增大海藻糖添加量,FC和FS均呈下降趋势。随着海藻糖添加量的增大,磷酸化MP凝胶的保水性呈现先增加后降低的趋势,并在添加量为0.4 mg/mL时达到最高;凝胶硬度则呈现先增加后降低的趋势,弹性逐渐增加;凝胶白度呈先增加后降低的趋势。DSC曲线反映出添加适量的海藻糖有利于MP结构的稳定,使蛋白质的变性温度逐渐上升。因此,添加适量的海藻糖可以显著改善虾蛄磷酸化MP的结构,促进虾蛄制品的产业化发展。
