直肠癌患者手术前后血清基质金属蛋白酶9、瘦素及基质金属蛋白酶抑制剂1的变化
2018-10-24张丽丽杨建波罗玉君
张丽丽,马 欢,杨建波,罗玉君
直肠癌为消化系统常见恶性肿瘤,近年来发病率呈逐年上升趋势[1]。而其发病及进展为多阶段、多基因参与的渐进性累积发病的复杂过程,多种肿瘤生物标志物均参与直肠癌病变过程[2]。基质金属蛋白酶(matrix metalloproteinase9,MMP)9为具降解细胞外基质能力的重要因子,早期被证实参与胃癌侵袭转移过程,同时对肿瘤微环境的维持及肿瘤生长、增殖有促进作用[3]。基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP)1则为拮抗MMP活性的主要因子,对细胞增殖、分化、凋亡及血管分化均有一定的调节作用[4]。瘦素(leptin)则为肥胖基因表达产物,主要通过与靶器官leptin受体结合发挥作用,可调节代谢、激素分泌,抑制摄食,强化能量支出等功能。近年来直肠癌发病与能量消耗及饮食的关系日益引起研究者的重视[5]。但目前对leptin与直肠癌手术病理参数的关系尚少见报道。基于此,为探讨直肠癌手术治疗前后血清MMP9、leptin、TIMP1的变化及其与肿瘤局部复发、预后的关系,对直肠癌患者的临床资料进行回顾性分析,报道如下。
1 资料与方法
1.1 临床资料 收集2012年1月—2014年12月于绵阳市中心医院接受手术治疗的150例直肠癌患者的临床资料。纳入标准:经病理证实为直肠癌;术前均未接受放化疗;行根治性手术治疗;术后完成3年随访调查;临床及随访资料完整。排除标准:心肝肾肺器质性功能障碍者;脑血管疾病者;肠外肿瘤者;自身免疫功能缺陷者;血液系统疾病者;精神障碍者;妊娠或哺乳期女性;预计生存期<3个月者;临床及随访资料不完整者。其中,男86例,女64例;年龄36~78(58.9±10.2)岁。 Dukes分期:A期36例,B期42例,C期60例,D期12例。分化程度:低分化73例,高中分化77例。
1.2 试剂与仪器 人TIMP1酶联免疫试剂盒(武汉博士德生物工程有限公司);人MMP9酶联免疫试剂盒(北京中杉金桥生物工程公司);人leptin定量酶联免疫试剂盒(上海森雄科技实业有限公司);Bio-Rad680型全自动酶标仪(美国Bio-Rad公司)。
1.3 方法 所有患者均接受根治性手术治疗,术前、术后10 d均采集外周静脉血4 mL,3 000 rpm,-20℃离心后分离血清,采用酶联免疫双抗体夹心法测定MMP9、leptin、TIMP1水平,均严格参照试剂使用说明进行操作。收集所有患者临床资料及随访资料,包括性别、年龄、肿瘤直径、临床分期、病理类型、肿瘤分化程度、淋巴结转移及随访局部复发、转移及预后情况等,分析MMP9、leptin、TIMP1与患者临床病理参数及局部复发、预后的关系。
1.4 统计学处理 应用SPSS 19.0软件,计数资料采用率表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,均行正态性和方差齐性检验,不符合正态分布变量进行自然对数转化呈正态或近似正态分布,组间比较采用t检验;各因素相关性分析采用Spearman相关分析;以P<0.05为差异具有统计学意义。
2 结果
2.1 手术治疗前后血清MMP9、leptin、TIMP1水平术后10 d,所有直肠癌患者MMP9、leptin、TIMP1水平均降低,与术前比较差异有统计学意义(P<0.05),见表 1。
表1 直肠癌患者手术前后血清MMP9、leptin、TIMP1水平(±s)
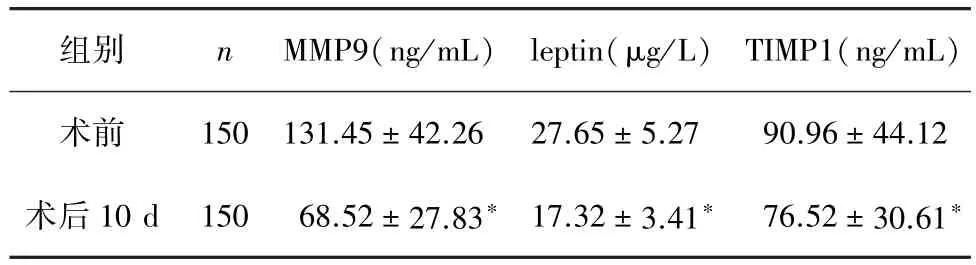
表1 直肠癌患者手术前后血清MMP9、leptin、TIMP1水平(±s)
注:与术前比较,∗P<0.05
组别 n MMP9(ng/mL) leptin(μg/L) TIMP1(ng/mL)术前 150 131.45±42.26 27.65±5.27 90.96±44.12术后10 d 150 68.52±27.83∗ 17.32±3.41∗ 76.52±30.61∗
2.2 血清MMP9、leptin、TIMP1水平与临床病理及随访预后的关系 Dukes分期为C期+D期、肿瘤侵犯浆膜层、合并淋巴结转移、术后未接受辅助治疗、术后复发/转移及术后3年死亡患者MMP9、leptin、TIMP1水平高于Dukes分期为A期+B期、肿瘤未侵犯浆膜层、无淋巴结转移、术后接受辅助治疗、术后未复发/转移及术后3年生存患者(P<0.05),见表2。
2.3 MMP9、leptin、TIMP1表达相互关系及与病理、预后参数的关系 相关性分析结果分析:MMP9、leptin、TIMP1 3者表达均互呈正相关,且3者与直肠癌Dukes分期、肿瘤浸润深度、淋巴结转移、术后复发/转移呈正相关(P<0.05),与术后辅助治疗及患者术后3年生存率呈负相关(P<0.05),见表3。
表2 直肠癌患者血清MMP9、leptin、TIMP1水平与临床病理及随访预后的关系(±s)
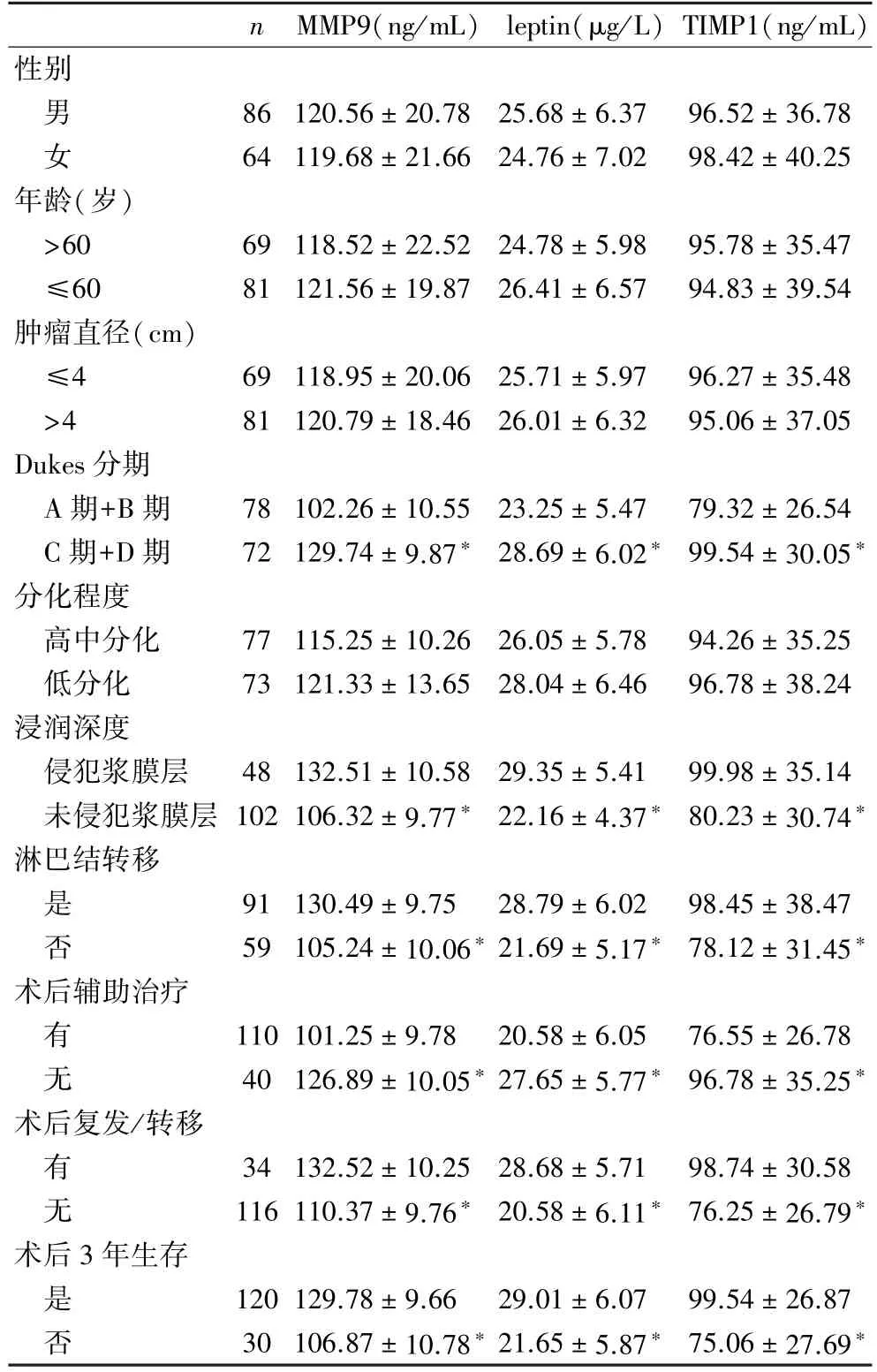
表2 直肠癌患者血清MMP9、leptin、TIMP1水平与临床病理及随访预后的关系(±s)
注:组间比较,∗P<0.05
n MMP9(ng/mL) leptin(μg/L)TIMP1(ng/mL)性别86 120.56±20.78 25.68±6.37 96.52±36.78女64 119.68±21.66 24.76±7.02 98.42±40.25年龄(岁)>60 69 118.52±22.52 24.78±5.98 95.78±35.47≤60 81 121.56±19.87 26.41±6.57 94.83±39.54肿瘤直径(cm)≤4 69 118.95±20.06 25.71±5.97 96.27±35.48>4 81 120.79±18.46 26.01±6.32 95.06±37.05 Dukes分期A期+B期 78 102.26±10.55 23.25±5.47 79.32±26.54 C期+D期 72 129.74±9.87∗ 28.69±6.02∗ 99.54±30.05∗分化程度高中分化 77 115.25±10.26 26.05±5.78 94.26±35.25低分化 73 121.33±13.65 28.04±6.46 96.78±38.24浸润深度侵犯浆膜层 48 132.51±10.58 29.35±5.41 99.98±35.14未侵犯浆膜层 102 106.32±9.77∗ 22.16±4.37∗ 80.23±30.74∗淋巴结转移是91 130.49±9.75 28.79±6.02 98.45±38.47否59 105.24±10.06∗ 21.69±5.17∗ 78.12±31.45∗术后辅助治疗有110 101.25±9.78 20.58±6.05 76.55±26.78无40 126.89±10.05∗ 27.65±5.77∗ 96.78±35.25∗术后复发/转移有34 132.52±10.25 28.68±5.71 98.74±30.58无116 110.37±9.76∗ 20.58±6.11∗ 76.25±26.79∗术后3年生存是120 129.78±9.66 29.01±6.07 99.54±26.87否30 106.87±10.78∗ 21.65±5.87∗ 75.06±27.69∗男
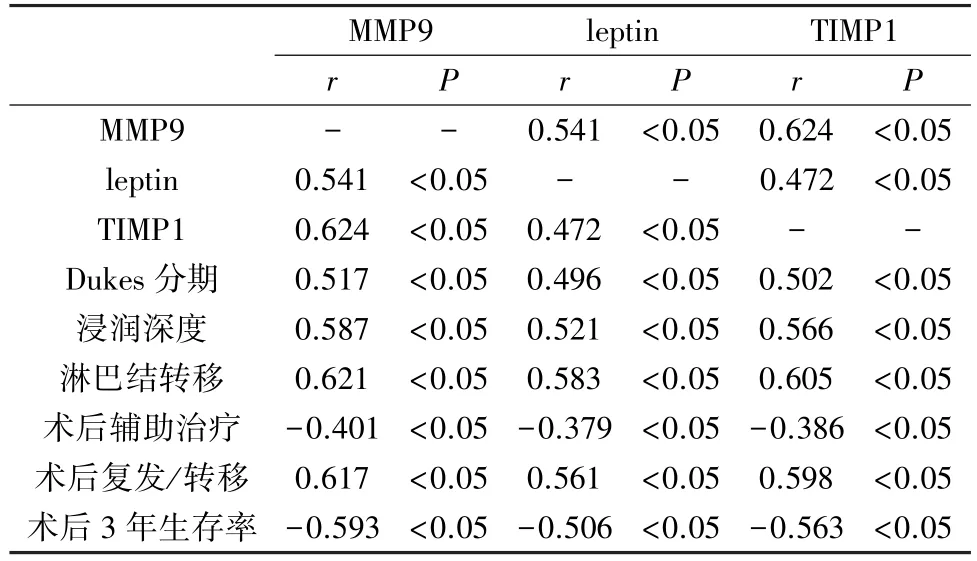
表3 直肠癌 MMP9、leptin、TIMP1表达相互关系及与病理、预后参数的关系
3 讨论
早期对直肠癌的诊断及病情评估多依赖于肿瘤相关标志物,癌胚抗原(carcinoembryonic antigens,CEA)是目前公认与直肠癌相关较高的肿瘤标志物,但血清CEA对早期直肠癌诊断敏感度较低[6]。近年来细胞外基质(extracellular matrix,ECM)在肿瘤局部侵袭及远处转移中的作用日益引起研究者的重视[7-8]。ECM为动态纤维蛋白网,对组织有重要的支撑及屏障作用,其各类受体均可与细胞进行密切接触,以细胞内传导途径促进细胞分化及增殖,促进肿瘤侵袭及转移。MMPs则为锌原子依赖性内肽酶,可降解ECM;MMPs组织抑制剂TIMPs为内源性MMPs抑制剂,研究发现,在胃癌、食管癌等恶性肿瘤中均可见 TIMPs及 MMPs高表达[9-10]。TIMP1为TIMPs家族成员,属可溶性糖蛋白,广泛存在于组织细胞及体液,可与螯合锌原子作用抑制MMPs水解,可与MMP非共价键结合形成复合物,抑制MMP活性。吴肖等[11]发现,TIMP1不仅可抑制MMP活性,同时具备肿瘤刺激作用,在癌细胞增殖、肿瘤血管生成中有重要作用。Spindler等[12]指出,TIMP1与结直肠恶性肿瘤发病存在密切关联,恶变结直肠组织间质可见TIMP1表达明显上升。本研究发现,直肠癌患者血清TIMP1呈高表达,高于王欣等[13]报道的健康人血清TIMP1水平,术后TIMP1降低,提示TIMP1参与直肠癌发病过程,与手术疗效存在一定的关联。同时进行相关性分析发现,TIMP1与直肠癌分期、浸润深度、淋巴结转移、术后辅助治疗、术后复发/转移及生存率均有明显相关性,分析可能原因为:直肠癌患者血清TIMP1水平上调,与机体肿瘤异常增生有关,其可独立刺激肿瘤细胞生长,并通过FAK/Bad-bclX2等途径抑制癌细胞凋亡,促进其增殖及生长,MMPs产生蛋白水解作用可抑制细胞凋亡及肿瘤新生血管形成,而TIMP对MMPs产生特异性抑制作用可促进肿瘤侵袭转移,证实TIMP1可能与直肠癌恶性生物学行为有关,为导致患者不良预后的关键指标。
MMP9为降解ECM的关键蛋白酶,病理条件下,MMP9可通过降解基底膜及包绕癌细胞基质,透过肿瘤基质屏障,导致肿瘤增殖及侵袭、转移。同时可通过毛细血管增生,促进肿瘤增殖及扩散,在消化系统恶性肿瘤发生及进展过程中有重要作用。Zhao等[14]发现,MMP9可直接促进结直肠癌癌细胞基底膜上移行。本研究发现,直肠癌患者血清MMP9浓度水平较高,术后有明显降低,提示MMP9水平的变化可用于评估手术疗效。同时本研究还发现,MMP9与直肠癌患者Dukes分期、浸润深度、淋巴结转移、术后辅助治疗及预后均存在不同程度的相关性,表明直肠癌血清MMP9高表达与肿瘤侵袭性存在明显关联,MMP9表达水平越高,肿瘤恶性行为及浸润转移潜能越高。Leptin为蛋白质激素,可促进多种细胞增殖及分化。早期认为,结肠组织无leptin表达[15]。近期研究发现,人手术切除结直肠癌标本及转移癌癌组织均可检出leptin mRNA表达[16],表明肿瘤局部leptin高表达可能为典型病理状态。本研究采用酶联免疫法对150例直肠癌患者血清leptin检测发现,直肠癌患者leptin呈明显过度表达,与肿瘤恶性生物学行为存在紧密联系。
陈燕和陈明卫[17]研究发现leptin可通过诱导MMP9表达、强化酶解作用、消化蜕膜基底及基底膜,促进滋养细胞侵袭。本研究发现,leptin与MMP9、TIMP1表达均呈正相关,提示 leptin对 MMP9及TIMP1均存在负向调控作用,考虑leptin对直肠癌恶性生物学行为的影响主要通过调控MMP9及TIMP1表达而发挥作用。
综上所述,直肠癌患者血清 MMP9、leptin及TIMP1均呈过度表达,与手术治疗、肿瘤Dukes分期、浸润深度、淋巴结转移、术后辅助治疗及预后存在密切关联,可作为评估直肠癌患者手术效果及预测其预后的依据。
