癌症免疫治疗的利器
——2018年诺贝尔生理学或医学奖简介
2018-10-23温铭杰于明航
温铭杰 于明航 王 玺
(首都医科大学基础医学院免疫学系,北京 100069)
免疫学是生物医学领域中基础性、前沿性的学科,而免疫学研究在医学领域中的特殊地位使其倍受诺贝尔奖的青睐。在20世纪,诺贝尔生理学或医学奖授予免疫学领域多达18次,并且首届诺贝尔奖(1901年)就授予免疫学领域——褒奖免疫学家开创免疫血清疗法,应用抗毒素成功治愈白喉患儿。由于分子生物学的发展,20世纪70年代后,免疫学更是蓬勃发展,几乎每10年就有3次获奖。巧合的是,2018年度诺贝尔生理学或医学奖再次授予的免疫学领域仍是抗体的临床应用——而此次是在肿瘤免疫治疗方面。其中詹姆斯·艾利森教授率先提出了免疫检查点(immune checkpoint)的概念,并且最早在小鼠实验中证明T细胞表面细胞毒T淋巴细胞抗原-4(cytotoxic T lymphocyte antigen-4,CTLA-4)抗体可以解除免疫抑制从而控制肿瘤的发展;另一位平分诺贝尔奖的日本免疫学家本庶佑教授则首次发现了PD-1基因,并且致力于PD-1抗体的研发和临床应用;两位免疫学家通过阻断免疫细胞表面的抑制分子以解除免疫系统的抑制,从而更有效的对抗肿瘤。詹姆斯·艾利森和本庶佑两位科学家的贡献为人类健康及癌症治疗开辟了一个崭新领域,针对PD-1和CTLA-4等免疫抑制分子的免疫检查点疗法可认为是肿瘤免疫治疗的里程碑事件。
1 获奖者简介
1.1 James P. Allison
James P. Allison(图1),1948年8月7日出生于美国德克萨斯州,免疫学家,美国科学院院士。1973年获得德克萨斯大学奥斯汀分校博士学位; 1977年成为德克萨斯大学系统癌症中心的教员;2012年为德克萨斯大学安德森癌症中心免疫学系教授兼主任。1995年发现CTLA-4可负性调节免疫功能,并在动物模型上证明CTLA-4抗体可激活T细胞抑制肿瘤的生长。因在癌症免疫治疗等领域的开创性发现,2008年获得美国免疫学家协会(American Association of Immunologist, AAI)斯坦曼奖;2011年获得美国免疫学家终身成就奖;2014年获得生命科学突破奖、首届唐奖“生技医药奖”;2015年获得“拉斯克临床医学奖”;2016年获得首届“复旦-中植科学奖”;2017年获得沃伦阿尔珀特基金会奖。
1.2 Tasuku Honjo
Tasuku Honjo(图2),1942年1月27日出生于日本京都,免疫学家,美国科学院外籍院士,德国自然科学家学会会员,日本学士院会员。1966年在京都大学医学院获得医学博士学位,1975年获得医学化学博士学位。1974年任东京大学的教员,现为京都大学高等研究院杰出教授;1988年以来一直是AAI荣誉会员。1992年首次报道程序性死亡(蛋白)-1(programmed death-1,PD-1),并发现PD-1在免疫应答中发挥负性调节作用。因在免疫领域的多项开创性工作,2012年获得罗伯特·科赫奖,2014年获得首届唐奖生技医药奖;2014年获得国际免疫学威廉·科利奖;2016年获得首届“复旦-中植科学奖”;2017年获得沃伦阿尔珀特基金会奖。

图2 Tasuku Honjo[2]
2 主要科学贡献[1]
免疫系统是机体执行免疫应答及免疫功能的重要系统,可防止细菌、病毒等病原体入侵及体内肿瘤形成。癌症是由DNA损伤等多种因素导致正常细胞突变为癌细胞,进而不正常分裂增生、转移而造成的[2]。20世纪,癌症治疗主要采用手术切除、化学药物治疗和放射治疗等手段[3],但仍不能有效治愈癌症。近几十年的研究显示,肿瘤免疫逃逸是治疗失败的重要原因。因此世界各国的免疫学家和临床工作者积极探索治疗癌症的免疫疗法,其设计思想主要是通过增强人体自身免疫系统,继而清除体内的肿瘤细胞。目前,癌症免疫疗法主要包括过继细胞疗法,免疫检查点阻断剂,非特异性免疫激活剂与癌症疫苗等四大类。本届荣获诺贝尔生理学或医学奖的就是免疫检查点阻断剂疗法。
2.1 免疫检查点CTLA-4和PD-1的发现及其在肿瘤免疫中的重要作用
20世纪中期,科学家发现机体免疫系统可抑制肿瘤增生,但在绝大多数情况下无法完全扼制肿瘤生长,即发生了“肿瘤免疫逃逸”,从而使得肿瘤能够进一步发展、转移[4-7],但肿瘤免疫逃逸的分子机制尚不清楚。
20 世纪 80 年代后期James P. Allison博士在总结前人研究的基础上,发现CTLA-4 可能作为T 细胞应答的抑制分子调控 T 细胞的活化反应,与此同时,Jeffrey A. Bluestone 与Craig B. Thompson团队也认识到T细胞免疫检查点的存在。1995年,华裔科学家Tak Wah Mak和美国免疫学家Arlene H. Sharpe分别在小鼠中敲除CTLA-4基因[8],发现小鼠出生几周后,就因T细胞在多个器官广泛浸润活化而产生的“免疫风暴”而死亡,从而更加证实了Jeffrey A. Bluestone通和James P. Allison的发现[9]。于是,James P. Allison教授和其博士后Dana Leach设计并制备抗CTLA-4分子的单克隆抗体,将其注入荷瘤小鼠体内,观察“关闭”T细胞抑制分子CTLA-4的免疫抑制功能后小鼠体内肿瘤的变化[10-11]。小鼠体内的免疫细胞开始攻击肿瘤,使得肿瘤体积变小,结果显示,小鼠生存期延长。因此,1996 年,James P. Allison首次证明抗体阻断T 细胞抑制分子(CTLA-4)可增强抗肿瘤免疫反应并清除肿瘤(图3)。

图3 CTLA-4单克隆抗体的抑瘤效应[1]
James P. Allison及其合作者发现:抗CTLA-4单克隆抗体应用荷瘤小鼠后能够阻断CTLA-4的抑制效应(解除刹车),控制肿瘤生长。
与此同时,日本免疫学家Tasuku Honjo教授研究组在1992年首次发现免疫细胞表面的一种特殊蛋白质(PD-1蛋白)[12],为了研究PD-1 的功能,Tasuku Honjo实验室将小鼠PD-1 基因敲除,并观察敲除小鼠。研究团队发现缺乏 PD-1 的小鼠可发生多种自身免疫病,因为小鼠体内的免疫反应过强,而攻击自身正常组织[13-14]。因此,Tasuku Honjo认为PD-1 可能是免疫系统的刹车器,进一步研究发现抑制 PD-1后能够活化 T 细胞,继而增强机体免疫功能,从而达到治疗癌症的目的。与此相辅相成的是在1992年,美国著名华人免疫科学家陈列平在Cell杂志上首次提出以PD-1配体(B7-H1)为靶点的免疫治疗设想,开创了肿瘤免疫治疗的全新理念,并且陈列平教授的发现是人类首次在动物实验中观察到,恶性肿瘤可以用免疫疗法彻底治愈[15]。在此基础上,免疫学界开启了对抗肿瘤的新方法——免疫检查点阻断疗法。
2.2 免疫检查点药物的临床应用
由于肿瘤免疫检查点阻断疗法在动物实验中取得令人振奋的结果,备受鼓舞的James P. Allison迫不及待地想在肿瘤患者中验证其疗效。2000年,生物技术公司Medarex按照James P. Allison的方法,制备出可在人体使用的CTLA-4单克隆抗体——伊匹单抗(Ipilimumab)。2010年,Ipilimumab的第一个Ⅲ期临床试验结果公布:与传统疗法相比,Ipilimumab 能将晚期黑色素瘤(metastatic melanoma)的存活时间从6.4个月延长到10个月(P<0.001)。2011年,美国食品药品监督管理局(Food and Drug Administration, FDA)批准Ipilimumab用于晚期黑色素瘤治疗——这是第一个获批的肿瘤免疫检查点阻断剂。
继Ipilimumab之后,越来越多科学家认识到免疫检查点疗法的重要性。Tasuku Honjo自从发现PD-1后,多年来坚持探索其功能。2000年,Tasuku Honjo教授与哈佛医学院的Gordon J.Freeman发现B7家族新成员PD-L1能够与T细胞表面的PD-1结合抑制T细胞活化,参与肿瘤免疫逃逸[16]。陈列平教授则第一个使用单克隆抗体阻断PD-1的抑制效应,发起并参与组织了PD-1免疫疗法的第一个临床试验[17]。在此期间,Tasuku Honjo教授带领他的研究团队,从 PD-1 抗体的动物实验开始[18](图4),之后又与药厂合作在美国及日本进行针对PD-1的新药研发,2014年PD-1阻断药物纳武单抗OPDIVO(Nivolumab)在日本首先获得批准。这一新药作为具有划时代意义的“癌症免疫疗法”备受世界瞩目,该疗法同时也被Science评选为2013年的 “年度突破” 之一。
PD-1抑制剂的出现,使得免疫疗法的治疗范围从转移性黑色素瘤扩展到了包括肺癌、肾癌、头颈癌、淋巴瘤等在内的多种肿瘤。目前为止,FDA已经批准5个PD-1/PD-L1药物上市用于临床治疗,包括PD-1抑制剂Nivolumab和Pembrolizumab,以及PD-L1抑制剂Atezolizumab、Avelumab和Durvalumab;而我国国家药品监督管理局也于今年6月份批准PD-1抑制剂纳武利尤单抗注射液(Nivolumab infection)在中国上市应用,突显了我国对肿瘤免疫检查点疗法的重视。由此,由艾利森开启并发展的免疫检查点疗法方兴未艾。其原理如图5所示。
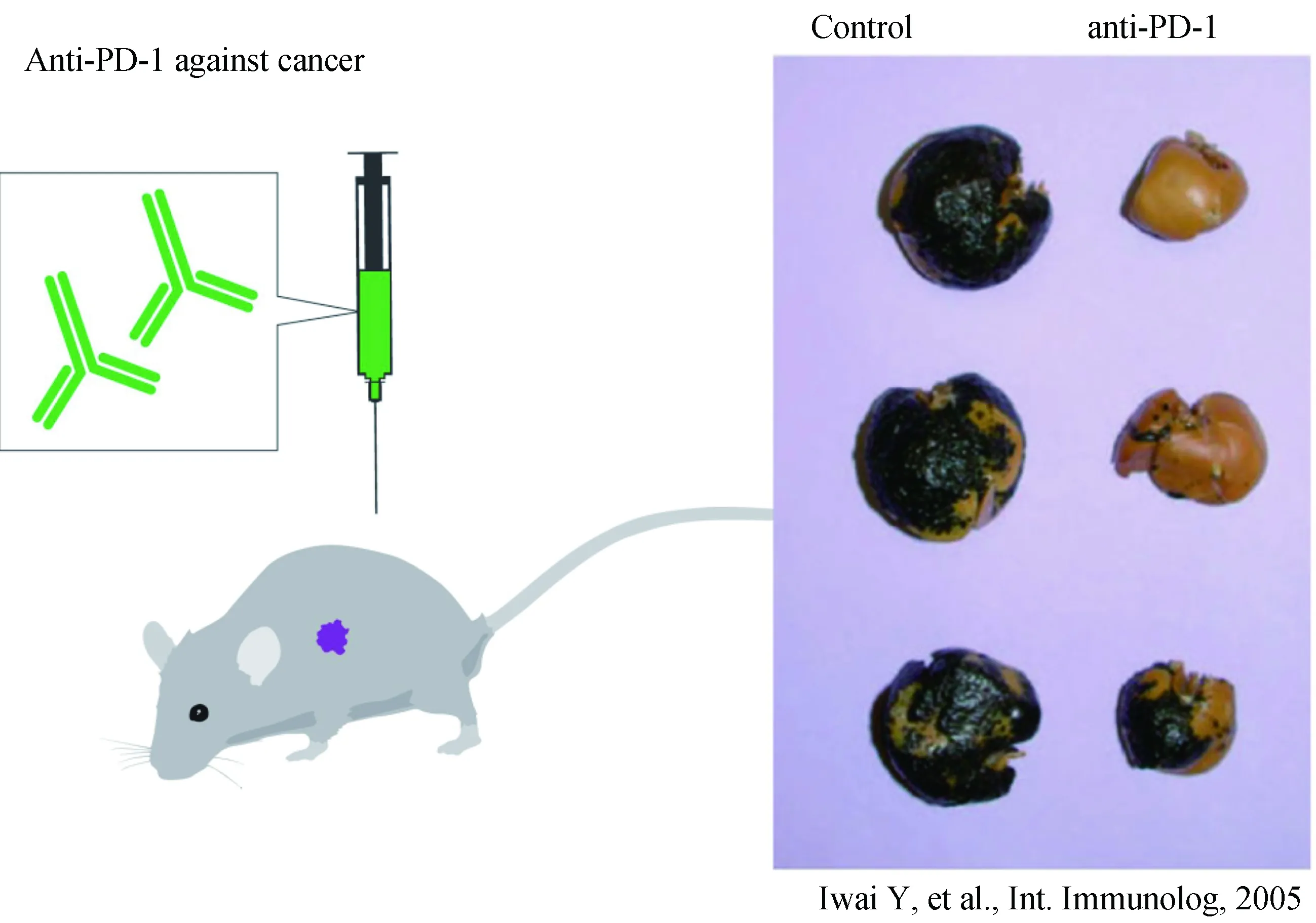
图4 PD-1单克隆抗体的抑瘤效应[1]
Tasuku Honjo及其合作者发现:抗PD-1单克隆抗体应用荷瘤(转移性黑色素瘤)小鼠后能够阻断PD-1的抑制效应(解除刹车),控制肿瘤生长。

图5 CTLA-4和PD-1的免疫抑制作用及相应抗体的刹车效应[1]
A:T细胞激活需要双信号:一是T细胞受体(TCR)识别结合抗原提呈细胞(APC)表面的MHC-抗原肽复合物;二是T细胞表面CD28与APC表面B7分子结合的共刺激信号; 而CTLA-4则作为“刹车”与B7结合抑制T细胞的活化。B:抗CTLA-4抗体(绿色)可阻断“刹车”功能,导致T细胞激活,攻击癌细胞。C:PD-1是另一种抑制T细胞活化的“刹车”分子。D:抗PD-1抗体可阻断“刹车”功能,导致T细胞激活,高效攻击癌细胞。
2.3 科学意义与展望
和传统的抗癌化疗药物和靶向肿瘤表面抗原的靶向药物相比,免疫检查点疗法所用的CTLA-4和PD-1单克隆抗体具有独特优势:首先,它通过抑制CTLA-4和PD-1的作用,使肿瘤微环境中的免疫功能“正常化”,可针对多种癌症发挥作用;其次,它的不良反应相对较小;第三,目前用于无其它疗法可用的晚期癌症患者,可多次给药。这使得免疫检查点药物能够成为治疗多种类型癌症的广谱免疫制剂。最新临床研究结果显示,同时靶向CTLA-4和PD-1的联合疗法或许能够更有效地治疗黑色素瘤患者[19]。因此,同时针对多个免疫检查点的联合免疫治疗、手术/化学药物治疗/放射治疗联合免疫治疗、如何提高免疫治疗的反应率、如何控制免疫治疗成本从而降低昂贵的价格,以及针对自身免疫病等其他类疾病的免疫治疗等,将是该类药物接下来的研究方向和需要解决的重要问题。
