林木抗虫性研究进展*
2018-10-23李淑娴
李 薇 李淑娴
(1. 南京林业大学林学院,江苏 南京 210037;2. 南京林业大学南方现代林业协同创新中心,江苏 南京 210037)
我国现有人工林面积达6 169万hm2[1],大面积纯林较容易受到虫害的威胁,虫害一直是制约农、林作物高产、优产和稳产的重要因素,这种现象对发展中国家的造成的损失更加严重,因此抗虫性研究在我国具有重要的生产意义。抗虫性强也是林木育种和造林生产的重要指标之一。随着化学农药对环境的污染以及害虫抗药性的加强,选育对目的害虫具有高抗性的林木新品种越来越受到人们的重视。
1 林木抗虫性的鉴定及分级标记方法
1.1 林木抗虫性定义及鉴定
林木抗虫性体现在林木与昆虫相互作用的整个过程中,林木抗虫性状由遗传决定,也会受到林木自身的生物、物理和化学因子的影响,可对昆虫行为和生物化学等功能产生负面影响,机械损伤和虫害入侵也可以诱导林木的抗虫性发挥防御作用[2-3]。从林木对害虫负面作用的性质,可将抗虫性分为真性抗性 (令害虫种群趋于消亡,包括拒虫性、杀生性、抗生性) 和假性抗性 (令害虫种群增长受到一定的抑制,包括拟抗虫性、抑制性、抗生性、耐害性) 2种[4-5]。
林木对昆虫的抗性影响级数取决于对昆虫的敏感性及外界干扰的强弱。林木的物候现象也会对昆虫的抗虫性产生影响,选育物候期非同步的林木可以作为病虫害综合治理的一种途径,掌握林木抗虫性的概念对于鉴定对害虫具有高抗性的林木具有理论指导意义。林木抗虫鉴定是抗虫育种的重要环节,田间调查和人工接虫是2种抗虫鉴定的主要方法。就林木而言,田间调查的影响因素较多,而人工接虫技术由于具有可快速测定林木的抗虫性、缩短研究周期、提高测定结果可信度的特点,现已被广泛应用。人工接虫技术包括大田筛选法[6]、大田笼罩法[7]、温室筛选法[8]套笼接虫、室内离体接虫和网室接虫等方法[9-11];人工接虫实验过程中需要考虑供试材料及昆虫特性;抗虫测定中,接虫数量、雌雄虫比例、参试树木年龄、规格以及接虫环境等也都是需要考虑的因素。
1.2 林木抗虫性的分级标记方法
传统抗虫性分级是根据经验将其粗分成不同等级,如在杨树 (Populus) 抗杨圆蚧 (Quadraspidiotusgigas)、梨圆蚧 (Quadraspidiotuspemiciosus) 的研究中,周茂建[12]将抗虫性粗分为3个等级:Ⅰ级,寄主抗虫性较强,害虫寄生率低并且不易在该树上扩展蔓延;Ⅱ级,中等抗性,树木被害后树势衰弱,但不易枯死;Ⅲ级,寄主抗性弱,受害率高,受害后易枯死。黄金水等[13]在木麻黄 (CasuarinaequisetifoliaForst.) 的抗虫性研究中,以有虫株率为指标,采用聚类分析将不同种源木麻黄的抗虫性分为高抗、中抗、高感和中感4大类群。也有学者在对杨树的抗虫性测定中,依据被害率、刻槽数等指标进行模糊聚类分析、显著性检验,将杨树抗虫性分成免疫、高抗、抗性、感虫和高感5个等级[14]。上述2项研究结合了统计学手段,因而分级更为科学合理。由于抗虫性测定受环境因素的影响比较大,并且抗虫性是树木与害虫的互作,测定过程不仅要考虑树木对害虫的作用,还需要兼顾害虫对树木的作用。基于这一理念,秦飞等[15]提出了一套新的抗虫性分级方法,并给出了抗虫力(R)和耐害力 (T) 的具体计算或分级方法。以上方法测定的抗虫性均为不连续特级,而林木的抗虫性状通常表现为典型的数量性状。在前人研究基础上,陈辉等[16]提出“抗性指数”的概念,实现了抗虫性的量化描述。
总体来讲,目前林木抗虫性分级评价方法还没有系统化,研究内容仅局限于少量品种的选择及相关指标的测定,不同研究的评价结果缺乏可比性。如何构建符合林业特点的林木抗虫性科学分类评价体系,仍是一个需要加强研究的课题。
2 林木抗虫性的表现方式
林木与昆虫长期互作,协同进化,林木对植食性昆虫的防御机制可分为组成型抗性和诱导型抗性。其中组成型抗性由遗传决定,是在林木体内始终起作用的阻碍害虫取食的物理或化学因子,而诱导性防御则是由于机械损伤、植食性昆虫取食及病原菌侵染等引起的类似于免疫应答的反应,使林木体内产生一些可防御害虫取食的次生代谢物质[17]。2种物质基础一致,均涉及植物形态、营养物质、次生代谢化合物积累对昆虫取食的影响。下面简要介绍林木对昆虫的防御形式。
2.1 组成性防御
组成性防御包括物理防御和化学防御2种。在长期的进化过程中,林木形成了多种防御害虫入侵的外部形态特征(绒毛、蜡质、叶表皮组织骨化、硅化)和内部组织结构(石细胞含量,树皮和木质部硬度,纤维素及木质素含量、导管结构和形态和木栓层的厚度以及内含物组成)都可以影响害虫取食和刻槽产卵[18],这些结构是对害虫进行物理防卫的第一道屏障,其轻微变化可能改变植物的适口度,从而影响昆虫的行为和生长发育。奥利维尔甲虫 (Paropsisatomaria) 初孵化的幼虫只能取食桉树 (Eucalyptusrobusta) 非常幼嫩的叶片[19];除去柳树 (Salixbabylonica) 嫩叶的绒毛则有利于柳蓝叶甲幼虫 (Plagioderaversicolora) 的取食[20];针叶树筛管丝团中混有的草酸钙晶体可有效抵抗树皮甲虫[21];美国西部白松 (Pinusbungeana) 对象鼻虫 (Elaeidobiuskamerunicus) 的抗性较东部强,主要是由于前者外皮层树脂道数量更多[22]。
对比物理防御,化学防御在组成性防御中起到更为重要的作用。二者共同影响昆虫的行为、生长发育和繁殖,而化学防御主要涉及林木的初级营养物质和次生代谢产物的参与。
2.1.1植物初级营养物质对抗虫性的影响
不同生境和树龄及植株个体的不同组织,在营养成分含量及组成上往往存在显著差异。昆虫的生长发育与繁殖受林木营养物质种类和质量影响。有研究表明,糖类物质的种类不同对昆虫的影响也不同,可溶性糖含量增高,有利于昆虫的存活和生长发育[23]。高含量的半乳糖和蔗糖可能延缓人工饲料喂养昆虫的生长。白桦 (Betulaplatyphyll) 叶片中这2种糖含量也与昆虫生长呈负相关,毛白杨 (Populustomentosa) 无性系树皮内总糖含量高时抗虫性较差[24]。蛋白质也是昆虫生长和发育的基本物质,树皮含氮物质中蛋白质类所占的比例高,木质部碳水化合物含量较低有利于幼虫取食[25]。
2.1.2次生代谢产物对抗虫性的影响
植物长期进化其体内会合成种类丰富的次生代谢产物以应对生物和非生物胁迫,其合成和分布具有种属、器官、组织及生长发育时间特异性。植物的次生代谢物主要包括萜烯类 (如挥发物,苷类物质,类胡萝卜素和植物固醇)、酚类 (如酚酸类、香豆素类、木质素、芪类黄酮、丹宁酸和木质素) 和含氮化合物 (如生物碱和芥子油苷)。林木抗虫次生代谢物研究中,尤以对酚类化合物、类萜化合物和生物碱类化合物的研究更为普遍,这些次生代谢产物对害虫的效应主要表现在诱集作用、驱避作用、拒食作用、毒杀作用、发育抑制作用及不育作用[26]等。值得注意的是,有些次生代谢产物需要特定营养物质的协同反应才能发挥抗虫作用,如没食子酸只有在特定蛋白质存在且取食对象碳水化合物比例适当的前提下,才会对蝗虫 (Tetrigoidea) 有防御作用[27]。当然,植物更多的是通过物理与化学防御的共同作用抵御昆虫侵害,如有些林木叶片具有分泌次生代谢物质的毛状体,毛状体和次生代谢产物共同对取食昆虫起防御作用。
2.2 诱导性防御
诱导性防御是树木受到机械损伤或者昆虫取食后激发自身基因调控表达以减轻伤害的一种诱导防御途径[28]。经过长期进化,树木可以识别昆虫取食、机械伤害并产生不同的响应策略。昆虫取食时,会激发植物一系列复杂的调控网络产生大量的防御蛋白和次生代谢产物,这些产物会参与到植物与昆虫的互作过程中。诱导性防御是保守、多层次、高度密集的防御系统,对大范围的病菌和害虫防御具有广谱有效性、系统性、持续性、传递性和动态性特点[27]。林木的诱导性防御主要包括可诱导的化学防御、可诱导的蛋白防御、可诱导的解剖学防御、可诱导的生态或者间接防御及可诱导的植株个体防御等5大类型。
2.2.1可诱导的化学防御
主要指一些有毒的、抗菌的、抑制营养吸收或消化的低分子量酚类、萜类及生物碱类物质,Delvas等[29]在白云杉 (Piceaglauca) 对云杉蚜虫 (Aphidoidea) 抗性研究中发现,抗虫植株受到取食后,酚类化合物中pungenol和piceol合成量显著增加,使云杉蚜虫幼虫取食受到显著影响。Fang等[30]发现天牛的取食促进了抗虫杨树水杨酚苷类、柳皮苷和美洲黑杨苷的合成,这些物质对天牛幼虫生长发育有不同程度的抑制作用。
2.2.2可诱导的蛋白防御
主要涉及一些有毒、抗菌、抑制生长或者营养吸收的氧化水解酶和蛋白抑制剂。抗性蛋白家族是一种可溶性的与昆虫或病原菌抑制相关的蛋白,现在已有17种以上抗性蛋白家族的防御功能已被阐明,如PR-3蛋白家族具有破坏真菌细胞壁及细胞膜的作用,而PR-6蛋白家族则被发现可作为线虫和植食性昆虫消化酶的抑制剂,机械损伤及昆虫取食后会导致蛋白酶抑制剂、半胱氨酸蛋白酶、凝集素、脂肪氧化酶及多酚氧化酶的富集和积累[31]。这些蛋白属具有毒性,有的则能导致昆虫拒食[32]。特定的多酚氧化酶可以明显减少昆虫氨基酸吸收,其分子基础是通过催化酚类物质氧化变为醌类化合物,该类化合物再与昆虫肠道蛋白交联从而抑制昆虫消化[33]。
2.2.3可诱导的解剖学防御
指植物由于创伤诱导产生的机械或者结构障碍,如松属 (Pinus) 和柏属 (Platycadus) 植物筛管和韧皮部受到创伤后,会形成创伤性树脂道,并且在受伤后的2~3周内持续有树脂和萜类物质合成[34],抵抗天牛 (Cerambycidae) 侵入到筛管和韧皮组织中[35]。
2.2.4可诱导的生态或者间接防御
有的植物在受到害虫取食后,会产生形态修饰及化学修饰,或分泌一些吸引害虫天敌的物质,这种间接防御是利用宿主-昆虫-天敌的取食关系实现的。如北美香柏 (Thujaoccidentalis) 的根部受到黑象甲幼虫侵害时,会释放乙酸叶醇酯来吸引其天敌杆线虫 (Ceanorhabditiselegans)[36]。作为一种信息素物质,VOCs不仅能引发未损伤的部位和未受害的植株产生防御性反应,还有助于招募昆虫天敌和寄生虫起到间接防御的作用[37]。有研究表明来自于亚油酸衍生途径的挥发性有机化合物 (VOCs) 可以促进茉莉酸甲酯途径中几个参与防御的基因,如查尔酮合成酶 (CHS),丙二烯氧化物合酶 (AOS),过氧化氢酶 (HPL) 和脂肪酸合成酶 (LOX2) 的表达,参与到抗虫防御过程中[38]。
2.2.5可诱导的植株个体防御
植株可以增强新陈代谢或光合作用的能力来减轻病虫伤害,提高其的耐虫性。虫害发生时,植株会通过上调未受害叶片的光合速率[39]、增加叶面积、改变植株地上和地下部分光合产物分配模式等方式,主动提高植株对突发病虫害的耐受力。
3 植物抗虫性相关的信号传递途径
植食性昆虫可以通过不同种取食途径从宿主中获得营养物质,植物在与昆虫作用的过程中进化出了多种不同的防御机制,如合成一些有毒的代谢产物及蛋白破坏昆虫的生理功能,或分泌一些可以吸引昆虫天敌的物质,这些高度复杂的防御机制起始于植物细胞膜上各种效应器对昆虫口器分泌物的识别,其后受损的植物细胞内钙离子浓度增加,细胞膜电化学梯度变化,丝裂原活化蛋白激酶 (MAPK) 的激活和蛋白质磷酸化反应,还原型辅酶II (NADPH) 氧化酶及氧化还原物质的释放,这些细胞内信号分子级联化反应会导致茉莉酸 (JA) 杨酸 (SA) 途径、乙烯 (ET) 等信号途径的一些参与防御的基因表达及VOCs的释放[40]。
3.1 JA途径
JA途径是进化上相对保守的、非特异性即广谱性的昆虫防御机制。机械损伤或昆虫取食会造成创伤处短时间的JA积累,JA合成的底物a-亚麻酸 (α-LeA) 由叶绿体的半乳糖脂膜中磷脂释放,随后a-亚麻酸被脂肪酸氧化酶 (LOX) 氧化为 (1, 3)-氢-氧-亚麻酸 (13-HPOT)[41],它被重新排列和环化,由丙二烯氧化酶 (AOS、AOC) 氧化,生成12-氧-植物二烯酸 (OPDA)。OPDA随即转移至过氧化物酶体中,在经过12-氧-植物二烯酸还原酶基因 (12-oxophytodienoate reductase) 多次氧化后,生成了JA (如图1)。JA在接下来的酶促反应中又可以生成一系列派生物如MeJA和JA-Ile等。这些派生物在信号传导过程中起重要的调控作用,如JA-Ile的剂量变化可以调控泛素化调节蛋白SCFCOI1与茉莉酸途径转录因子抑制蛋白JAZ的结合。在健康未受损伤的叶片中,JA-Ile的浓度较低,低浓度的JA-Ile会允许JAZ结合到转录调控区来抑制下游防御基因表达[42]。而当叶片受到侵害时,JA-Ile快速积累促进了JAZ和SCFCOI1的结合,使JAZ被降解失去抑制活性,促使下游防御基因表达 (如图2)。
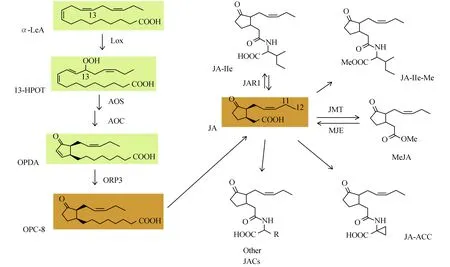
图1JAZ合成及其派生物形成图
Fig.1 JAZ synthesis and biological formation pathway
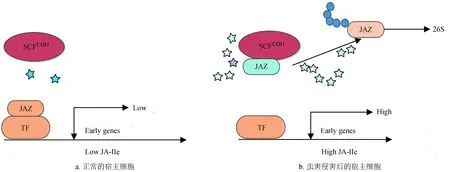
图2JAZ调控的茉莉酸信号途径模式图
Fig.2 The JAZ repressor model of jasmonate signaling pathway pattern
最新的研究表明COI1-JAZ通路具有组织表达和时空特异性,Mao等[43]通过比较14 d与26 d的拟南芥 (Arabidopsisthaliana) 植株,发现成熟的植株对鳞翅目 (Lepidotera) 昆虫表型出较强耐受力,其体内茉莉酸途径相关的参与抗性防御合成的基因表达量减弱,这说明茉莉酸防御水平随着植株成熟表现出衰减变化,茉莉酮酸酯反应也被SPL9和植株年龄反向调控。进一步的研究表明,SPL9能与JAZ家族分子 (JAZ1/3/4/6/10/11/12) 直接相互作用,而SPL9-JAZ的相互作用与COI1-JAZ的相互作用之间存在着竞争关系,并且SPL9分子能使JAZ分子更加稳定的结合在转录调控区[44]。研究还发现,在信号输出的精细调控中,在组织和器官水平层面进行空间调控是茉莉酮酸酯信号通路途径另一个非常重要的因素。已有许多研究显示其是以组织特异性的方式进行精细调控,如NINJA主要在植物根部发挥功能[45],茉莉酸途径可以激活根部的转录因子EIN3,但是在黄化幼苗顶端组织却是起抑制作用[46]。此外,JA信号途径又可以通过通用转录因子ORA59、MYC2分别与乙烯和脱落酸 (ABA) 通路进行信号交联,微阵列的结果显示有41种JA响应基因参与到乙烯、水杨酸信号传递途径中,因此JA与这些通路之间存在着交叉交流[47]。
由于林木适合研究的突变体较少,目前林木的诱导防御信号途径还主要借鉴模式植物和作物的研究结果,施加同样外源信号诱导因子可以引发林木的诱导防御反应,如JA的施用可以提高松树防御象鼻虫的能力[35],在挪威云杉上喷施MeJA可以诱导其树脂道中萜类物质的积累以有效应对甲虫的危害[48]。喷施一定浓度的MeJA后,枣树 (Ziziphusjujube) 诱导抗虫性增强[49],构杞 (Lyciumbarbarum)、青杨 (Populuscathayana) 叶内防御蛋白酶活性显著增加[50]。
3.2 水杨酸途径
近年来水杨酸(SA)途径也被公认为植物抵御昆虫、病原菌等的重要内源信号通路,可诱导多种烟草 (Nicotianatabacum)、玉米 (Zeamays)、拟南芥植物对生物与非生物胁迫产生持续抗性。近期的研究还发现SA途径在生物应激反应中还参与了气孔的关闭过程[51]。
SA作为胞内信号分子能够参与到植物的抗性反应中,尤其在防御病原微生物侵害时,会引起PAMPs和效应物触发的免疫应答反应。作为外源信号分子,SA早已被确定为系统获得性抗性 (SAR) 的化学诱导剂[52]。SA会在叶绿体中诱导合成,其底物分支酸通过异分支酸合成酶合成,而分支酸是受生物胁迫后诱导莽草酸酯途径合成的主要成分之一。大多数病原菌诱导的SA是由糖化UDP-葡萄糖基转移酶形成无毒的SA 2-O-β-D-葡萄糖苷,游离在液泡里形成一个速效的SA的来源。
SA被修饰后的产物可以为植物防御反应赋予生物特异性功能,其中水杨酸甲酯 (Me SA) 作为一个长距离信号分子与其共同作用来诱导SAR,被认为是植物长距离SAR信号之一,同时也是SA在韧皮部中的运输形式。植物受到侵染后产生的SA被苯甲酸/水杨酸羧甲基转移酶1转化产生Me SA;当Me SA被运输至远端植物组织后,与SA结合蛋白2 (SABP2) 相结合,SABP2具有酯酶活性,其催化Me SA重新生成SA,从而诱发SAR。这说明,SABP2作为SA的结合蛋白以及其SABP2的酯酶活性在植物SAR发生及发展过程中是无可或缺的[53]。
SA信号转导途径转导过程包括SA首先与SA结合蛋白 (SABPs) 结合,SA-SABP0复合体将信息传递给胞内第二信使,如H2O2等,信号通过自我反馈机制放大后在胞内转导引发过敏反应,同时引起胞内氧化还原态改变,激活NPR1, TGA和WRKY等转录因子的活化与互作,最终诱导抗性PR基因、苯丙氨酸解氨酶关键酶和β-1, 3-葡聚糖酶及SAR的产生[54](图3)。
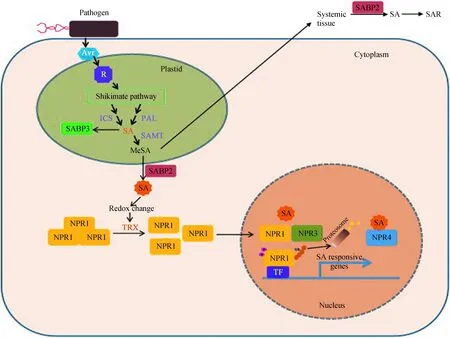
图3植物水杨酸介导的相应生物胁迫信号途径
Fig.3 The salicylic acid-mediated biotic stress signaling in plants
目前最新的SA通路研究主要集中在利用一些生物化学、基因工程技术或者微阵列技术发现一些未知的SA-结合蛋白,为进一步确认整个信号通路中各组分及其功能打下基础。现在发现的新的一些SA结合蛋白包括过氧化氢酶、碳酸酐酶、甲基水杨酸酯酶、硫代磷酸酶、甘油醛3-磷酸脱氢酶和α-酮戊二酸脱氢酶等。SABP的作用机制是通过对SA的结合来抑制其的过氧化氢酶活性,导致了细胞内活性氧浓度的积累使防御蛋白的活化发挥功能。Tripathi等[55]指出转基因烟草过表达过氧化氢酶导致植物体内活性氧分子水平降低表现出对烟草花叶病毒的敏感性。
NPR (nonexpresser of PR genes) 也是一种重要的SA-结合蛋白,也是SAR的主要调控者。受到SA诱导后NPR1蛋白以复杂的低聚物形态转化成单体蛋白,还原势升高,连接NPR1低聚物的82、216位半胱氨酸残基分子之间的二硫键会被还原,当这2个残基突变时,NPR1也会变成单体,释放出具有完整核定位序列且能转移到细胞核内的单体NPR1[56]。Ding等[57]发现,NPR1能与含有亮氨酸拉链的转录因子TGA亚家族和WRKY家族互成员发生相互作用,可以结合到PR-1基因启动子应答性SA的as-1元件上,来调控PR基因表达。
NPR1的旁系同源物NPR3和NPR4是CUL3蛋白泛素和E3连接酶的接头蛋白,该连接酶能够根据SA浓度的高低来特别的标记NPR1,从而影响它被26S溶酶体途径降解,NPR3和NPR4与不同浓度SA结合会影响其与NPR1的互作来诱导防御反应的功能。
SA、JA途径是植物应对胁迫的重要内源分子机制。大量研究表明,SA与JA信号途径之间存在相互拮抗作用,诱导或者施加外源的SA可以激活SA信号途径,但却抑制了JA信号响应一些应答基因如PDF1.2,LOX2和VSP2等基因的表达;SA的激活反应使依赖于JA途径防御的植物更容易受到害虫的侵害,JA对SA途径也有相类似的作用。SA主要是通过抑制过氧化氢物脱水酶的活性,该酶可催化JA合成的前体13-HPLA转化成12-O-植物二烯酸,同时还可以抑制PI基因的转录来抑制JA信号途径传递。JA对SA信号途径的作用可能是通过抑制SA的生物合成和PR基因的转录来实现的。随后的研究证明SA与JA这两种信号途径之间存在着协同效应,SA和JA相互的作用结果取决于两者相互作用的阶段和顺序及施加的外源激素的剂量[52]。除了JA、SA途径以外,ABA、NO和乙烯等激素信号分子也参与其中,各种生理生化机制信号通路是复杂的,各种信号通路之间的交叉交流形成复杂的调控网络来协助植物应对非生物的胁迫。
林木与昆虫互作更为多样化,且存在蛀干害虫等特殊虫害,因此林木可能拥有更为丰富的响应害虫入侵的信号途径。已有学者推测林木中有可能存在不同于草本植物的介导防御诱导的信号分子[58]。
4 林木转抗虫基因育种
转基因作为林业生物技术的重要一环,已经被广泛的应用于林木抗虫育种工作中。利用DNA重组手段,可将一些外源的或者人工构建的抗性基因导入林木染色体中,从而产生具有外源基因表达的转基因抗虫林木。目前林木的抗虫基因来源主要包括苏云金杆菌毒蛋白基因(微生物源),蛋白酶抑制剂基因、植物凝集素基因、淀粉酶抑制剂基因等(植物源),蝎毒素基因和蜘蛛毒素基因(动物源)等[59]。常用的转基因方法包括电转化、显微注射法,脂质体介导转化法等,其中农杆菌转化和基因枪法是2种试用于林木的转基因方法[60]。
在抗虫基因研究方面,已在多个树种上开展了利用分子标记构建遗传图谱,定位克隆控制抗虫性状的基因位点的研究,如苹果(Maluspumila)中对苹果小卷娥(Laspeyresiapomonella)和桃潜叶娥(Lyonetiaclerkella)抗性位点的基因定位研究[61]。利用简化基因组测序技术构建遗传图谱,对杨树抗蚜虫基因位点的定位和分析中,Carletti等[11]发现其中一个主效QTL位点可以解释44.1%的遗传变异;通过目标区间序列解析,找到了杨树抗蚜虫的3个候选基因,为抗蚜虫数量位点基因克隆打下了基础。采用多组学结合的手段有利于研究者在整个全基因组范围内挖掘抗虫信号调控网络及一些参与抗虫防御的基因和代谢物质。王晓丽等比较了感虫和抗虫的棉花(Gossypium)品种在受到棉铃虫(Helicoverpaarmigera)侵害前后的转录组和代谢组的信息变化,挖掘到了抗虫基因,林木在进化过程中可能丢失部分抗性机制,这些优良的性状可能存在于某些野生品种中,育种家需要发掘有利的抗虫性状并且转化于商业品种中,发展“绿色化学”基因工程技术,生产可诱导的天然杀虫剂或半化学制品,倡导林业抗虫防御的综合治理手段。随着测序技术的进步和林木遗传研究的不断深入,林木抗虫基因克隆和抗虫分子育种也将进入一个飞速发展的时代。最新的研究表明RNA干扰技术 (RNAi),依赖于双链RNA(dsRNA)引发的昆虫体内一些重要基因的转录后基因沉默机制,在作物抗虫防御方面发挥重要的功能。一种表达Snf7 dsRNA的转基因玉米的可以有效的起到防御玉米根部免受西部玉米根虫的侵害,其机理是Snf7 dsRNA可以通过干扰昆虫的Snf7基因表达来影响其体内液泡分选过程从而影响昆虫取食或者导致其死亡[62]。转基因抗虫棉携带棉铃虫分解棉子酚的CYP6AE14基因的dsRNA,可以有效抑制棉铃虫分解棉子酚毒性的能力,昆虫取食转基因抗虫棉后对其生长不利[63]。此外一些新起的基因编辑技术如锌指核酸酶 (ZFN)、转录激活样效应因子核酸酶 (TALEN) 和成簇规律间隔短回文重复序列 (CRISPR/Cas9) 这些反义遗传学手段可以均可诱导拟南芥、玉米和水稻等植物基因组缺失突变、特殊序列替换或插入,调节基因组内特异目标位点。目前基因编辑技术应用于林木的实例较少,但是这些技术手段将有助于我们研究林木有效的抗病虫害性状,消除转基因林木筛选标记,帮助外源基因稳定表达及降低嵌合体和变种的产生概率。
林木抗虫性状同木材、开花控制等性状都属于多基因控制,因此多基因转化法是转基因抗虫育种的主要方向。王志斌等[64]利用UNA成熟蛋白基因和人工合成的GFMcryAI,创建双价基因载体,进行转基因抗棉铃虫的实验,转基因烟草拥有较好的抗虫效能;Dong等[65]将Cry3Aa基因和CRY1Ac基因构建在同一表达载体上,获得了对鳞翅目和鞘翅目 (Coleoptera) 的双抗性转基因巨霸杨。双元载体构建方法会导致目的基因沉默且仅适用于小分子量基因的叠加,采用共转化连续转化法,将不同基因的转基因材料进行有效杂交可以提高转化效率,促进外源基因表达[66]。
外源抗虫基因植物的表达稳定性及遗传规律是影响转基因植物应用前景的重要因素,在许多情况下目标基因插入整合在植物基因组中,会受到外部环境和植物生长条件的影响,导致外源基因的失活和沉默,从而影响外源基因的表达稳定性;此外外源基因还有复杂的遗传分离类型。到目前为止,符合孟德尔和非孟德尔遗传分离方式都有。如玉米、棉花和小麦 (Triticumaestivum) 等作物的 (t1-T3)代;苹果、杨树和李树 (Prunus) 的一些林木品种T1或BC1群体中很多转基因个体的外源基因的遗传方式都符合孟德尔的分离方式。田间试验可以获得转基因植物的外源抗虫基因的抗虫效果、遗传和表达规则。Ren等[67]将Cry1Ac gene转入741杨树中,研究发现了转抗虫基因可以稳定表达8~10年,通过控制杂交组合的方法研究了外源基因的遗传方式,转基因株系pb1、pb29和pb11分别与非转基因84 K白杨 (Populustomentosa) 的杂交后代中,BtCry1Ac基因pcr-阳性和pcr-阴性个体的比值分别为1.31、1.15和0.86。X2测试结果表明,该比率与孟德尔1∶1分离比一致,该抗虫性状是由一对纯合等位基因控制的,而pb6 × 8 k的杂交后代的抗虫性状表型分离比为3∶1。
利用目前的生物科学技术在商业规模上种植转基因抗虫林木品种是可行的,但是由于受转基因技术、严格的管理手段、生物安全和社会经济等各方面的限制,转基因抗虫林木并没有得到大规模商业化种植。目前适用于林木可携带多基因且稳定转化的载体较少,特异性启动子改造后活性并不高,不同林木的高效组培再生系统和基因转化体系还没有完全建立,抗虫机理未阐明,挖掘到的抗虫基因数目有限,因此今后应加强林木转基因抗虫育种的研究工作。
5 结 语
林木抗虫性是多种防御机制的积累及协同效应,是化学与物理防御方式的结合,外界因素如机械损伤及虫害会引发诱导防御机制,这些作用相结合共同应对生物不利侵害,但现在对林木如何感知及应对植食性昆虫的侵害还远未被阐明。以林木为材料,开展钙离子通路、磷酸化级联反应、诱导防御信号传导途径、反馈调节网络及转录调控的研究还十分缺乏。昆虫取食林木会诱导寄主产生防御反应,引起林木生理过程的改变,影响其初级代谢过程进而影响林木的抗虫性。昆虫取食后对林木光合作用产生何种的影响,光合作用与植物的防御反应存在的关系,将会是今后的一个研究热点问题。尽管模式植物和作物抗虫研究的结果为我们研究林木的抗虫机制提供了有益借鉴,但林木的抗虫遗传基础和防御机制最终还需要以林木自身为材料开展研究。
分子生物学的飞速发展推进了林木分子育种时代的到来,林木抗虫分子育种也是一个研究热点。利用重组DNA技术,将外源抗虫基因苏云金杆菌毒蛋白(Bt毒蛋白)基因、蛋白酶抑制剂(PI)基因导入林木基因组,培育出转基因抗虫林木新品种,现在部分林木转基因抗虫品种已进入大田实验阶段。开展利用RNAi技术控制虫害已经成为热点,与传统抗虫蛋白转基因相比,这一技术更具选择性和安全性。抗虫标记定位方面目前定位的区段较大,精细定位工作需要较大的分离群体,耗时、费力;抗虫表型鉴定评价标准不一致,因此可以采用全基因组关联分析来检验每个遗传标记或标记区间与数量性状的关系,根据标记与目标性状连锁程度确定各个QTL的效应。随着科学技术的日益发展,分子水平研究的逐渐深入,林木抗虫性研究方法上将进行与分子生物学、植物生理学、林木栽培学以及林木遗传育种学等多学科结合,林木抗虫性相关研究必然会展现出良好的前景。
