猪轮状病毒对小鼠小肠粘膜TLR3表达的影响
2018-10-22刘北华
刘北华
(广东省深圳市宝安区动物卫生监督所,深圳 518101)
0 引言
轮状病毒(Rotavirus,RV)是双链核糖核酸病毒,属于呼肠孤病毒科。猪轮状病毒易感于猪的小肠粘膜细胞,引起小肠绒毛的细胞损伤,进而引发猪的腹泻,此外,感染仔猪因腹泻而生长迟缓对养猪业造成巨大的经济损失。目前对猪病毒性腹泻病毒感染特点、免疫应答和疫苗开发研究具有一定的了解,但猪轮状病毒是肠道病原微生物,其粘膜免疫机理尚不清楚,使得轮状病毒感染免疫应答的认识还不完全。TLR3可以特异性的识别双链RNA,双链RNA又是轮状病毒在复制期间的中间体,故TLR3可能在抗病毒的免疫应答过程中发挥一定的作用。
1 概述
1.1 轮状病毒
轮状病毒(Rotavirus,RV)是双链核糖核酸病毒,属于呼肠孤病毒科。轮状病毒第一次发现于腹泻的犊牛粪便中,此后在人、绵羊、猪、马、犬、猫、鼠及禽类中都有所发现。仔猪感染猪轮状病毒后可使仔猪出现严重的腹泻、厌食等临床症状。感染该病毒的仔猪死亡率变化较大,在0~50%之间。
1.1.1 生物学特性
轮状病毒的病毒颗粒略呈圆形,没有囊膜。轮状病毒中心由核酸构成,轮状病毒粒子由3层衣壳组成,使得病毒颗粒呈致密的六角形棱心。轮状病毒有6个血清型,即A、B、C、D、E、F,但是轮状病毒的各血清型间没有抗原相关性。然而,大部分猪轮状病毒的血清型属于C型。
轮状病毒的体外培养困难,但可在培养基中加入胰酶或胰蛋白酶培养,但在制备原代猪肾细胞时须除去胎牛血清接受感染悉生小猪小肠内容物的10%无菌滤液,吸附1 h后,将未吸附的残留的液体倒掉,进行培养18~24 h后,用免疫荧光试验检验有无轮状病毒颗粒的存在。该病毒感染性不能被乙醚和氯仿灭活,对环境因素有抵抗力,对常用的消毒剂如碘伏、次氯酸有耐受性[1]。
1.1.2 致病性
自然条件下,动物之间不太可能发生轮状病毒交叉感染,但试验感染时可以发生。试验感染低于1周龄的哺乳仔猪时,仔猪先出现呕吐症状,之后发生水样腹泻,持续4~5 d,仔猪发生严重的脱水,最终死亡。猪轮状病毒感染存在年龄分布的特点,日龄不足2 d的仔猪感染通常死亡;10~12 d感染者出现腹泻,有的患病动物可以康复;出生后19 d的仔猪感染轮状病毒后无明显的症状表现。自然状态下发生感染时,大部分猪群中患病猪大都表现出轻微腹泻的症状。
发病率和死亡率与轮状病毒感染数量、动物年龄、母源抗体含量、饲养条件、有无其他病原共同感染或继发感染等密切相关。猪群感染猪轮状病毒的发病率较高,在成年猪群中均可检测到轮状病毒的抗体。猪群感染轮状病毒不具有季节性,但是干燥季节和4~20 ℃的环境容易使猪群感染该病。
1.1.3 免疫
轮状病毒感染主要侵害的部位是肠道。猪机体内的循环抗体对轮状病毒感染导致的肠道感染病具有保护性作用,但可以作为猪是否感染该病毒的指示,如果循环抗体是母源抗体就可以起到一定的保护作用。小肠粘膜中的肠道相关淋巴样组织(GALT)产生的局部抗体可起到保护肠道、防治感染的作用。当轮状病毒感染肠道绒毛上皮细胞后,GALT内的淋巴细胞被激活,进入循环系统,之后回到隐窝。B淋巴细胞在GALT中分化为能够产生轮状病毒抗体的效应性B细胞,效应性B细胞产生相应的抗体(IgA),并分泌到肠腔中中和轮状病毒,阻止病毒侵害小肠的正常组织。动物试验中,试验感染猪群后5~10 d内便可以在血液中检测到轮状病毒抗体。感染后14~21 d用同种病毒攻击可提供足够保护作用[2]。哺乳仔猪的肠道中存在高水平的母源抗体,这些抗体中主要是IgA,IgA可保护肠道免受轮状病毒的感染。
1.2 Toll样受体
Toll样受体(Toll-like receptors,TLR),是一种可以参与天然免疫的重要蛋白分子,TLR也可以起到连接非特异性免疫和特异性免疫的作用。TLR可以识别出病原微生物所携带的特殊抗原决定,当病原微生物突破机体的皮肤、粘膜侵害机体时,TLR就可以识别这些病原体并激活机体的免疫应答。目前,Toll样受体有13种已经确认,这些受体基本存在于哺乳动物巨噬细胞、树突状细胞以及某些组织上皮细胞表面,这些Toll样受体中与病毒感染有关的TLRs有TLR2、TLR3、TLR4、TLR7以及TLR9。当TLR识别并结合病原体的抗原簇后就会激活下级信号转导以及转录因子表达增加,诱导下一步反应中的抗微生物分子、细胞因子、刺激分子等相关物质的表达增加,这些物质的表达增加会继续激活天然免疫和获得性免疫,产生特定的效果对机体起到保护作用[3]。
1.3 Toll样受体3
Toll样受体3(TLR3)可以特异性的识别病毒的双链RNA,而猪轮状病毒在复制时可以产生双链RNA,TLR3可能会识别这些双链RNA进而在抗病毒的免疫应答过程中发挥重要功能。TLR3主要表达具有抗原呈递的细胞内如树突状细胞,识别病毒的核糖核酸部分。TLR3在动物中不同组织和细胞的分布特点中存在差异性。较多的病毒复制时可产生dsRNA,这些dsRNA又能够被TLR3捕获并识别,进而激活I型干扰素(IFN-α/β)的表达。TLR3识别病毒的双链RNA后,便会诱导NF-κB和IFN-(α/β)的基因表达增加,这样便会导致促炎性细胞因子及辅助刺激因子的释放增高。TLRs/ NF-κB信号转导通路在引发机体炎症和免疫应答的过程中起到不可替代的作用[4]。该信号通路激活后大量的炎性介质释放,在这些炎性介质中,IFN-γ是一种重要的抗病毒细胞因子,IFN-γ能够抵抗轮状病毒在小肠粘膜细胞中的复制。
1.4 冰冻组织切片
冰冻组织切片是在低温的作用下使组织达到一定的硬度后进行切片的技术。冰冻切片较石蜡切片相比,制作过程更加简便、快捷,在切片的制作过程中不需要进行包埋、烤干等处理,却可以很好的保护组织抗原和酶的活性不受损伤,因而冰冻组织切片较多的应用于HE染色、免疫组织化学、免疫荧光等病理诊断和医学相关领域的研究。制作出的高质量冰冻组织切片能够保证试验结果的科学可靠[5]。
1.5 免疫组织化学技术
免疫组织化学技术(Immunohistochemistry ,IHC)指的是用标记物标记的抗体与组织或细胞抗原结合,对特定的抗原作出定性、定位和定量检测的一门生物学技术。免疫组化技术具有特异性强、灵敏度高的特点,而又可将形态与功能的研究相联系。其所用材料为组织切片和细胞爬片两类,其中组织切片的制作最常用并且最基本的方法是石蜡组织切片[6]。石蜡组织切片可以长期保存样本组织的形态,这种特点有利于各种试验的染色对照观察,但是石蜡组织切片制作中会使用甲醛固定液,经过甲醛固定液的组织会影响抗原的暴露,利用石蜡组织切片时需要进行免疫组化,试验前需要进行抗原修复以暴露抗原。然而冰冻组织切片在抗原保护上优于石蜡组织切片,冰冻组织切片可以良好的保护组织或细胞的抗原活性,特别是在科研实验的免疫组化中,冰冻组织切片可以标记出那些在石蜡切片上无法显示出来的抗原组织。鉴于这种优势使得冰冻组织切片也成为免疫组织化技术中经常采用的切片制作方法[7]。
1.6 免疫组化SP法
链霉菌抗生物素蛋白-过氧化酶(Streptavidin-Peroxidase,SP)连接体系指的是一种用来检测组织或细胞中特定抗原的一种免疫组织化学技术方法[8],即SP法(Streptavidin-Peroxidase Method)。霉菌抗生物素蛋白(SA)是从链霉菌中分离提取出的一种蛋白,这种蛋白具有穿透组织能力强,反应速度快的特点,霉菌抗生物素蛋白几乎不与组织的内源性凝集样物质发生非特异性结合,因而,利用该连接体系形成的SP法可以制作出低背景、高放大效果并且清晰的免疫组化切片[9]。免疫组化SP法相比其他的PAP、ABC法,操作更加简便,得出的检测结果具有高敏感性和高特异性等优点。免疫组化SP染色法原理见图1。

图1 免疫组化SP染色法原理
1.7 目的与意义
猪轮状病毒是一种常见的引起仔猪腹泻的病毒,感染途径多以患病猪排泄出的粪便进行传播,经其他健康猪舔食而感染[10]。该病毒感染时,小肠上皮细胞最易受到损害,临床表现出严重的腹泻。轮状病毒每年在夏秋冬季流行,患病猪的治疗费用、猪群高患病率与高死亡率都会造成高的经济损失[11]。因此,研究机体对于该病毒的免疫调节机制中对TLR3的影响具有重要的现实意义,并且为制定合理的预防措施提供重要理论依据。
2 材料与方法
2.1 材料
BALB/c小鼠
MA-104细胞系培养的猪轮状病毒DN30209,病毒滴度为1×107TCID
2.1.1 实验器材
冷冻切片机 德国徕卡微系统有限公司
黏附载玻片 福州迈新生物技术开发有限公司
盖玻片 盐城市弘达医学器材有限公司
DAB显色试剂盒 福州迈新生物技术开发有限公司
UltraSensitiveTMS-P免疫组化染色试剂盒 福州迈新生物技术开发有限公司
1 mL注射器 江苏正康医疗器械有限公司
徕卡DM500双目显微镜 德国徕卡微系统有限公司
恒温培养箱 上海姚氏仪器设备厂
移液器 德国艾本德股份公司
分析天平 南京莱步科技实业有限公司
高压蒸汽灭菌锅 山东博科科学仪器有限公司
2.1.2 药品与试剂
抗TLR3抗体 美国abcam抗体公司
冰冻切片包埋剂 德国徕卡微系统有限公司
丙酮 北京化工厂
无水乙醇 北京化工厂
二甲苯 北京化工厂
中性树胶 中国上海标本模型厂
苏木精染色液 南昌雨露实验器材有限公司
浓盐酸 北京化工厂
无水氯化钠 北京化工厂
无水氯化钾 北京化工厂
十二水合磷酸氢二钠 北京化工厂
磷酸二氢钾 北京化工厂
2.2 方法
2.2.1 实验动物准备
实验采用BALB/c小鼠,实验分为两组,一组为空白对照组,设置小鼠3只,每只灌服PBS缓冲液100 uL;另一组为实验组,设置3只小鼠,每只小鼠灌服100 uL病毒液。口服48 h后准备进行样本的采集[12]。
2.2.2 仪器准备
冰冻切片机使用前设置速冻台为-25 ℃,冰冻箱为-20 ℃,切片厚度为在4 μm;恒温箱设置温度到37 ℃[13]。
2.2.3 试剂的准备
2.2.3.1 猪轮状病毒液的配置
采用MA-104细胞系培养的猪轮状病毒DN30209,病毒滴度为1×107TCID。
解冻准备灌服小鼠;丙酮放入冰箱进行4 ℃预冷。
2.2.3.2 PBS缓冲液的配置
用分析天平分别称取无水氯化钠8 g、无水氯化钾0.2 g、十二水合磷酸氢二钠3.63 g、磷酸二氢钾0.24 g放入1 L的容量瓶中溶解后[14],加入蒸馏水900 mL混匀,并调节pH值至7.2~7.4,然后再加蒸馏水定容至1 L。移液至其他容器中,高温高压120 ℃,15 min后,常温保存。
2.2.3.3 DAB染色液的配置
从冰箱中取出DAB显色试剂盒,在1 mL的离心管中先加入850 uL的蒸馏水,再按试剂A、B、C 的顺序依次加入试剂各50 uL(约1滴),混匀即可,配制成DAB显色工作液,若出现沉淀可过滤后使用。配制好的工作液避光放置,工作液必须在30 min内使用,超过后弃用[15]。
2.2.3.4 第一抗体的稀释
从冰箱中取出采购的第一抗解冻,根据一抗使用说明书,按1∶5 000进行稀释。吸取1 uL抗体原液加入到999 mL PBS缓冲液中做1∶1 000的稀释,吹打混匀。然后再取100 uL加入到400 uL的PBS缓冲液中做1∶5稀释,吹打混匀,最后得到500 uL做1∶5 000稀释的抗体工作液,放入4 ℃可保存1~2周[16]。
2.2.3.5 梯度酒精的配置
吸取25 mL蒸馏水与75 mL的无水酒精混匀后,即可配制成75%的酒精溶液,按同样的方法配置85%和95%的酒精溶液。
2.2.3.6 盐酸酒精分色液的配制
95%的酒精吸取出100 mL与1 mL的38%的浓硫酸混合后,即可配制成试验所需要的盐酸酒精分色液。
2.2.4 冰冻切片的制作
将实验小鼠脊椎脱臼处死,切开腹部皮肤及肌肉,找到小肠的空肠段并截取1 cm左右,小心的夹住一段竖直放入包埋盒中,并倒入包埋液直至完全包埋住,迅速放入冰冻切片机的速冻台上进行速冻,10 min左右即可,若包埋块还发软需继续进行冷冻并适当降低切片机内的温度[17]。速冻好的包埋块剥去外层锡纸后将组织按在包埋架上并继续进行速冻5 min左右,之后将其夹在切片机的机头上。放下护刀架,使样本向刀架方向移动。将刀架底座沿着滑槽向远离操作者的方向移动到快要接触到样本,顺时针旋转柄轮一圈后,即可切除出一张切片,切到样品位置时,放下防卷板再次切片。当切到所需厚度的切片时,掀开玻璃防卷板用黏附性载玻片快速轻靠到切片上,切片立即附着在载玻片上,根据组织大小可在一张载玻片上多黏附几块组织,之后将粘有组织的载玻片自然晾干或者放入-20 ℃的冰箱中冷藏备用[18]。
2.2.5 免疫组化SP法操作方法
(1)冰冻切片晾干后,放入4 ℃的丙酮中浸泡处理10 min进行组织固定。
(2)切片室温下晾置10 min,这样可以使残留在组织上的丙酮挥发,以防止丙酮的干扰,再把切片用PBS缓液洗3次,每次5 min左右。
(3)倾倒去除切片上多余的PBS缓冲液,在每张切片滴加1滴过氧化酶阻断溶液,室温下静置反应10 min后,继续用PBS缓冲液对切片进行冲洗,每次冲洗3次,每次5 min左右。通过过氧化酶阻断剂的处理可以阻断内源性过氧化物酶的活性,以防止内源性过氧化物酶的干扰,使得背景很深[19]。
(4)倾倒或甩去切片上多余的PBS缓冲液后,每张切片滴加1滴正常非免疫动物血清,轻微振荡切片使液体均匀覆盖在切片上,放入恒温箱中,37 ℃下静置孵育10 min。
(5)除去组织上的血清,不用PBS缓冲液冲洗,滴加1滴第一抗体工作液,放入恒温箱37 ℃孵育1.5 h。
(6)每张切片继续用PBS缓冲液洗,每次冲洗次数为3次,每次冲洗时间为5 min左右。切片倾倒或甩去多余的残留在切片上的PBS缓冲液,此时,滴加1滴生物素标记的第二抗体,然后放置在室温下静置孵育10 min后,用PBS缓冲液继续冲洗,每次冲洗次数为3次,每次冲洗时间为5 min左右[20]。
(7)倾倒或者甩去切片上多余存在的PBS缓冲液,每张切片滴加1滴链霉菌抗生物素-过氧化物酶溶液,放置在室温下静置反应10 min后,用PBS缓冲液洗,每次冲洗3次,每次冲洗时间为5 min左右。
(8)倾倒或者甩去片上多余残存的PBS缓冲液,然后滴加100 uL左右新鲜配制的DAB显色液于切片上的组织,在显微镜下观察或者肉眼观察3~8 min,根据显色变化的情况进行终止显色反应[21]。
(9)终止反应时,用自来水冲洗或者浸泡去除残余在切片上的DAB显色液,之后将切片浸泡或者滴加苏木素染色液,避光染色8 min,轻微擦拭组织旁残存的染色液,放入到盐酸酒精分色液中涮洗5 s进行分色,然后再放入到自来水中浸泡10 min,进行返蓝的操作。
(10)返蓝处理后切片需要进行梯度酒精脱水干燥的操作,该操作包括先浸入75%酒精2 min;擦去残留的多余酒精后,再浸入85%酒精2 min,擦去残留的多余酒精,再浸入95%酒精2 min,擦去残留的多余酒精,再浸入无水酒精Ⅰ3 min,继续浸入无水酒精Ⅱ3 min处理[22],完成脱水的操作。
(11)脱水干燥后需要进行组织透明的处理,此步骤需要应用二甲苯透明,在通风橱中进行,先将切片浸入二甲苯Ⅰ中5 min,然后再浸入二甲苯Ⅱ中5 min,进行透明处理。
(12)中性树胶封片。取出干净的盖玻片,在做好的切片组织旁滴加一滴中性树胶(树胶用前可先与二甲苯1∶1稀释)后,用盖玻片倾斜覆盖在组织上,进行封片。
(13)封好的切片放入恒温箱中,37 ℃烤片1~2 h即可在显微镜下观察[23]。
2.2.6 切片观察与判读
2.2.6.1 人工计数分析
人工分析时以细胞膜或细胞胞质并伴有少量胞膜出现棕黄色颗粒就可以判定为阳性细胞[24]。将做好的免疫组化切片放到已经调节好的显微镜下进行观察,并调整到合适的倍数,首先对观察到的切片中图像的染色强度进行打分:切片图像显示为蓝色则判定为0分;组织中出现浅黄色颗粒时为1分;当组织中出现棕黄色颗粒着色时为2分;当组织中的细胞着色有棕褐色颗粒可计为3分。对已染色的组织进行染色强度与背景着色的比较,这在判定打分的操作过程中能够做到准确的判定[25]。
染色强度判定操作后,再按发生着色的阳性细胞在所有细胞中的百分比进行打分操作的处理,0分为阴性,即不存在着色的细胞出现;当阳性细胞占比<15%时可计为1分;当阳性细胞16%~50%时可计为2分;当阳性细胞占51%~75%时可判定该张切片的分数为3分;组织中的阳性细胞占比>75%时,可认为该张切片为4分[26]。
结果分析过程中,每张切片随机取5个视野,每个视野在400倍放大的显微镜下观察,每个采集到的视野都要进行阳性细胞在所有细胞中的占比计分与染色强度判定打分,对两次判定结果进行相加处理[27]。0分计为阴性(-);1~2分判定为弱阳性(+);3~4分为中等阳性(++);5分以上判定为强阳性(+++)。
2.2.6.2 图像分析方法
图像分析方法(Image analysis)是通过数码相机对切片染色结果进行图像拍照采集后,利用相关软件进行分析的方法。图像结果采集使用配备拍照功能的数码显微镜进行拍摄,采取免疫组化切片的结果[28]。首先将切片放置到显微镜上并调到合适的倍数(×400)后获得清晰图像,打开 Motic Images Advanced 4.0系统,通过在采集窗的操作进行图像捕捉,记录试验切片的结果,并对每张切片随机拍照5个视野。捕捉图像采用美国Media Cybernetics公司研发的图像分析软件Image-Pro Plus(Version 6.0)进行图像分析。用软件对捕获的图像进行相对灰度值的测定,记录所有图像的灰度值,最后该切片的图像分析结果有5次结果的均值作为该切片的灰度值测定结果[29]。
通过拍摄切片采集到的图像用软件分析后的结果用均数标准差(±S)表示;图像的灰度值与人工判定间的关系采用Spearman等级相关分析两者之间的相关性,该步骤的操作有助于保证两种分析方法对结果判定的准确性和可靠性,其中分析的结果(P<0.05)有统计学意义。
3 结果
3.1 切片图像采集结果
实验组和对照组的对比可以看出,实验组中,在小肠微绒毛中出现了较多的黄褐色颗粒,且较多的出现在细胞膜上,细胞质中出现较少[30]。可见图2、图3、图4与图5。

图2 对照组小肠绒毛TLR3,SP法,×400

图3 对照组小肠绒毛TLR3, SP法,×400

图4 实验组小肠绒毛TLR3表达SP法,×400
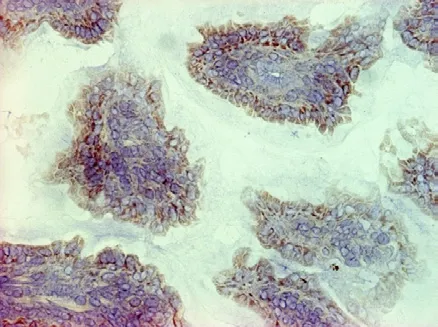
图5 实验组小肠绒毛TLR3表达, SP法,×400
3.2 人工计数结果
人工判定结果按照判定标准判定,实验组攻毒病毒的小鼠空肠组织中TLR3的表达呈中到强阳性者多于对照组,见表1。

表1 人工计数结果 单位:个
3.3 图像分析结果
实验组攻毒小鼠空肠组织中的TLR3阳性细胞的平均灰度值、阳性细胞在所有细胞中的百分比明显高于对照组,此结果见表2。
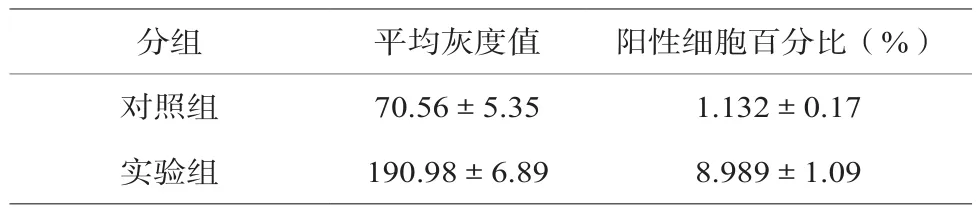
表2 图像分析结果
3.4 灰度与人工判定结果的相关性
根据两种判定结果进行灰度值与人工分析结果间的相关性分析,结果见表3,通过表中人工计数方法与图像分析的结果可以判断,在该试验分析中是比较符合的。

表3 各相关系数比较
4 结束语
猪轮状病毒在猪群中的感染率比较高,感染仔猪因腹泻而导致生长迟缓,对畜牧业造成严重的经济损失,这也是困扰养猪业发展的难题之一[31]。目前对猪轮状病毒感染的特点、免疫反应和疫苗开发做了大量的研究工作,但猪轮状病毒属于易于感染猪肠道的病原微生物,主要损害小肠绒毛的肠黏膜细胞,进而改变上皮细胞的结构和功能,其粘膜免疫机理尚不清楚,对轮状病毒感染免疫应答的认识还不完全,通过该试验,应用猪轮状病毒攻毒小鼠观察对小鼠小肠粘膜中TLR3的表达影响,结果表明:感染病毒后的小鼠小肠粘膜中TLR3的表达明显升高,通过对免疫组化切片的观察,可以发现TLR3主要表达于这些细胞的细胞膜上,这些细胞很可能是具有抗原呈递功能的树突状细胞迁移到微绒毛进行抗原捕获,发挥抗原呈递的功能,调节免疫功能。
