一株白牦牛源牛病毒性腹泻病毒E0基因的原核表达与序列分析
2018-10-19李林杰常秋燕王悦萦马晓霞马忠仁
马 鹏,李林杰,常秋燕,王悦萦,马晓霞,马忠仁 *
(1.西北民族大学 甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
【研究意义】牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)属于黄病毒科(Flaviviridea)瘟病毒属(Pestivirus),可引起牛病毒性腹泻-黏膜病(BVD-MD)。流行病学调查显示,在世界范围内,BVDV在畜牧业发达的国家流行形势依然严峻。而BVDV在中国的流行也呈上升趋势,涉及面达全国20多个省,包括内蒙古、甘肃、青海、新疆等。国内研究人员通过血清学方法检测到牦牛体内存在BVDV持续性感染,其血清抗体阳性率高达72.14 %[1];邓宇等[2]对来自全国11个省份的511份猪病料样品进行了检测,BVDV阳性率高达23.1 %~33.6 %。由此可见BVDV不仅对反刍动物养殖业造成严重威胁,同样也威胁着养猪业。【前人研究进展】BVDV基因组分为5′非翻译区(5′-UTR)、开放阅读框架区(ORF)和3′非翻译区(3′-UTR),ORF编码4种结构蛋白和8种非结构蛋白,C、E0、E1、E2为结构蛋白[3]。编码这11种蛋白质的基因在基因组上相对位置为5′-P20(NPRO)-P14(C)-gp48(E0)-gp25(E1)-gp53(E2)-P7-P125(NS2-3)-P10(NS4A)-P30(NS4B)-P58(NS5A)-P75(NS5B)-3′[4],其中P14、gp48、gp25、gp53是病毒的结构蛋白。
囊膜蛋白E0,位于ORF的811-1491位核苷酸,由227个氨基酸残基组成,有9个可糖基化位点,去糖基化形式分子质量约为27 ku。在病毒粒子中,E0以100 ku大小的同聚体存在,在细胞信号肽酶作用下,其N末端从多聚蛋白上裂解下来,可被分泌到宿主细胞外,E0蛋白有其特有的RNase活性[5],但该活性在瘟病毒增殖及使机体致病过程中所起的作用还不清楚,对E0蛋白RNase活性的研究有可能为预防病毒感染找到新的途径。E0是BVDV编码蛋白中保守性很高的蛋白,其上有中和表位,刺激机体产生的中和抗体具有中和BVDV和HCV抗原的能力[6]。氨基酸序列分析结果表明,在这一蛋白内有一高度保守结构域,因此它可用于研究基因工程亚单位疫苗,也可作为基因工程诊断抗原。【本研究切入点】本研究通过对BVDV E0基因的克隆、表达和进化树分析对BVDV GSTZ株进行分型研究,确定GSTZ株所属的基因型,为研究BVDV GSTZ株掌握相关数据。【拟解决的关键问题】通过对E0基因的抗原表位预测,为后续开发BVDV检测试剂盒或是研制相关疫苗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 牛肾细胞(Madin-Darby bovine kidney cell,MDBK)甘肃省动物细胞工程技术研究中心保藏。
1.1.2 主要试剂与仪器 RNA提取试剂盒,DNA纯化回收试剂盒,北京博凌科为生物科技有限公司;普通质粒小提试剂盒,兰州美伯生物医药技术有限公司;One Step RT-PCR Kit Ver.2试剂盒、XhoⅠ和BamHⅠ,宝生物工程(大连)有限公司;兔抗牛IgG,北京康为世纪生物科技有限公司;Bio-Rad电泳仪、转印槽,美国伯乐有限公司产品;PCR仪、化学发光仪,北京市六一仪器厂。
1.2 方法
1.2.1 引物设计 根据GenBank中的不同BVDV毒株,其中14株BVDV I型,登录号分别为NC_001461、U86600、U86599、AF091605、AF268278、AB078952、AB078950、M96687、AJ585412、M96751、AF526381、DQ088995、EF101530和U63479;7株BVDV II型,登录号分别为AF002227、AY149216、AF502399、AY149215、FJ527854、GQ888686和AB567658,将21株BVDV E0基因序列进行比对,利用Primer 5.0软件设计一对扩增E0基因的引物:
Forward:5′-CGGGATCCATAACACAGTGGAACTTACAGGATA-3′
Reverse:5′-CGCTCGAGCGCATAGCCCCAAACCATGTCCTA-3′
1.2.2 病毒RNA的提取 将从牦牛血清中分离得到的BVDV GSTZ株接种到MDBK细胞中进行增殖,每隔24 h进行观察,发现细胞发生病变后,收细胞。将细胞反复冻融3次,使用RNA提取试剂盒提取病毒RNA,置于-80 ℃保存,备用。
1.2.3 目的基因的扩增 使用One Step RT-PCR Kit Ver.2试剂盒进行扩增,扩增体系为:2×One Step Mix 25 μl;上下游引物各1 μl;One Step Enzyme Mix 2 μl;RNase free ddH2O 16 μl;模板5 μl。反应条件:42 ℃ 30 min;94 ℃ 3 min;94 ℃ 变性30 s;55 ℃ 复性 30 s;72 ℃ 延伸 1 min,共计25个循环;72 ℃ 10 min。琼脂糖凝胶电泳,回收目的基因置于-20 ℃保存,备用。
1.2.4 克隆载体和表达载体的构建 把E0基因插入克隆载体pMD18-T中,构建pMD18-T-E0,将克隆好的载体送金唯智测序。将pET-28a和pMD18-T-E0分别用BamHI和XhoI双酶切,回收酶切产物于22 ℃过夜连接,转化至E.coliBL21(DE3)感受态细胞中,在含有卡那霉素的LB平板上筛选阳性克隆,挑取单克隆培养,提质粒pET-28a-E0,使用BamH I和XhoI进行双酶切鉴定并测序。
1.2.5 目的蛋白诱导表达及Western blot鉴定 将pET-28a-E0转化至E.coliBL21(DE3)感受态细胞中,12 h后挑斑摇菌。取活化的菌液按1∶100的比例接种到新的培养基中,待其OD值达到0.6~0.8之间,加入1.0 mmol/L IPTG,在37 ℃摇床中培养4 h。4 h后收集菌液,离心收集沉淀,加入裂解液冰浴裂解30 min,加入蛋白上样液煮样10 min。将处理后的样品进行聚丙烯酰胺凝胶电泳(SDS-PAGE),将目的蛋白湿转移至PVDF膜上,加封闭液室温封闭1 h。用封闭液1∶5000稀释感染BVDV阳性血清反应1 h,洗膜3次,每次20 min。用封闭液1∶5000稀释二抗(兔抗牛IgG)反应1 h,洗膜3次,每次20 min。加TWB显色液暗室显色3 min。
1.2.6 BVDV E0基因序列分析 从GenBank中找出20株牛病毒性腹泻病毒(BVDV)E0基因序列,3株边界病病毒(BDV)E0基因序列,6株猪瘟病毒(CSFV)E0基因序列,应用DNAstar中Clustal W Method和MEGA 5软件对E0基因的核苷酸序列与上述已知序列进行同源性分析与比较,绘制系统发育进化树并分析。
1.2.7 BVDV E0蛋白抗原表位的预测 使用DNAstar分析软件,来分析E0蛋白B细胞抗原表位和潜在优势T细胞抗原表位。使用Gamier-Robso对E0蛋白的二级结构进行预测,包括α-螺旋、β-折叠、β-转角和无规卷曲。预测E0蛋白质骨架的柔韧性、蛋白表面可及性和蛋白的抗原性分析分别应用了Karplus-Schulz方法、和Emini方法和Jameson-wolf方法。综合蛋白质的二级结构、亲水性、蛋白骨架的柔韧性以及蛋白的抗原性,以此预测E0蛋白的B细胞抗原表位。
在DNAstar中,用AMPHI法和Rothbard-Taylor方法综合性预测E0蛋白潜在的优势T细胞抗原表位。
2 结果与分析
2.1 E0基因扩增及测序
以RNA为模板,通过RT-PCR扩增,1 %琼脂糖凝胶电泳得到大约675 bp的目的条带(图1),将EO基因克隆至pMD18-T中,进行测序。测序结果显示,BVDV E0基因序列全长为675 bp(图2)。

M.Marker:DL2000; 1. E0基因; 2. 阴性对照M.Marker:DL2000; 1. E0 gene; 2. Negative control图1 E0基因的克隆Fig.1 E0 gene cloning
2.2 pET-28a-E0表达载体的构建及鉴定
通过双酶切、单酶切和PCR鉴定,得675 bp目的条带与预期结果相符(图3),表明已成功构建了pET-28a-E0的原核表达载体。
2.3 SDS-PAGE和Western blot鉴定结果
将pET-28a-E0转化至E.coliBL21(DE3)感受态细胞中,加入1.0 mmol/L IPTG、在37 ℃摇床中诱导4 h后收集菌液,离心收集细胞。加入裂解液冰浴裂解30 min,离心取上清,制成SDS样品。对pET-28a-E0质粒表达得到的融合蛋白进行Western blot鉴定,加入TWB显色后在相对分子质量大约27 ku位置有目标条带(图4)。
2.4 E0基因系统发育进化树
根据GenBank中已经公布的序列中,找出20株BVDV E0基因序列(序列号:U86600、U86599、AF091605、AF268278、AF002227、AB078952、AB078950、M96687、AY149216、AJ585412、M96751、AF502399、AF526381、DQ088995、EF101530、AY149215、FJ527854、GQ888686、AB567658、U63479),3株BDV E0基因序列(序列号:GU270877、AF037405、U70263),6株CSFV E0基因序列(序列号:X87939、X96550、U90951、U45478、U45477、NC_002657)。使用生物信息学软件DNAstar中Clustal W Method和MEGA 5中的Neighbor-Joining程序对上述30株E0基因序列进行同源性分析,同源性分析结果如图5所示,构建的系统发育进化树如图6所示(重复次数为1000)。

图2 BVDV GSTZ E0基因序列全长和氨基酸序列Fig.2 BVDV GSTZ E0 gene sequence and amino acid sequence
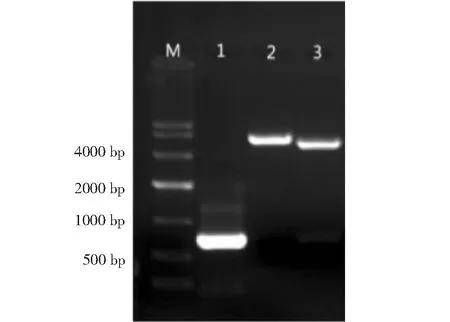
M.Marker DL10000; 1.重组质粒 PCR; 2.重组质粒用 BamH I酶切; 3.重组质粒用 BamH I、XhoI酶切M.Marker DL10000; 1.Amplification products of recombinant plamid; 2.Recombinant plamid digested with BamH I; 3.Recombinant plamid digested with BamH I and XhoI图3 重组质粒鉴定Fig.3 Identification of recombinant plamid by enzyme digestion

M. Marker; 1.pET-28a-E0上清; 2.阴性对照M. Marker; 1.pET-28a-E0 supernatant; 2.Negative control图4 Western blotFig.4 Western blot
同源性分析结果显示,GSTZ株与SD-1株、Singer_Arg株、NS3株和C24V序列相似性分别为85.9 %、87.1 %、85.5 %和85.3 %;BDV和CSFV与BVDV同属于黄病毒科、瘟病毒属,三者比较发现E0基因序列的同源性均相对较低。在进化树中显示与GSTZ株进化关系较近SD-1株和C24V株属于牛病毒性腹泻病毒-1a亚型,Osloss株和VEDEVAC株属于牛病毒性腹泻病毒-1b亚型;与GSTZ株进化关系较远的ZM-95则属于牛病毒性腹泻病毒-1f亚型。由此可以推断出牛病毒性腹泻病毒GSTZ株基因型可能属于牛病毒性腹泻病毒-1a亚型,也可能是其他基因亚型发生较大突变产生变异。

图5 E0基因的同源性分析Fig.5 E0 gene homology analysis

图6 E0基因的系统发育进化树Fig.6 Phylogenetic tree of E0 gene
图5显示,牛病毒性腹泻病毒(BVDV)、边界病病毒(BDV)和猪瘟病毒(CSFV)同属于黄病毒科瘟病毒属,但是从进化树中可看出,三者彼此之间进化关系较远。

图7 E0蛋白二级结构预测结果Fig.7 Prediction results of E0 protein secondary structure
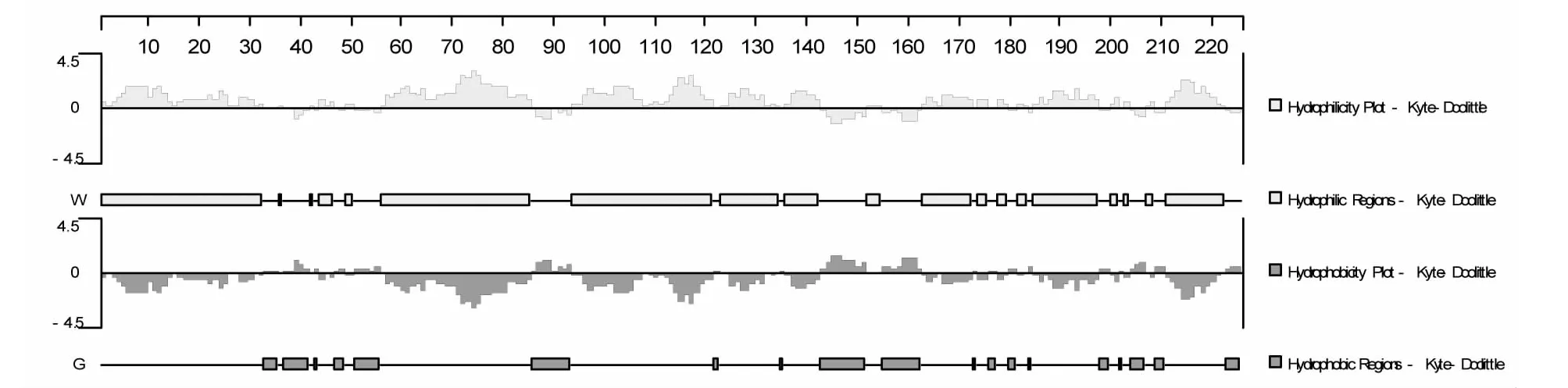
图8 E0蛋白亲水性和疏水性预测结果Fig.8 Prediction of hydrophilicity and hydrophobicity of E0 protein

图9 E0蛋白质骨架柔韧性分析结果Fig.9 E0 protein framework flexibility analysis results
2.5 E0蛋白抗原表位的预测
2.5.1 E0蛋白二级结构预测 蛋白质的二级结构中,只有β-转角和无规卷曲呈现凸出状,具有柔韧性,可发生变形,较多出现在蛋白表面,有利于与抗体相结合,因此存在较大可能为抗原表位。与之相反的是,α-螺旋和β-折叠结构规则不易发生变形,一般不作为抗原表位。所以,本实验重点预测β-转角和无规卷曲。β-转角在:21-22、29-30、36-37、62-65、73-82、101-102、115-119、127-128、136-140、149-150、215-219位氨基酸残基,共有41氨基酸。无规卷曲在:6-12、23-24、26-28、40-41、85-86、94-97、103-104、151-152、185-187、224-225位氨基酸残基,共有29个氨基酸(图7)。
2.5.2 E0蛋白亲水性和疏水性预测 E0蛋白的亲水区主要位于:1-32、44-46、49-50、56-85、94-121、123-134、136-142、152-154、163-172、174-175、178-179、182-183、185-197、200-201、207-208、211-222位氨基酸残基,共有162个氨基酸(图8)。
2.5.3 E0蛋白质骨架柔韧性分析 E0蛋白质骨架柔韧性区域主要位于:7-15、22-26、32-34、38-41、59-63、94-106、115-120、125-141、151-152、174-175、183-200、203-204、210-219位氨基酸残基,共有96个氨基酸(图9)。
2.5.4 E0蛋白表面可及性分析 E0蛋白表面可及性区域主要位于:4-10、17-18、22-23、47-48、58-63、70-76、83-85、93-98、100-105、113-118、125-130、138-140、167-168、175-176、186-187、189-194、211-218位氨基酸残基,共有76个氨基酸(图10)。
2.5.5 E0蛋白抗原性分析E0蛋白含有的抗原性区域主要位于:5-15、18-27、35-37、40-41、45-51、57-65、68-82、93-110、112-120、125-132、134-142、151-154、158-159、162-172、184-197、209-219位氨基酸残基,共有143个氨基酸(图11)。
2.5.6 E0蛋白B细胞抗原表位分析 根据上述结果中对E0蛋白二级结构、亲水性、蛋白骨架的柔韧性以及蛋白的抗原性的预测,得出E0蛋白B细胞的抗原表位主要位于:7-12、22-26、62-63、94-97、101-105、115-119、127-128、138-140、185-187、215-219位氨基酸残基,共有40个氨基酸,占整个氨基酸序列的17.6 %(图12)。
2.5.7 E0蛋白T细胞抗原表位分析 使用AMPHI法和Rothbard-Taylor方法分析得出E0蛋白T细胞潜在优势抗原区域主要位于:10-14、19-31、36-43、52-58、77-86、96-98、137-140、148-150、167-191、209-211位氨基酸残基,共有51个氨基酸,占全部氨基酸序列的22.5 %。
3 讨 论
E0蛋白是一种高度糖基化的蛋白,其与病毒粒子相关,而且E0可由被BVDV感染的细胞以可溶性蛋白的方式分泌出细胞外[7]。E0蛋白通过C末端的两亲性螺旋松散地附着在病毒颗粒的表面,这种弱相互作用允许E0从病毒颗粒解离[8]。E0还具有一个独特的特征——RNase活性,该功能在先天免疫应答中有重要作用[9]。

图10 E0蛋白表面可及性分析结果Fig.10 Analysis of surface accessibility of E0 protein
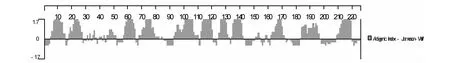
图11 E0蛋白抗原性分析结果Fig.11 Antigenic analysis results of E0 protein
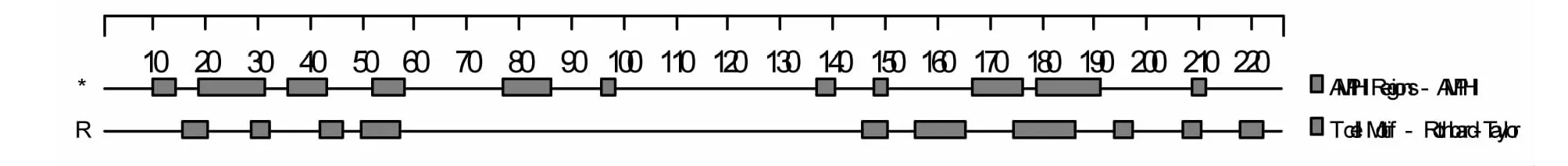
图12 E0蛋白T细胞抗原表位预测结果Fig.12 E0 protein T cell epitope prediction results
当前,对牛病毒性腹泻病毒(BVDV)疫苗的研制我国还相对滞后,但是随着BVDV疫情不同程度的爆发,给牧民带来严重的经济损失。因此,有必要研究BVDV疫苗,以保护农牧民的利益不受损害,进一步保护食品安全。在先前的研究中发现,E0能中和BVDV和HCV(丙型肝炎病毒)。
本研究中,根据DNAstar软件预测到,整个E0序列二级结构中β-转角区域共有41氨基酸,占全部氨基酸序列的18.1 %。无规卷曲共有29个氨基酸,占全部氨基酸序列的12.8 %。经预测,其亲水区域共有162个氨基酸,占全部氨基酸序列的71.4 %,表面可及性区域包括76个氨基酸,占全部的33.5 %。通过抗原性分析,其抗原性区域主要在5-15、18-27、35-37、40-41、45-51、57-65、68-82、93-110、112-120、125-132、134-142、151-154、158-159、162-172、184-197、209-219位氨基酸残基,共有143个氨基酸,占全部氨基酸的63.0 %。综合上述全部分析结果,预测E0蛋白B细胞的抗原表位主要位于:7-12、22-26、62-63、94-97、101-105、115-119、127-128、138-140、185-187、215-219位氨基酸残基,共有40个氨基酸,占整个氨基酸序列的17.6 %。E0蛋白T细胞潜在优势抗原区域主要位于:10-14、19-31、36-43、52-58、77-86、96-98、137-140、148-150、167-191、209-211位氨基酸残基,共有51个氨基酸,占全部氨基酸序列的22.5 %。根据预测结果分析,预测的B细胞抗原表位和T细胞潜在优势的抗原区域分别占整个氨基酸的17.6 %和22.5 %,说明E0是一个B细胞抗原表位和T细胞抗原表位相差无几的蛋白抗原,可更好利用此特性,为后续对BVDV检测试剂盒的开发奠定一定的基础。
本研究利用原核表达载体pET-28a在大肠杆菌中成功表达了E0蛋白,并且在实验中对E0蛋白表达的温度、IPTG浓度和诱导时间分别进行了优化,优化后的温度为37 ℃、IPTG浓度为1.0 mmol/L,诱导时间为4 h时,蛋白的表达量最高。在试验中所使用的一抗为BVDV阳性血清,二抗为兔抗牛抗体,在western blot结果中显示蛋白的分子质量约为27 ku,使用BVDV阳性血清作为一抗,说明E0具有良好的抗原性,在蛋白后期的纯化以及使用E0蛋白来制备疫苗提供了很好的基础。
随着生物信息学和分子病毒学的不断发展和完善,病毒的分类也在不断的变化和发展。目前,BVDV的主要分类方式是由vilcek等在2001年根据BVDV 的5′-UTR和NPRO将BVDV分为了11个基因亚型[10]。根据同源性分析得出GSTZ株与SD-1株、Singer_Arg株、NS3株和C24V序列相似性较高,均高于85 %;相比较与BVDV同属的BDV和CSFV,E0基因序列的同源性均相对较低,如图5中所示,GSTZ与H2121和CAP的E0序列的同源性分别为69.5 %和68.6 %。根据系统发育进化树中的进化关系的远近,可以看出GSTZ株与SD-1株、Singer_Arg株、NS3株和C24V关系较近,与ZM-95、Osloss、VEDEVAC等株距离较远。综合同源性分析以及系统发育进化树可以推断出牛病毒性腹泻病毒GSTZ株基因型可能属于牛病毒性腹泻病毒-1a亚型,也可能是其他基因亚型发生较大突变产生变异。
4 结 论
本研究中通过原核表达E0蛋白大小与预期结果相符且该蛋白具有良好的抗原性。基因序列的同源性分析以及构建E0基因系统发育进化树表明牛病毒性腹泻病毒GSTZ株基因型可能属于BVDV-1a亚型,也可能是其他基因亚型发生较大突变产生变异。使用DNAstar预测E0蛋白B细胞的抗原表位主要位于:7-12、22-26、62-63、94-97、101-105、115-119、127-128、138-140、185-187、215-219位氨基酸残基;T细胞潜在优势抗原区域主要位于:10-14、19-31、36-43、52-58、77-86、96-98、137-140、148-150、167-191、209-211位氨基酸残基。整个研究表明E0蛋白具有良好的抗原性,通过对抗原表位预测以及对GSTZ进行基因分型,为后续基因工程疫苗和BVDV检测试剂盒的开发提供了理论依据。
