黑曲霉固态发酵改善茶渣营养价值的研究
2018-10-17范彩云张子军刘政权宛晓春程建波
朱 飞 苏 娣 冉 雷 范彩云 张子军 刘政权 宛晓春* 程建波*
(1.安徽农业大学动物科技学院,合肥230036;2.安徽农业大学茶树生物学与资源利用国家重点实验室,合肥230036)
茶渣是茶饮料、速溶茶和茶单宁(TTN)产业等加工茶叶后产生的残渣,据统计,仅茶饮料和速溶茶公司每年产生的茶渣就高达16万t。研究报道,茶渣的粗蛋白质(CP)含量为26%~35%,是一种良好的蛋白质饲料资源[1],但茶渣中的TTN是一种具有涩味的抗营养因子,会抑制动物对饲料的摄入[2],其含有的酚羟基能螯合饲料中的铁、铜和锌等金属元素以及蛋白质,形成大分子金属-单宁和蛋白质-单宁螯合物,降低肠道对金属元素和氮的吸收利用率[3-4],TTN还能以非竞争性方式抑制胰α-淀粉酶的活性,从而影响动物对淀粉的消化吸收[5]。除此之外,机体吸收单宁后还会引起肝毒性和肾毒性,对于反刍动物而言,TTN不仅可以与瘤胃微生物细胞外酶反应,还能与微生物细胞壁结合,使微生物失去生长所需的底物,并抑制氧化磷酸化和电子传递,从而破坏瘤胃微生物区系稳态[4]。这些因素均限制了茶渣在动物饲料中的广泛应用,通常被当作工业废料丢弃,造成资源的巨大浪费。预计到2020年,我国蛋白质饲料资源缺口将达到4 800万t,在此窘境下,科学工作者开始关注糟渣类饲料资源的开发与利用,并获得了较高质量的生物饲料资源。目前,我国对茶渣的利用主要集中在功能性成分提取[6]、栽培食用菌[7]和制备有机肥[8]等方面,国外则注重在环境治理中的应用,例如使用茶渣去除废水中重金属离子[9]和有机污染物[10]以及吸附有害气体[11]等,但将茶渣饲料化的研究并不多见。
黑曲霉(Aspergillusniger,AN)作为一种大型真菌,具有生长旺盛、发酵周期短且不产生毒素等特点,是美国食品药品监督管理局(FDA)认证的安全菌种之一,可分泌淀粉酶、纤维素酶、植酸酶等酶类[12],部分AN还可分泌单宁酶[13-14]。本试验以AN为发酵菌种,期望利用AN产生的单宁酶和纤维素酶降解TTN和纤维素,在降低茶渣中TTN含量的同时有效提高CP含量,缓解茶渣的饲喂限制因素,开发出一种优质蛋白质饲料资源,这将为开发利用茶渣饲料资源探索出一条新途径,有效解决废弃茶渣对环境造成的巨大压力和缓解人畜争粮的尖锐矛盾,具有重要的研究价值和良好的应用前景。
1 材料与方法
1.1 材料
1.1.1 试验原料
茶渣:由浙江铭皇生物科技有限公司提供,TTN含量为13.30%,CP含量为32.30%。玉米粉:市场购买,CP含量为6.65%。
1.1.2 发酵菌种及培养基
AN由中国工业微生物菌种保藏管理中心(CICC)保藏,编号为41125。AN所用培养基为察氏培养基。
1.2 方法
1.2.1 AN的活化及孢子液的制备
将AN冻干粉溶于液体培养基,再涂布到固体培养基上,于33 ℃恒温培养箱中培养至培养基表面铺满孢子,用液体培养基冲洗孢子获得AN孢子悬液,用灭菌擦镜纸过滤后于4 ℃保存备用。
1.2.2 接种量的计算
在将AN孢子悬液接入茶渣发酵培养基进行发酵之前,用血球计数板法调节AN孢子悬液浓度为1.25×107个/mL,接种量以每克发酵底物干重所接种的孢子量表示,茶渣发酵培养基的含水量包含接入的菌液。
1.2.3 茶渣发酵培养基的制备
按比例将茶渣和玉米粉(共50 g)在500 mL锥形瓶中混匀,然后倒入含有一定体积孢子悬液的纯水,用玻璃棒搅拌均匀后以8层无菌纱布封口。
1.3 单因素优化发酵条件试验
在自然pH的条件下,考察玉米粉含量、料水比(m/V)、接种量、发酵温度和发酵时间对发酵效果的影响。以TTN和CP含量为测定指标,筛选出发酵效果较好的单因素水平,以此进行后一个单因素试验研究,每个水平3个重复。
1.3.1 玉米粉含量对发酵效果的影响
设置玉米粉含量分别为0、5%、10%、15%和20%,料水比为1.0∶1.0、接种量为1.50×106个/g、发酵温度为30 ℃、发酵时间为4 d。
1.3.2 料水比对发酵效果的影响
在1.3.1确定的玉米粉含量下,设置料水比分别为1.0∶0.8、1.0∶1.0、1.0∶1.2、1.0∶1.4和1.0∶1.6,其他条件同1.3.1。
1.3.3 接种量对发酵效果的影响
在1.3.2确定的料水比下,设置接种量分别为1.25×105、2.50×105、5.00×105、1.00×106和1.50×106个/g,其他条件同1.3.2。
1.3.4 发酵温度对发酵效果的影响
在1.3.3确定的接种量下,设置恒温培养箱的温度分别为21、24、27、30、33、36和39 ℃,其他条件同1.3.3。
1.3.5 发酵时间对发酵效果的影响
在1.3.4确定的发酵温度下,设置发酵时间分别为2、3、4、5、6、7、8和9 d,其他条件同1.3.4。
1.4 正交优化发酵条件试验
以TTN和CP含量为测定指标,在单因素试验的基础上,选择料水比、接种量、发酵温度和发酵时间4个因素进行L9(34)正交试验(表1),以优化发酵条件。
1.5 指标测定
发酵产物105 ℃烘干,粉碎后过40目筛。CP、粗脂肪(EE)、粗灰分(Ash)、钙(Ca)和磷(P)含量的测定参照张丽英[15]的方法;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量的测定参照Van Soest等[16]的方法;TTN含量的测定参照GB/T 8313—2002[17]的方法,真蛋白质(TP)含量的测定参照胡艳丽等[18]的方法,氨基酸(AA)含量采用氨基酸自动分析仪(日立L-8900)测定。

表1 L9(34)正交试验设计
1.6 数据统计与分析
试验数据用Excel 2007进行预处理,然后采用SAS 9.2进行统计分析。单因素试验数据进行单因素方差分析,再结合Duncan氏法进行多重比较;正交试验数据进行极差分析。P<0.05表示差异显著,结果以平均值±标准差表示。
2 结果与分析
2.1 单因素优化发酵条件试验结果
2.1.1 玉米粉含量对发酵效果的影响
由表2可知,当玉米粉含量为5%时,TTN含量降至最低,为2.17%,显著低于其他玉米含量组(P<0.05),同时TTN降解率最高,为81.34%,之后TTN降解率随着玉米粉含量的增多而逐渐降低;CP含量随着玉米粉含量的增多而逐渐降低,但CP增长率逐渐升高,说明玉米粉过量添加有利于CP含量的提高,但是不利于AN对TTN的降解。综合考虑,选择在茶渣中添加5%的玉米粉作为最适发酵培养基组成。
2.1.2 料水比对发酵效果的影响
由表3可知,TTN含量随着培养基水分含量的增多而呈现出先下降后上升的趋势,当料水比为1.0∶1.4时,TTN含量降至最低,为2.74%,显著低于其他组(P<0.05);料水比在1.0∶(1.2~1.6)时,CP含量差异不显著(P>0.05),但均显著高于料水比为1.0∶0.8时(P<0.05),当料水比为1.0∶1.4时,CP含量达到最高,为37.94%。综合考虑TTN和CP含量以及发酵产物的烘干成本,选择1.0∶1.4为最佳料水比。

表2 玉米粉含量对茶渣营养价值的影响(干物质基础)
降解率(%)=100×(对照组-发酵组)/对照组;增长率或提高率(%)=100×(发酵组-对照组)/对照组。表8和表9同。
同列数据肩标不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。
Degradation rate (%)=100×(control group-fermentation group)/control group; increase rate or improvement rate (%)=100×(fermentation group-control group)/control group. The same as Table 8 and Table 9.
In the same column, values with different small letter superscripts mean significant difference (P<0.05), while with the same letter superscripts mean no significant difference (P>0.05).
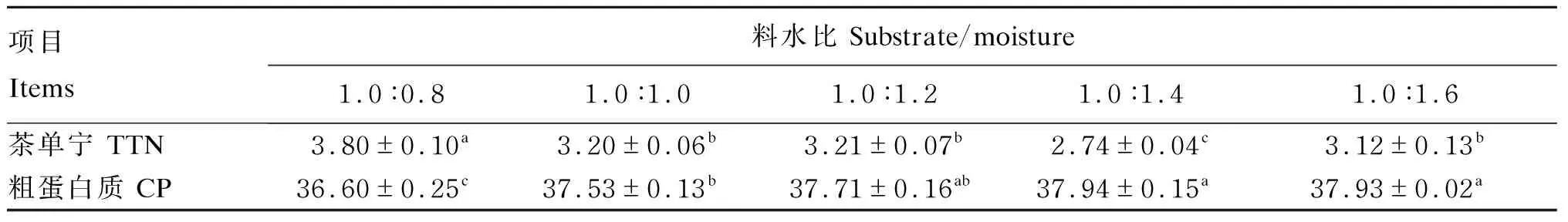
表3 料水比对茶渣营养价值的影响(干物质基础)
同行数据肩标不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。表4至表6同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same letter superscripts mean no significant difference (P>0.05). The same as Table 4 to Table 6.
2.1.3 接种量对发酵效果的影响
由表4可知,接种量为5.00×105和1.00×106个/g时TTN含量相对较低,其中5.00×105个/g组的TTN含量为3.75%,显著低于除1.00×106个/g组外的其他各组(P<0.05);CP含量随着接种量的增加而升高,当接种量为1.00×106个/g时,CP含量达到最高,为37.88%。5.00×105个/g组和1.00×106个/g组的TTN含量差异不显著(P>0.05),且1.00×106个/g组的CP含量显著高于5.00×105个/g组(P<0.05)。综合考虑,选择1.00×106个/g的接种量为最佳接种量。
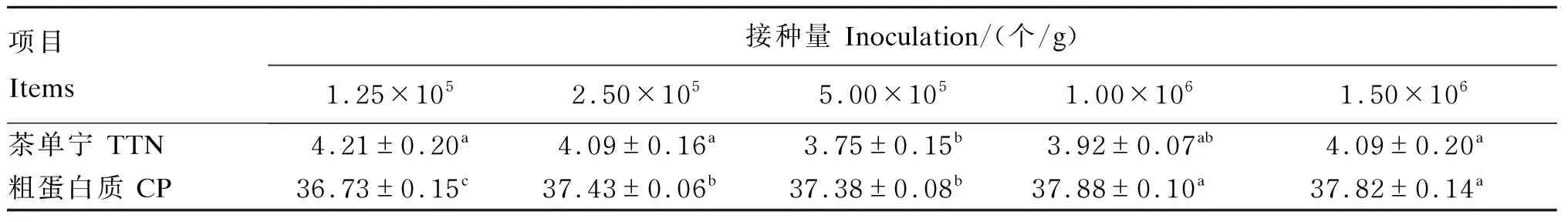
表4 接种量对茶渣营养价值的影响(干物质基础)
2.1.4 发酵温度对发酵效果的影响
由表5可知,TTN含量随着发酵温度的升高而逐渐降低,在36 ℃时达到最佳,仅为2.96%,显著低于其他温度组(P<0.05);CP含量则与发酵温度呈正相关,当发酵温度在36~39 ℃时,CP含量显著高于其他温度组(P<0.05),并在36 ℃时达到最高,为38.50%。因此,选择36 ℃为最佳发酵温度。
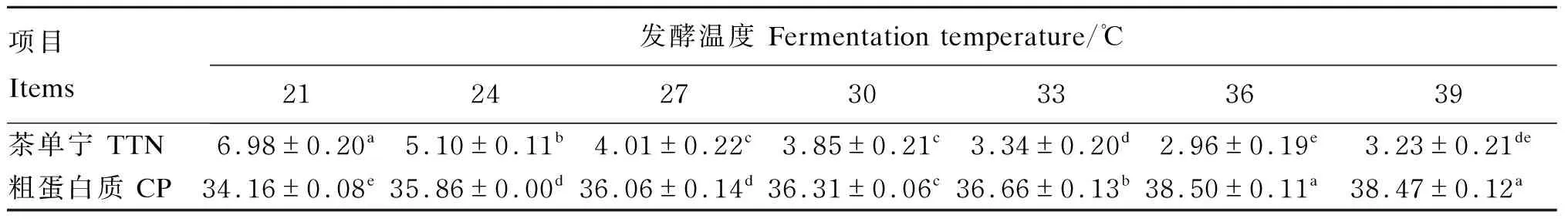
表5 发酵温度对茶渣营养价值的影响(干物质基础)
2.1.5 发酵时间对发酵效果的影响
由表6可知,TTN含量随着发酵时间的延长而逐渐降低,发酵时间为8、9 d时的TTN含量分别为1.81%、1.84%,显著低于其他时间组(P<0.05);CP含量随着发酵时间的延长而逐渐升高,发酵时间为7、8 d时的CP含量分别为43.28%和43.21%,显著高于其他时间组(P<0.05)。综合考虑TTN和CP含量以及发酵成本,最终确定8 d为最佳发酵时间。
2.2 正交优化发酵条件试验结果
由极差分析(表7)可知,各因素TTN降解产生影响的顺序为C>D>B>A,即影响茶渣发酵降解TTN的因素依次为发酵温度、发酵时间、接种量、料水比。由TTN含量的K值可得最佳组合为A3B2C3D2,即料水比1.0∶1.5、接种量1.00×106个/g、发酵温度37 ℃、发酵时间8 d。由极差分析(表7)可知,各因素对CP含量产生影响的顺序为C>A>D>B,即影响茶渣发酵提高CP含量的因素依次为发酵温度、料水比、发酵时间、接种量。由CP含量的K值可知,提高CP含量的最佳组合为A2B3C3D2,即料水比1.0∶1.4、接种量1.25×106个/g、发酵温度37 ℃、发酵时间8 d。
结合单因素试验结果得出,茶渣发酵的最佳组合为A2B2C3D2,即料水比1.0∶1.4、接种量1.00×106个/g、发酵温度37 ℃、发酵时间8 d。

表6 发酵时间对茶渣营养价值的影响(干物质基础)
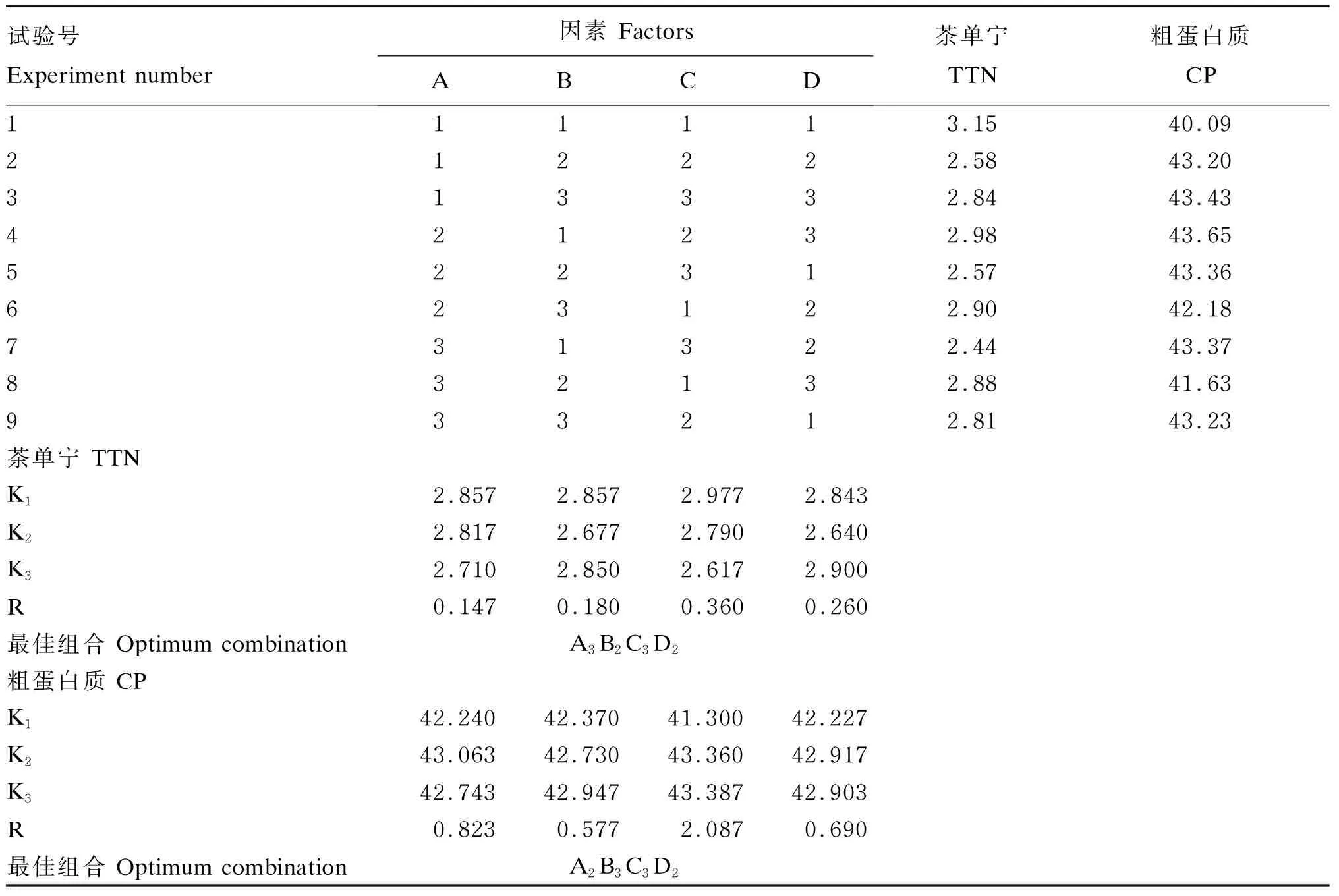
表7 正交试验结果的极差分析表(干物质基础)
K1、K2、K3分别代表结果在水平1、2、3下的平均值。R代表K1、K2、K3在各因素下的极差。
K1, K2and K3stand for the mean value of the results under levels 1, 2 and 3, respectively. R stands for the range of K1, K2and K3under each factor.
2.3 正交试验发酵产物营养价值分析
采用最佳发酵工艺参数,获得最佳发酵产物,茶渣发酵前后营养价值和AA含量变化分别见表8和表9。
由表8可知,AN发酵可有效提高茶渣的营养价值。与对照组相比,经AN发酵后茶渣的CP含量由31.22%提高到44.56%(P<0.05),TP含量由23.64%提高到36.99%(P<0.05),TTN含量由11.63%降低到2.42%(P<0.05),NDF含量由39.85%降低到32.96%(P<0.05),ADF含量由15.70%降低到12.28%(P<0.05),EE含量由4.06%提高到5.13%(P<0.05),Ash含量由4.09%提高到6.09%(P<0.05),Ca含量由0.75%提高到1.10%(P<0.05),P含量由0.32%提高到0.47%(P<0.05)。
由表9可知,与对照组相比,经AN发酵后茶渣中17种AA的含量均显著提高(P<0.05),且总AA含量由18.45%提高到23.38%,提高率为26.72%。必需AA中的缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸、甲硫氨酸、苏氨酸和赖氨酸的提高率分别为42.01%、25.27%、22.50%、26.20%、30.00%、31.20%和24.62%,其中缬氨酸提高率位居17种AA提高率的榜首。
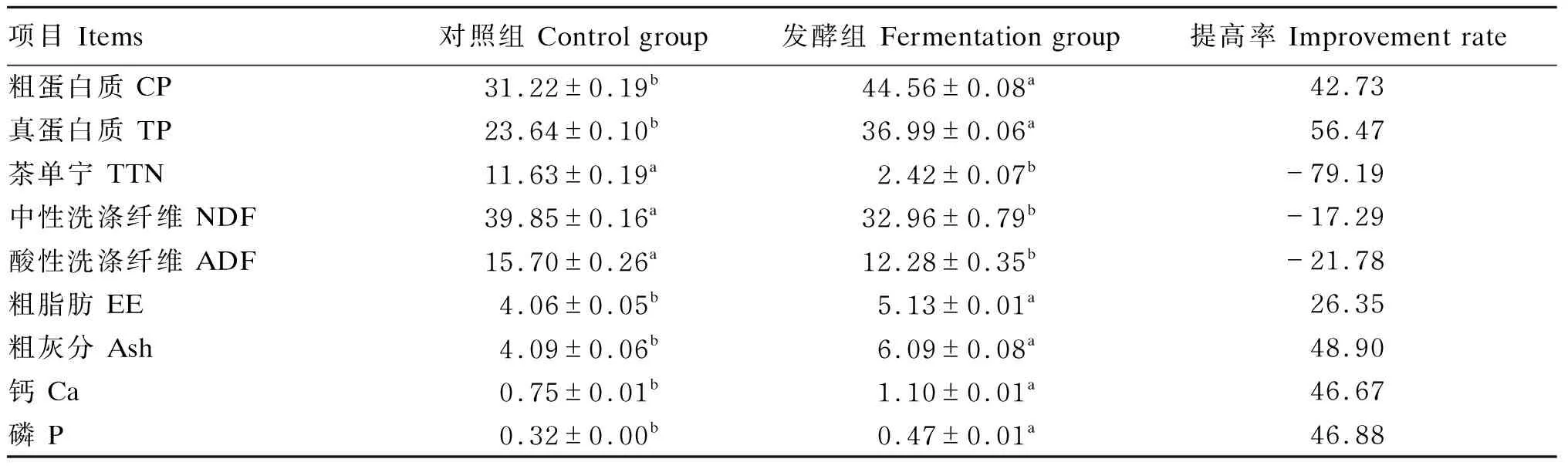
表8 茶渣发酵前后营养价值变化(干物质基础)
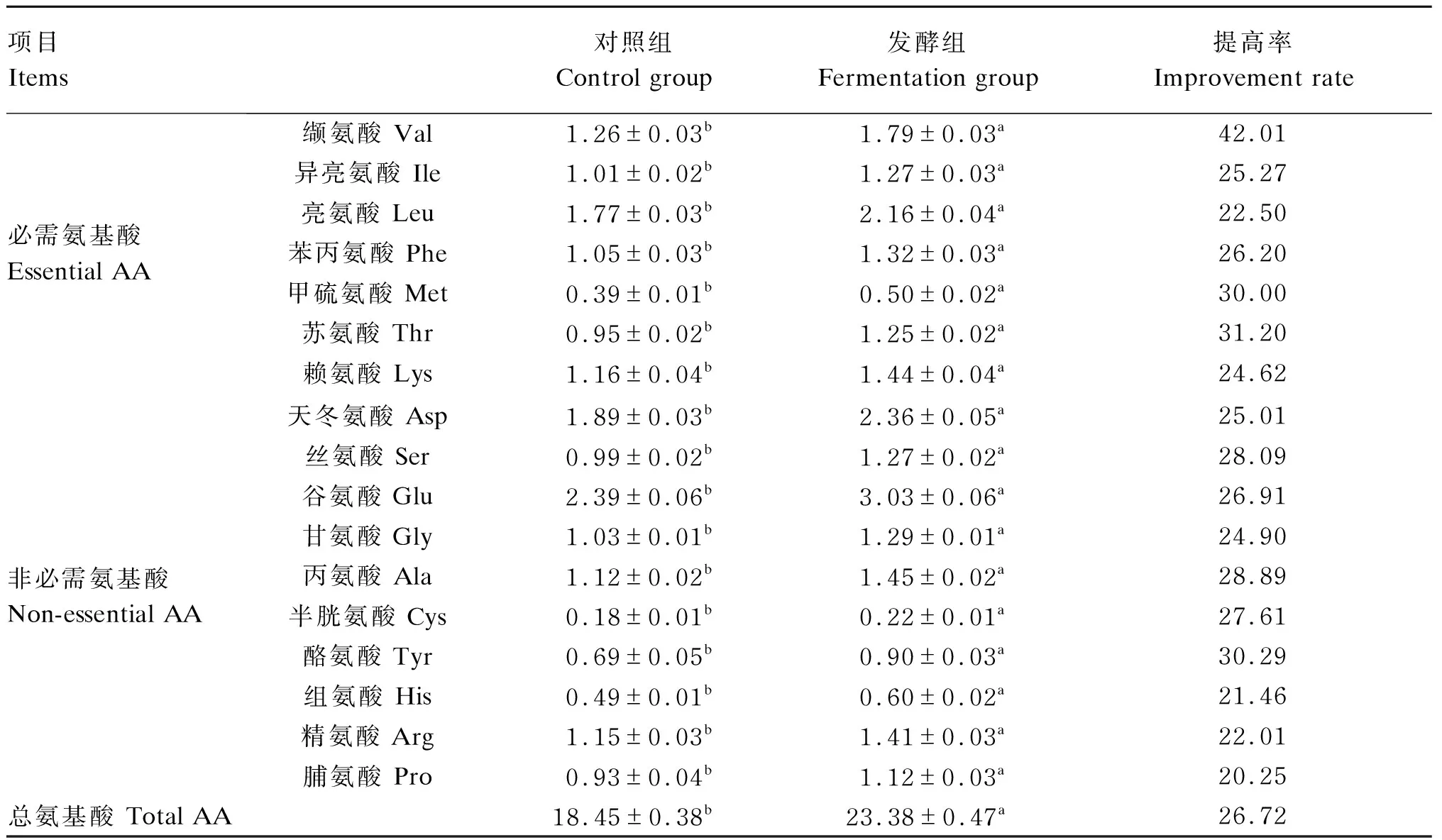
表9 茶渣发酵前后AA含量变化(干物质基础)
3 讨 论
研究表明,菌种、培养基组成、料水比和原料粒度、发酵温度、菌液接种量和发酵时间等因素会影响发酵进程[19]。对于固态发酵而言,水分和原料粒度影响着好氧发酵的气体交换过程。适宜的水分和原料粒度能够保证发酵基质深层微生物对氧气的需求,疏松多孔的基质状态还能使得微生物的代谢废物及时排出,基质内部的养分也可随着自由水通过原料间隙扩散到基质表面,满足基质表面微生物对营养的需求,有利于微生物正常繁殖并保持高产酶活性状态[20]。此外,水能够溶解发酵产生的氨态氮和蛋白质分解物,并能与蛋白质的正电荷或者负电荷相互作用,增强蛋白质的稳定性[21],从而减少氮损失,提高CP含量。本试验发现1.0∶1.4的料水比可使TTN含量降为最低,间接表明在此料水比下单宁酶产量最高。Yee等[22]研究原料粒度和含水量对AN发酵树皮生产单宁酶的影响,结果发现1.0∶1.5的初始料水比可获得最佳单宁酶产量,此结果与本试验所得最佳料水比相似。Mahdi等[23]发现AN Ass19发酵麸皮时最大单宁酶产量对应的料水比为1∶3,高于本试验结果,可能的原因是AN类型和发酵底物以及底物初始含水率与本试验不同。
温度极易影响菌体中核酸与蛋白质等重要成分的生理功能,过低的温度会抑制微生物体内酶的活性,降低繁殖效率,过高的温度则会损伤菌体内蛋白质的高级结构,可能直接杀死微生物[24]。另外,AN等真菌的适宜生长温度较为宽泛,一般在20~55 ℃的温度范围内都可以生存,但不同温度下真菌的产酶能力和产酶种类会有所不同,因此需要根据试验目的选择合适的发酵温度[25]。本试验的目的是利用AN产单宁酶,进而降解茶渣中的TTN,研究发现36 ℃时TTN含量降为最低且CP含量最高,表明此温度下单宁酶产量最佳且AN生长菌丝最多。汤小朋[25]发现AN发酵木薯渣时羧甲基纤维素酶活性和CP含量在36 ℃时为最高,与本试验结果一致,说明羧甲基纤维素酶在36 ℃时具有最大产量,这可能也是本试验中茶渣发酵后ADF和NDF含量降低的原因。Aboubakr等[26]将AN的发酵温度从30 ℃提高到35 ℃,发现单宁酶活性从6.100 U/mL提升到6.254 U/mL,说明35 ℃更有利于AN产单宁酶,与本试验所得最佳发酵温度接近。
微生物的接种量和发酵时间会影响发酵工业的经济效益。较低的接种量不仅会减缓发酵进程,增加杂菌污染的概率,还会延长发酵时间,增加发酵成本;过高的接种量虽然能够降低杂菌污染的可能性,但微生物在短时间内会大量扩增繁殖,在造成底物中代谢副产物过量积聚,反馈抑制微生物的生长速度与产酶能力的同时还会引起培养基消耗过快且黏度增加,不利于氧的扩散,反而加速细胞凋亡,影响产物的合成和降低发酵效率[24]。因此,必须选择合适的接种量,以使微生物既能抵抗杂菌污染,正常繁殖、产酶,还能缩短发酵时间,从而提高发酵效益。本试验发现AN发酵茶渣的最优接种量为1.00×106个/g,与赵华等[27]研究得出的AN发酵甘薯渣的最佳接种量一致,但其发酵时间要短于本试验所得最佳发酵时间,可能是由于甘薯渣的营养价值要远低于茶渣,微生物的生长提前结束。Wang等[28]利用AN发酵茶梗获取单宁酶,其最佳接种量为4×107个/g,菌种类型、发酵温度以及底物组成不同可能是导致其所得最佳接种量是本试验所得最佳接种量40倍的原因。
本试验中,茶渣经过AN发酵后,NDF和ADF含量分别降低了17.29%和21.78%,与张玉诚[29]研究白酒糟发酵和唐庆凤等[30]研究木薯渣发酵的结果相似;Ash、Ca和P含量分别提高了48.90%、46.67%和46.88%,与汤小朋[25]和张玉诚[29]的研究结果相似;EE含量提高了26.35%,与汤小朋[25]的研究结果变化趋势一致;TP含量提高了56.47%,与张玉诚[29]的研究结果相似。AN在利用茶渣和玉米粉中的碳源、氮源及其他营养因子进行自身生长与代谢的过程中,也能产生纤维素酶和淀粉酶等酶类,将纤维素、淀粉等碳水化合物分解为二氧化碳和水,二氧化碳和部分水分逸散,其余水分和氮源将被微生物利用合成菌体蛋白,这样就使得原料中的NDF、ADF和DM含量降低,CP、TP、EE、Ash、Ca和P含量相应升高,但茶渣和玉米粉的营养价值绝对含量保持不变或者略有降低。本试验中17种AA在茶渣和发酵茶渣中均有分布,但茶渣经AN发酵后,17种AA含量均显著提高,且必需AA中的缬氨酸提高率最高,说明经微生物发酵后,发酵产物的AA含量会有所增加,这与欧荣娣[24]和张玉诚[29]的结果相似。茶渣经AN发酵后EE含量提高的另一个可能原因是AN将碳水化合物转化为脂肪[25]。总体而言,AN在发酵茶渣的过程中会降解TTN,同时积累大量菌体蛋白和代谢产物,从而提高茶渣的营养价值。
4 结 论
① 以AN发酵茶渣,最佳工艺为玉米粉含量5%、料水比1.0∶1.4、接种量1.00×106个/g、发酵温度37 ℃、发酵时间8 d、自然pH。
② 在最佳发酵工艺下经AN发酵后,茶渣的CP、TP、EE、Ash、Ca、P和17种AA含量显著提高,TTN、NDF和ADF含量显著下降。
