热碱法提取异养小球藻蛋白质工艺优化
2018-10-17胡守珍毕生雷黄丽丽邹婷婷郭乐乐杨迪张乃群
胡守珍,毕生雷,黄丽丽,邹婷婷,郭乐乐,杨迪,张乃群*
1 (南阳师范学院 生命科学与技术学院,河南 南阳,473061) 2 (河南天冠企业集团有限公司车用生物燃料技术国家重点实验室,河南 南阳,473000)
小球藻(Chlorella)属绿藻门,绿藻纲,绿藻目,卵胞藻科,小球藻属[1],有自养、异养、兼养3种培养方式[2-3]。小球藻在生产油脂的同时还能产生如蛋白质、小球藻生长因子、色素、多不饱和脂肪酸等高附加值产物[4-5]。小球藻中的蛋白质种类非常丰富,其氨基酸组成超过FDA颁布的用于人类食品的蛋白质标准[6]。小球藻生长因子不仅可以改善机体酸性环境,还能够增强免疫力[7]、延缓衰老、更好更快修复受伤组织[8-10]。以藻蛋白为主的小球藻保健产品在日本、东南亚、我国台湾地区每年销售量都位居前列,具有很好的经济前景[11],而产油效率远高于油料作物的小球藻也屡屡成为国家级科研资金资助的研究目标[12]。因此,随着能源危机和粮食安全加剧,基于小球藻生产油脂、蛋白质等高附加值产品的技术受到人们的广泛关注[13],其中异养小球藻具有生长速度快、生物量高、含油量高、占用土地面积小[14]、能够利用工业化设备实现藻体高密度规模化培养等特点受到研究人员重点关注[15-17]。但是由于异养小球藻产油技术的高成本导致该产业规模仍然较小[18-20],如果能够在提油之前将小球藻产生的蛋白质提取出来,不仅使小球藻物尽其用,还可以降低异养小球藻产油的生产成本[21-25]。
由于自养小球藻生产成本低、蛋白质含量和品质相对较高[26-27],现有文献关于小球藻蛋白质的提取聚焦于自养小球藻[28-30],但是高产蛋白的自养小球藻含油量极少、规模化培养受到自然条件和场地限制较大,生产过程难以控制,会造成不同批次的产品质量差异较大[31-33]。相对于藻蛋白市场,藻油可用于制成食用油、生物柴油[34-36]、是用途广泛、市场容量巨大的产品[37],提取异养小球藻的蛋白质,有助于降低藻油的生产成本,从而为提高人类生活品质、解决人类生存问题作出贡献[38]。本研究使用的异养培养的小球藻,原材料充足、藻体密度大、质量稳定,具有很好的研究价值和经济意义[39]。
小球藻细胞壁坚韧,如果不能将其有效破碎,其中的营养成分难以被充分提取,因此小球藻细胞破碎技术至关重要[40]。目前国内外对于藻类细胞常用的破壁技术有超声波法、高压均质法、纤维素酶解等。曲文娟等[41]使用脉冲超声技术提取钝顶螺旋藻中的藻蓝蛋白,蛋白得率为13.45%,比冻融法高10.26%。王晓琴等[42]利用高压均质机对小球藻进行破壁,蛋白提取率为45.78%。陈艺煊等[43]使用纤维素酶对蛋白核小球藻进行破壁,破壁率为82.25%。但这些技术存在着处理量小、破壁效果差,且设备及材料成本较高、不适合规模化生产等缺点,因此寻找更为经济有效的破壁方法势在必行,本研究借鉴植物蛋白提取的常用的“碱提酸沉”法来提取异养小球藻中的蛋白质[44-45],并进行工艺优化,旨在为异养小球藻高附加值利用提供参考。
1 材料与方法
1.1 材料与试剂
异养小球藻藻粉(蛋白含量:12.163%,水分含量:1%);
考马斯亮蓝、牛血清蛋白,北京索莱宝科技有限公司;NaOH、乙醇、H3PO4均为分析纯,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
DGG-9070A型电热恒温鼓风干燥箱,上海森信实验仪器有限公司;AL204型电子天平,梅特勒-托利多仪器(上海有限公司);DK-S22型电热恒温水浴锅,上海精宏实验设备有限公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;SKD-100型凯氏定氮仪,上海沛欧分析仪器有限公司;WFJ2100型分光光度计,尤尼柯(上海)仪器有限公司;高速粉碎机,上海隆拓仪器设备有限公司。
1.3 试验方法
1.3.1 小球藻粉中水分含量的测定
按GB/T5009.3—2003.105 ℃恒重法(恒质量法)测得小球藻粉中水分含量为1%。
1.3.2 小球藻粉中蛋白质含量的测定
利用凯氏定氮法检测。
1.3.3 提取液蛋白质含量测定
采用考马斯亮蓝G-250法测定,以牛血清蛋白(BSA)为标准品配制浓度梯度标准液,做标准曲线,然后依据标准曲线推测提取液样品中蛋白质含量。
1.3.4 小球藻蛋白质提取率
小球藻蛋白质提取率按式(1)计算。
蛋白质提取率/%=
(1)
1.3.5 小球藻粉中蛋白质的提取流程
异养小球藻粉在电热恒温干燥箱中105 ℃烘干至衡重,取适量处理过的小球藻粉于锥形瓶中,按照设定的试验条件来提取其中的蛋白质。
1.4 单因素试验
1.4.1 NaOH的添加量对小球藻蛋白质提取率的影响
固定液料比为50∶1,提取温度60 ℃,提取时间为1 h,分别在5%、10%、15%、20%、25%(质量分数)的NaOH添加量下进行试验。
1.4.2 液料比对小球藻蛋白质提取率的影响
固定NaOH添加量为20%质量分数,提取温度60 ℃,提取时间为1 h,分别在20∶1、30∶1、40∶1、50∶1、60∶1、70∶1、80∶1的液料比下进行试验。
1.4.3 提取时间对小球藻蛋白质提取率的影响
固定NaOH添加量为20%(质量分数),液料比为50∶1,提取温度60 ℃,分别在20、40、60、80、100、120 min的提取时间下进行试验。
1.4.4 提取温度对小球藻蛋白质提取率的影响
固定NaOH添加量为20%(质量分数),液料比为50∶1,提取时间为40 min,分别在40、45、50、55、60、65、70 ℃的提取温度下进行试验。
1.5 正交实验设计
根据单因素试验结果,选取NaOH的添加量、液料比、提取时间、提取温度4个因素作为试验因素,以蛋白质提取率为指标设计试验,采用L9(34)正交表,试验因素水平表见表1。
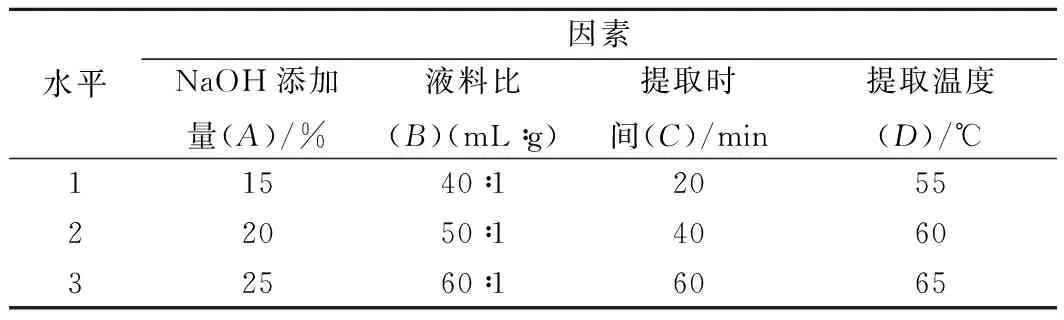
表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal test
2 结果与分析
2.1 蛋白质标准曲线
实验测得蛋白的标准曲线为y=6.446 6x+0.023 9,R2=0.995 9。其中y为A595nm的数值,x为溶液中蛋白质的质量浓度。

图1 牛血清蛋白质标准曲线Fig.1 Calibration curve of the bovine serum albumin
2.2 单因素试验结果
2.2.1 NaOH的添加量对小球藻蛋白质提取率的影响
碱溶液提取蛋白质过程中,pH值是影响蛋白质提取效果的重要因素,但是在提取过程中pH值会发生变化,且不易控制,因此选择NaOH的添加量进行研究更为方便可行[46]。由图2可以看出,NaOH的添加量对小球藻蛋白质的提取率有较大的影响,在NaOH的添加量比较小的时候,蛋白质的提取率比较低,并且蛋白质的提取率随着NaOH的添加量的增加而提高,因为在碱性环境中,蛋白质分子的结构由紧密变为疏松,蛋白质分子之间相互排斥,同时碱性溶液会破坏蛋白质分子的次级键尤其是氢键,这些作用会使蛋白质溶解性增加,并且这种增溶作用会随着NaOH添加量的增加而增强[47],所以蛋白质提取率随着NaOH添加量的增加而上升。但是当NaOH的添加量超过20%并且继续增加时,蛋白质的提取率不升反降,并有异味产生,可能是因为NaOH添加量过高造成了蛋白质过度水解,部分氨基酸发生缩合反应产生异味物质[48]。江怀真等[49]利用热碱法提取小球藻蛋白质,在NaOH的添加量为15%(质量分数)时,蛋白质提取率约为43%,本实验为39.19%,可能是因为江怀真等人试验所用小球藻粉蛋白含量(55.8%)高于本实验(12.163%),提取液蛋白质含量测定使用的是凯氏定氮法,而本实验使用考马斯亮蓝G-250法测定,因此本实验蛋白质提取率与之对比相对较低。NaOH添加量的单因素试验结果与江的相当,因此,NaOH的最佳添加量定为20%(质量分数)。

图2 NaOH的添加量对小球藻蛋白质提取率的影响Fig.2 Effect of the adding ratio of NaOH on the extractionof the chlorella protien
2.2.2 液料比对小球藻蛋白质提取率的影响
由图3可以看出,液料比对小球藻蛋白质提取率也有较大的影响,液料比较小时蛋白质提取率较低,可能是因为加水量太少溶液黏稠,分子扩散速度慢,影响蛋白质分子的溶解。当液料比从20∶1增大到50∶1时,蛋白质提取率提高比较明显,由32.26%提高至43.96%,等量蛋白质由过饱和状态变为不饱和状态,所以蛋白质溶解性增加[50]。而当液料比从50∶1增大到80∶1,料液比几乎增大了1倍,但是蛋白质提取率却只提高了3.38%,尽管提取率仍然有所提高,但是结合生产实际,较高的液料比会导致蛋白质浓度过低,提取过程中的损耗会增大,而且会造成后期蛋白质的纯化难度大大增加[51],因此选择液料比为50∶1。

图3 液料比对小球藻蛋白质提取率的影响Fig.3 Effect of the liquid-solid ratio on the extraction ofthe chlorella protien
2.2.3 提取时间对小球藻蛋白质提取率的影响
由图4可知,热碱法对小球藻细胞壁的破坏作用较强,提取20 min时,蛋白质提取率已经达到45.74%,随着提取时间的延长,蛋白质提取率继续增加,在40 min时提取率达到最高,为50.42%,此时小球藻中的大部分蛋白质已经溶出,因为超过40 min后,蛋白质的提取率开始缓慢下降,这表明蛋白质的溶出过程与时间密切相关,提取时间太短,蛋白质溶解不充分,提取时间过长,又会造成蛋白质的变性或者其他组分溶出量增大,使得蛋白质提取率降低[52]。所以选择提取时间为40 min。

图4 提取时间对小球藻蛋白质提取率的影响Fig.4 Effect of the time on the extraction of the chlorellaprotien
2.2.4 提取温度对小球藻蛋白质提取率的影响
温度直接影响物质在溶液中的溶解性,因此温度对蛋白质提取率有显著的影响。由图5可知,在温度为40~50 ℃,蛋白质提取率基本没有变化,可能是温度较低,小球藻的细胞壁未能有效破碎,但是在温度为50~60 ℃,蛋白质提取率随着温度的升高迅速提高,在温度为60 ℃时提取率达到最高,为53.16%,可能是由于在该温度范围内蛋白质分子结构发生变化,立体结构舒展,与水的相互作用增强[47],蛋白质溶出量增大。温度超过60 ℃以后,蛋白质提取率不升反降,可能是由于温度过高造成蛋白质变性,这与前人的研究结果一致[53]。所以提取温度取60 ℃。
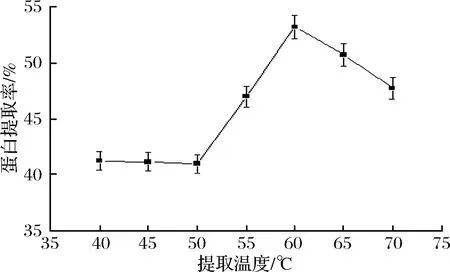
图5 提取时间对小球藻蛋白质提取率的影响Fig.5 Effect of the temperature on the extraction of thechlorella protien
2.3 正交试验结果
为了比较NaOH的添加量、液料比、提取时间、提取温度4个因素对小球藻蛋白质提取率的影响,使用正交试验法来确定小球藻蛋白质的最佳提取条件,试验设计及结果见表2。

表2 正交试验结果Table 2 Results of the orthogonal test
由正交试验R值分析可知,4个因素对小球藻蛋白质提取率的影响次序为A>B>D>C,即NaOH添加量>液料比>提取温度>提取时间,进一步的方差分析表明(表3),4个因素中,提取时间对小球藻蛋白质的提取有显著影响,最优组合为A2B2C1D2,即NaOH添加量20%(质量分数),液料比50∶1,提取时间20 min,提取温度60 ℃。以该自由组合条件进行验证试验,得出在该条件下小球藻蛋白质提取率为54.98%,与正交试验中提取率最高的一组A2B2C3D1进行比较,可知小球藻最佳提取条件为A2B2C3D1,即NaOH添加量20%,液料比50∶1,提取时间60 min,提取温度55 ℃,此条件下小球藻蛋白质的提取率可达55.24%。

表3 方差分析Table 3 Analysis of variance
3 结论
藻类细胞破碎方法有很多,但常用的藻类细胞破碎方法多不适合工业化应用,本文参考植物蛋白提取常用的“碱提酸沉法”来提取异养小球藻粉中的蛋白质,研究了热碱法提取小球藻蛋白质的条件,经单因素试验和正交试验对热碱法提取小球藻蛋白质的提取工艺进行了优化,得到热碱法提取小球藻蛋白质的最佳条件为:NaOH添加量20%(质量分数),液料比50∶1,提取时间60 min,提取温度55 ℃,此条件下小球藻蛋白质的提取率可达55.24%。此法所用仪器简单、操作简便易行、处理量大、提取效果明显、成本低,且在后续蛋白质的提纯过程中可加入HCl来调节等电点使蛋白质沉淀,并且中和了提取过程中添加的碱,不会对环境造成污染,也不影响提取出来的蛋白质作为保健品来食用,因此该法非常适合工业化应用,具有很好的应用前景,本研究为异养小球藻产油技术经济最大化提供了参考。
