响应面法优化超声波辅助提取杜仲叶茯砖茶绿原酸及其体外降血糖抗氧化活性
2018-10-17曾桥韦承伯夏飞李祥
曾桥,韦承伯,夏飞,李祥
1(陕西科技大学 食品与生物工程学院,陕西 西安,710021)2(陕西农产品加工技术研究院,陕西 西安,710021) 3(陕西科技大学 化学与化工学院,陕西 西安,710021)
杜仲叶为杜仲科植物杜仲[1](Eucommia ulmoides oliver)的干燥叶,常于夏、秋二季枝叶茂盛时采收,晒干或低温烘干。《中国药典》记载其性微辛、温,归肝、肾经,具有补肝肾,强筋骨的作用,临床上常用于治疗肝肾不足,头晕目眩,腰膝酸痛,筋骨痿软等症[2]。绿原酸是杜仲叶中的重要活性成分,是评价杜仲叶质量优劣的主要指标[2],现代药理研究表明,绿原酸具有抗氧化[3]、抑菌[3-4]、保护心血管[5]、降血糖[6]、降血脂[7]、抗病毒[8]、抗白血病[9]、抗癌[10]等一系列生物活性,在医药和食品领域具有广泛的用途。杜仲叶中绿原酸含量因产地和收获时间而异,一般可达1%~5%,一些品质较好的杜仲叶,其绿原酸含量和金银花相当[11]。2018年4月24日国家卫生健康委员会发布《关于征求将党参等9种物质作为按照传统既是食品又是中药材物质管理意见》的函,提出将杜仲叶按照药食同源物质进行管理,有望在未来进一步拓宽杜仲叶的使用范围,从而极大地促进杜仲叶资源的开发和利用。
茯砖茶属于后发酵茶,是近年来茶品市场兴起的一个新热点,由于其内质金花普茂,菌香浓郁,开汤后汤色红浓,滋味醇和,香气纯正[12],且具有较好的消食健胃、降脂减肥、降血糖、抗肿瘤、抗氧化、抑菌等[13-14]功效,受到消费者的青睐。本文前期以采摘于陕西汉中略阳的杜仲叶为原料,经杀青、揉捻、干燥等制成杜仲叶茶,进一步采用茯砖茶加工工艺制作而成杜仲叶茯砖茶,属于一种新型茶,目前尚未见杜仲叶茯砖茶功能成分和活性研究的相关报道。
1 材料与方法
1.1 材料与试剂
杜仲叶茯砖茶:所用杜仲叶为2017年5月采摘于陕西汉中略阳,经陕西科技大学药学系鉴定为杜仲科植物杜仲的干燥叶,由陕西朴道茯茶股份有限公司加工制成杜仲叶茯砖茶。
乙腈(色谱纯),默克股份两合公司;绿原酸标准品(纯度≥98%)、α-胰淀粉酶(13 U/mg)、α-葡萄糖苷酶(32 U/mg)、阿卡波糖、1,1-二苯基-2-三硝基苯肼(DPPH),上海源叶生物科技有限公司;H3PO4、NaCl、FeCl3、乙酸乙酯、淀粉、NaOH、Na2CO3、NaH2PO4、Na2HPO4、铁氰化钾、酒石酸钾钠、抗坏血酸(Vc)、无水乙醇、95%乙醇,天津市天力化学试剂有限公司;HCl、3,5-二硝基水杨酸、4-硝基苯-β-D-吡喃半乳糖苷,国药集团化学试剂有限公司;三氯乙酸,上海山浦化工有限公司;D101型大孔树脂,天津允开树脂科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
ThermoU3000高效液相色谱仪(配有可变波长紫外检测器和Chromeleon 7.10色谱工作站)、Varioskan flash酶标仪,美国Thermo Fisher Scientific公司;TU-1810紫外分光光度计,北京普析通用仪器有限责任公司;FA1004N电子分析天平,上海精密科学仪器有限公司;EX125DZH电子天平,奥豪斯仪器(常州)有限公司;RE52CS-1旋转蒸发仪,上海亚荣生化仪器厂; KH5200DE型医用数控超声波清洗器,昆山禾创超声仪器有限公司;HH-2电热恒温水浴锅,北京科伟永兴仪器有限公司;TD5A大容量低速离心机,长沙英泰仪器有限公司;DZ-2BC型真空干燥箱,天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 样品制备
取杜仲叶茯砖茶1块(500 g),粉碎过60目筛,置于50 ℃真空干燥箱中干燥至恒重后,准确称取杜仲叶茯砖茶粉末2 g,置于一定浓度乙醇溶液中,在一定温度、液料比、超声功率下提取一定时间后过滤,滤液定容至100 mL,进一步吸取2 mL定容至50 mL,经0.45 μm微孔膜过滤,得杜仲叶茯砖茶绿原酸供试品溶液。
1.3.2 绿原酸含量测定
1.3.2.1 色谱条件[2]
色谱柱:Thermo C18色谱柱(250 mm×4.6 mm,5 μm);流动相:V(乙腈)∶V(0.4% H3PO4水溶液)=13∶87;柱温:25 ℃;流速:1 mL/min;进样量:10 μL;检测波长:327 nm。
1.3.2.2 绿原酸标准曲线绘制
精密称取绿原酸标准品20.922 mg,用体积分数为50%的乙醇溶解并定容至25 mL棕色容量瓶中,得质量浓度为836.9 μg/mL的绿原酸标准品母液。精密吸取绿原酸标准品母液,分别配制成质量浓度为4.185、8.369、16.738、41.845、83.690 μg/mL的绿原酸标准工作液,采用HPLC法进行测定,以质量浓度为横坐标,峰面积为纵坐标绘制绿原酸标准曲线。曲线方程为Y=0.531 7X+0.239 6,R2=0.999 9,线性关系良好。
1.3.2.3 供试品溶液绿原酸含量测定
取供试品溶液,采用HPLC法按1.3.2.1项下色谱条件进行测定,计算峰面积,依绿原酸标准曲线计算绿原酸含量。
1.3.2.4 绿原酸得率计算

(1)
式中:Y为绿原酸质量浓度,μg/mL;V为供试品溶液体积,mL;D为稀释倍数;B为原料质量,g;106为质量换算系数。
1.3.3 单因素实验
准确称取杜仲叶茯砖茶试样2 g置于100 mL锥形瓶中,在液料比25∶1(mL∶g)、提取时间30 min、提取温度60 ℃、超声功率60 W条件下,考察乙醇体积分数分别为10%、20%、30%、40%、50%、60%、70%、80%、90%对绿原酸得率的影响;在乙醇体积分数为50%、提取时间30 min、提取温度60 ℃、超声功率60 W条件下,考察不同液料比10∶1、15∶1、20∶1、25∶1、30∶1、35∶1、40∶1(mL∶g)对绿原酸得率的影响;在乙醇体积分数为50%、 液料比25∶1(mL∶g)、提取温度60 ℃、超声功率60 W条件下,考察提取时间分别为10、20、30、40、50、60、70 min对绿原酸得率的影响;在乙醇体积分数为50%、液料比25∶1(mL∶g)、提取时间30 min、超声功率60 W条件下,考察提取温度分别为30、40、50、60、70、80 ℃对绿原酸得率的影响;在乙醇浓度为50%、液料比25∶1(mL∶g)、提取时间30 min、提取温度60 ℃条件下,考察超声功率分别为40、50、60、70、80、90、100 W对绿原酸得率的影响。
1.3.4 响应面优化杜仲叶茯砖茶绿原酸提取工艺
在单因素实验基础上,固定超声功率为90 W,选取乙醇体积分数、液料比、提取时间、提取温度等4个因素,利用Design Expert 8.0.6软件,设计4因素3水平Box-Behnken中心组合实验,响应面因素及水平设计见表1。

表1 Box-Behnken实验设计因素和水平表Table 1 Factors and levels of Box-Behnken design
1.3.5 杜仲叶茯砖茶绿原酸的纯化[15]
将D101大孔树脂用无水乙醇浸泡24 h后,去离子水洗至无醇味,进一步用体积分数5% HCl溶液提取12 h,去离子水洗至中性;然后用质量浓度为50 g/L 的NaOH溶液提取12 h,去离子水洗至中性;最后用体积分数为95%乙醇洗涤,水洗至中性后备用。将预处理后的D101大孔树脂湿法装入离子交换柱,将在最优提取工艺条件下提取的绿原酸提取液离心(4 000 r/min)15 min,取上清液,用浓HCl调至pH=2,自离子交换柱上端倒入柱中,进行动态分离,调节去离子水为pH=2,冲洗3~5 BV(树脂体积)洗脱以去除杂质,用体积分数为30%乙醇洗脱绿原酸。上样、洗柱、洗脱速度均为2 BV/h。
将洗脱所得绿原酸溶液55 ℃减压浓缩至质量浓度约为40 mg /mL,采用乙酸乙酯按酯相和水相为1∶1萃取5次,每次萃取20 min,合并萃取液旋转蒸发浓缩至干,采用去离子水复溶,冷冻干燥得纯化后的绿原酸,经HPLC检测,绿原酸纯度为30.31%。
1.3.6 降血糖作用研究
1.3.6.1 ɑ-胰淀粉酶抑制活性的测定[16]
称取一定量纯化后的杜仲叶茯砖茶绿原酸,溶于NaCl浓度为6 mmol/L的20 mmol/L pH 6.9的磷酸钠缓冲液,配制成质量浓度分别为0.4、0.6、0.8、1.0、1.2、1.4 mg/mL的绿原酸溶液。于各试管中分别加入上述不同质量浓度的绿原酸溶液200 μL与200 μL α-淀粉酶溶液(1.0 U/mL,溶于pH 6.9的磷酸钠缓冲液)混合,记为样品;以缓冲液代替酶溶液记为背景;用含NaCl的缓冲液代替样品溶液记为阴性对照。所有试管溶液于37 ℃水浴孵育10 min后加入400 μL 2.5 g/L的淀粉溶液,置于37 ℃水浴中反应10 min后加入1.0 mL DNS显色剂(1% 3,5-二硝基水杨酸、12%酒石酸钾钠共同溶于0.4 mol/L NaOH)终止反应,沸水浴10 min 后冷却至室温,加入10 mL蒸馏水稀释,以缓冲液调零,于540 nm波长处测定样品、背景、阴性对照的吸光度值,分别记为A样品、A背景和A阴性。以阿卡波糖为阳性对照,按下式计算样品对α-胰淀粉酶的抑制率:
(2)
1.3.6.2 ɑ-葡萄糖苷酶的抑制活性的测定[16-17]
称取一定量纯化后的杜仲叶茯砖茶绿原酸,溶于40%乙醇溶液,配制成质量浓度分别为0.08、0.10、0.12、0.14、0.16、0.18 mg/mL的溶液,在96孔板中,分别加入20 μL的绿原酸溶液与40 μL 5 mmol/L的4-硝基苯-β-D-吡喃半乳糖苷溶液(溶于pH 7.0的磷酸钠缓冲溶液),在37 ℃下孵育5 min后,分别加入10 μL 1.0 U/mL α-葡萄糖苷酶溶液(溶于pH 7.0的磷酸钠缓冲溶液),振荡均匀,37 ℃下反应10 min后加入140 μL 0.2 mmol/L的Na2CO3溶液终止反应,得待测样品。同时以缓冲液代替酶溶液,以40%乙醇溶液代替绿原酸溶液,其余操作条件同样品,分别记为背景和空白对照。于400 nm波长处测定样品、背景、空白对照的OD值,分别记为A样品、A背景和A空白。以阿卡波糖为阳性对照,用以下公式计算样品对α-葡萄糖苷酶的抑制率:
(3)
1.3.7 抗氧化活性研究
1.3.7.1 DPPH自由基清除活性测定[18]
称取一定量DPPH粉末,用无水乙醇配制成浓度为0.1 mmol/L的DPPH溶液。称取一定量纯化后的杜仲叶茯砖茶绿原酸,分别配制质量浓度为4、8、12、16、20、24 μg/mL的溶液。取6支洁净具塞试管,分别依次加入DPPH溶液2 mL,各浓度梯度杜仲叶茯砖茶绿原酸溶液2 mL,混匀后室温放置30 min,以蒸馏水调零,于517 nm处测吸光度记为A样品。用蒸馏水代替DPPH溶液按上述方法处理测定吸光度记为A对照,以蒸馏水代替杜仲叶茯砖茶绿原酸提取液按上述方法处理测定吸光度记为A空白。同时,以VC为阳性对照。按下式计算DPPH自由基清除率:
(4)
1.3.7.2 铁还原力测定[19]
称取一定量纯化后的杜仲叶茯砖茶绿原酸,分别配制质量浓度为0.08、0.12、0.16、0.20、0.24、0.28 mg/mL的溶液,分别取各梯度浓度绿原酸溶液0.5 mL,加入2.5 mL 0.2 mol/L pH 6.6的磷酸盐缓冲液和2.5 mL 1%铁氰化钾溶液,混匀后于50 ℃水浴保温20 min后,加入2.5 mL 10%的三氯乙酸溶液、5 mL蒸馏水和1 mL 0.1% FeCl3溶液,混合均匀,静置10 min,以无水乙醇代替绿原酸提取液按上述处理作空白对照,于700 nm波长处测定吸光度。
1.4 数据处理
所有实验均重复3次,响应面优化实验数据采用Design-Expert 8.0.6软件进行二次回归分析及方差分析,其余实验结果均采用Graph Pad Prism软件进行处理。
2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇浓度对杜仲叶茯砖茶绿原酸得率的影响
由图1可知,杜仲叶茯砖茶绿原酸得率随乙醇体积分数的变化先增大后减小,当乙醇体积分数为40%时,绿原酸得率达到最大值,继续增大乙醇体积分数,绿原酸得率则开始下降,当乙醇体积分数大于60%时,下降最为明显。虽然增大乙醇体积分数有利于绿原酸的溶出,但过大,易造成杂质的溶出,削弱绿原酸的溶出,从而导致绿原酸提取率下降[20]。因此,适宜的乙醇体积分数为40%。

图1 乙醇体积分数对杜仲叶茯砖茶绿原酸得率的影响Fig.1 The effect of ethanol concentration on the chlorogenic acid extraction rate from eucommia ulmoides leaves of Fubrick tea
2.1.2 液料比对杜仲叶茯砖茶绿原酸得率的影响
由图2可知,杜仲叶茯砖茶绿原酸得率先随液料比增加而增大,当液料比达到25∶1 (mL∶g)时,绿原酸得率达到最大值2.376 2%,继续增大液料比,绿原酸得率则开始下降。这是由于液料比的增加有利于增大绿原酸的绝对溶出量,但是过大的液料比也会造成杂质的溶出和能耗的增大。因此,适宜的液料比为25∶1 (mL∶g)。

图2 液料比对杜仲叶茯砖茶绿原酸得率的影响Fig.2 The effect of liquid-solid ratio on the chlorogenic acid extraction rate from eucommia ulmoides leaves of Fu brick tea
2.1.3 提取时间对杜仲叶茯砖茶绿原酸得率的影响
由图3可知,随着提取时间的延长,杜仲叶茯砖茶绿原酸得率也逐步增大,当提取时间为50 min时,得率达到最大2.388 9%,继续延长时间,得率缓慢下降。由于过长的提取时间可能导致绿原酸的结构遭到破坏[21]以及杂质的溶出。因此,适宜的提取时间为50 min。
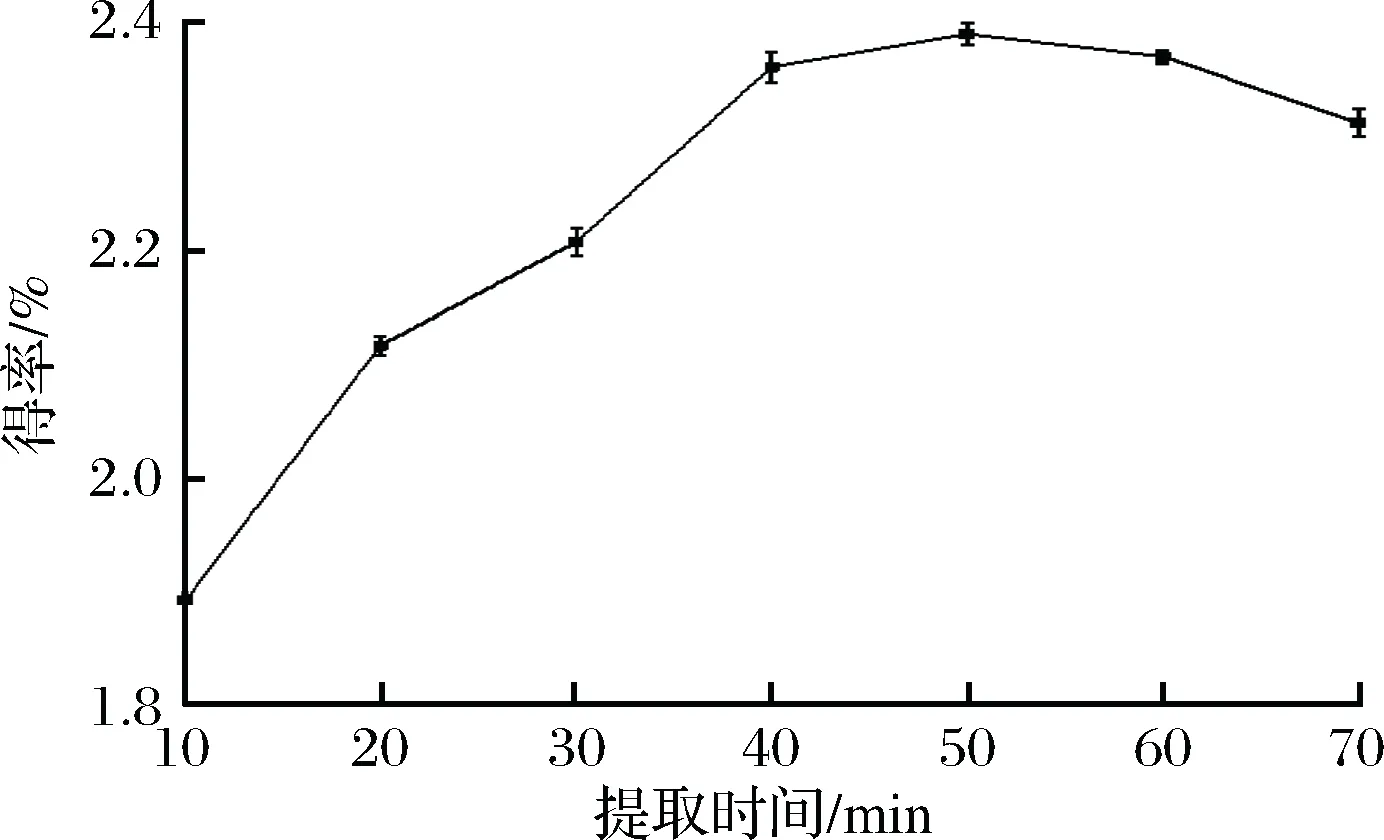
图3 提取时间对杜仲叶茯砖茶绿原酸得率的影响Fig.3 The effect of extraction time on the chlorogenic acid extraction rate from eucommia ulmoides leaves of Fu brick tea
2.1.4 提取温度对杜仲叶茯砖茶绿原酸得率的影响
由图4可知,随着提取温度的升高,杜仲叶茯砖茶绿原酸得率增加较为显著,当温度为60 ℃时,绿原酸得率达到最大2.216 2%,继续升高温度,绿原酸得率又开始下降。这可能是由于温度升高,分子运动加快,促进了绿原酸的溶出,但是过高的温度可能会破坏绿原酸的结构,从而导致得率下降。因此,适宜的提取温度为60 ℃。
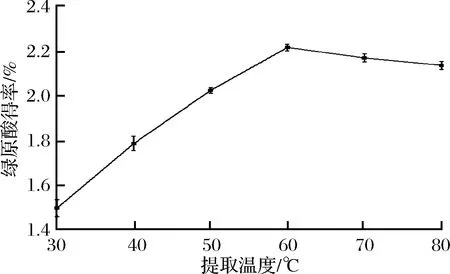
图4 提取温度对杜仲叶茯砖茶绿原酸得率的影响Fig.4 The effect of extraction temperature on the chlorogenic acid extraction rate from eucommia ulmoides leaves of Fu brick tea
2.1.5 超声功率对杜仲叶茯砖茶绿原酸得率的影响
从图5可以看出,当超声功率较低时,杜仲叶茯砖茶绿原酸得率变化不大,当功率超过80 W时,绿原酸得率显著增加,当功率为90 W时,绿原酸得率达到最大2.281 0%,继续增大超声功率,得率则开始下降。因此,适宜的超声功率为90 W。

图5 超声功率对杜仲叶茯砖茶绿原酸得率的影响Fig.5 The effect of ultrasonic power on the chlorogenic acid extraction rate from eucommia ulmoides leaves of Fu brick tea
2.2 杜仲叶茯砖茶绿原酸提取工艺的响应面优化
在单因素实验基础上,根据Box-Behnken中心组合实验设计原理,确定以乙醇浓度(A)、液料比(B)、提取时间(C)、提取温度(D)为基础设计4因素3水平共29组响应面分析实验。实验因素和水平设计见表1,实验方案设计及结果见表2,方差分析见表3,各响应面分析图见图6。
由响应面分析结果对各因素拟合所得回归方程为:Y=-5.308 62+0.055 567A+0.220 02B+6.075 40× 10-3C+0.128 40D+1.528 13×10-4AB-3.275 00×10-5AC-2.497 50×10-4AD-3.052 50×10-4BC+1.625 00×10-3BD+3.353 75×10-4×CD-5.494 51×10-4A2-6.252 81×10-3B2-1.754 75×10-4C2-1.452 65×10-3D2
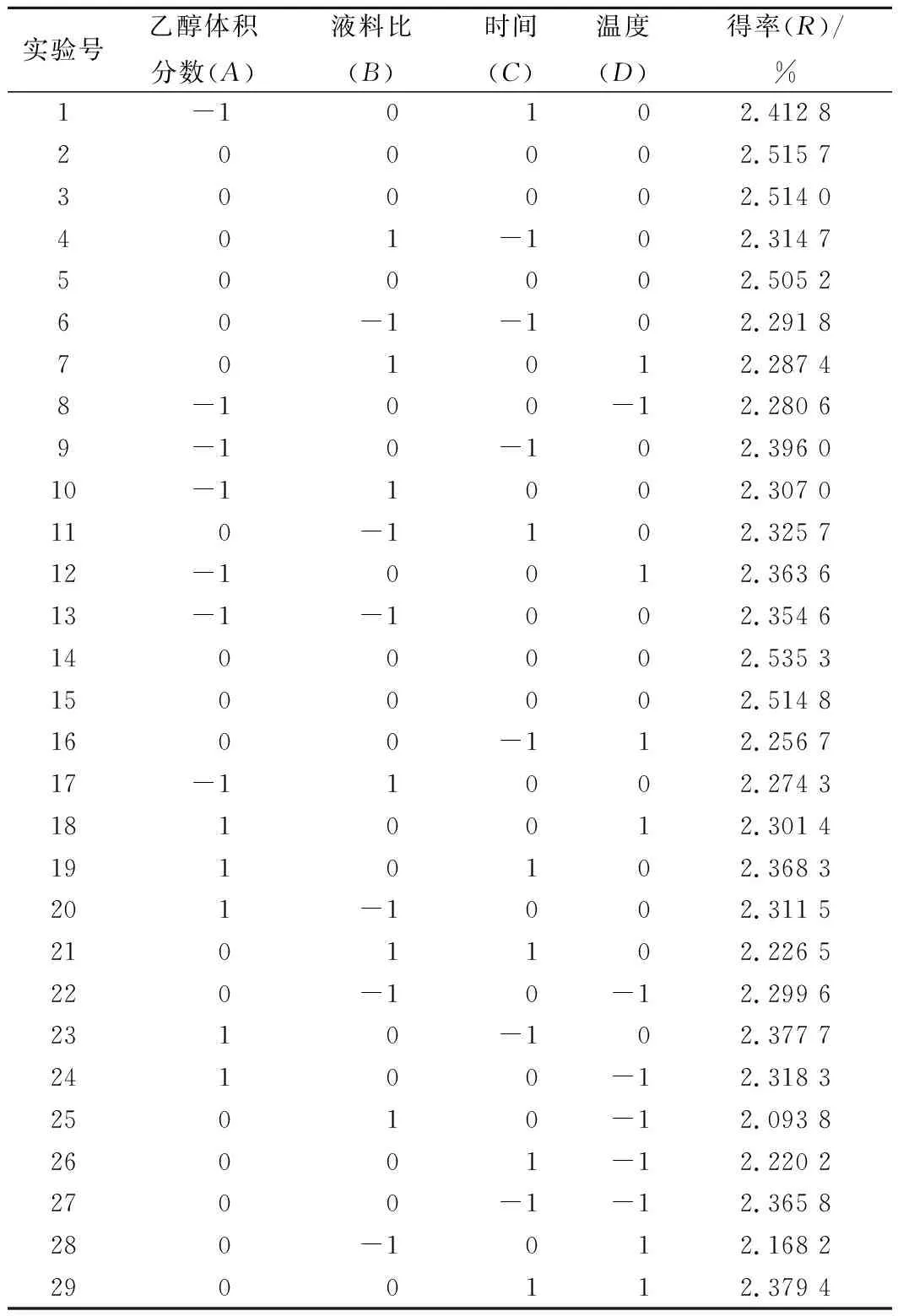
表2 Box-Behnken中心组合实验设计及结果Table2 Design and results of Box-Behnken experiment

表3 回归方程方差分析Table 3 Results of variance analysis of regression equation
注:***:差异极显著(p<0.001);**:差异高度显著(p<0.01);*:差异显著(p<0.05)。

图6 各因素交互作用对绿原酸得率影响的响应面图Fig.6 Response surface plots showing the interactive effectsof various factors on chlorogenic acid extraction rate
由图6可知,提取温度,液料比以及乙醇浓度对绿原酸的得率均有较显著的影响。其中,液料比对绿原酸得率的影响最为显著,随着液料比的增大,绿原酸得率先增大后减小,提取温度对绿原酸得率影响相对显著,乙醇体积分数次之,提取时间影响最小,曲面较为平缓[21]。这与表3回归分析结果相符。
经模型预测,杜仲叶茯砖茶绿原酸最佳提取条件为超声功率90 W,乙醇体积分数38.77%,提取时间49.96 min,液料比24.70∶1 (mL∶g),提取温度60.45 ℃,在该最佳条件下,杜仲叶茯砖茶多糖得率为2.518 7%。考虑到实际操作过程的简便,对各个工艺参数稍作修改为:超声功率90 W,乙醇体积分数39%,提取时间50 min,液料比25∶1 (mL∶g),提取温度60 ℃,经过3次平行验证实验,在此条件下,绿原酸得率为2.446 1%,与预测值相对误差为2.88%,说明该提取工艺条件准确可行,具有应用价值。
2.3 杜仲叶茯砖茶绿原酸体外降血糖抗氧化活性
2.3.1 体外降血糖作用研究
2.3.1.1 对α-胰淀粉酶的抑制活性
由图7可以看出,杜仲叶茯砖茶绿原酸对α-胰淀粉酶有较强的抑制作用,但抑制能力较阿卡波糖要低。随着绿原酸浓度的增大,抑制率也逐步增加,当绿原酸浓度达到1.4 mg/mL时,其对α-胰淀粉酶的抑制率达到83.26%,相同浓度下阿卡波糖对α-胰淀粉酶的抑制率为97.14%。在0.4~1.4 mg/mL范围内,绿原酸质量浓度与抑制率间存在线性正相关,拟合方程为:Y=0.487 4X+0.162 1,R2=0.994 8,线性关系良好。通过该拟合方程可计算出杜仲叶茯砖茶绿原酸对α-胰淀粉酶半抑制浓度(IC50)为0.69 mg/mL。

图7 杜仲叶茯砖茶绿原酸对α-胰淀粉酶抑制活性Fig.7 α-pancreatic amylase inhibitory activity of chlorogenic acid from eucommia ulmoides leaves of fu brick tea at various concentrations
2.3.1.2 对α-葡萄糖苷酶的抑制活性
由图8可以看出,杜仲叶茯砖茶绿原酸对α-葡萄糖苷酶有较强的抑制作用,但抑制能力较阿卡波糖要低。随着绿原酸质量浓度的增大,抑制率也逐步增加,当绿原酸质量浓度达到0.18 mg/mL时,其对α-葡萄糖苷酶的抑制率达到96.80%,与相同浓度下阿卡波糖对α-葡萄糖苷酶的抑制率相当。从图8还可以发现杜仲叶茯砖茶绿原酸对α-葡萄糖苷酶的IC50为0.08~0.10 mg/mL。
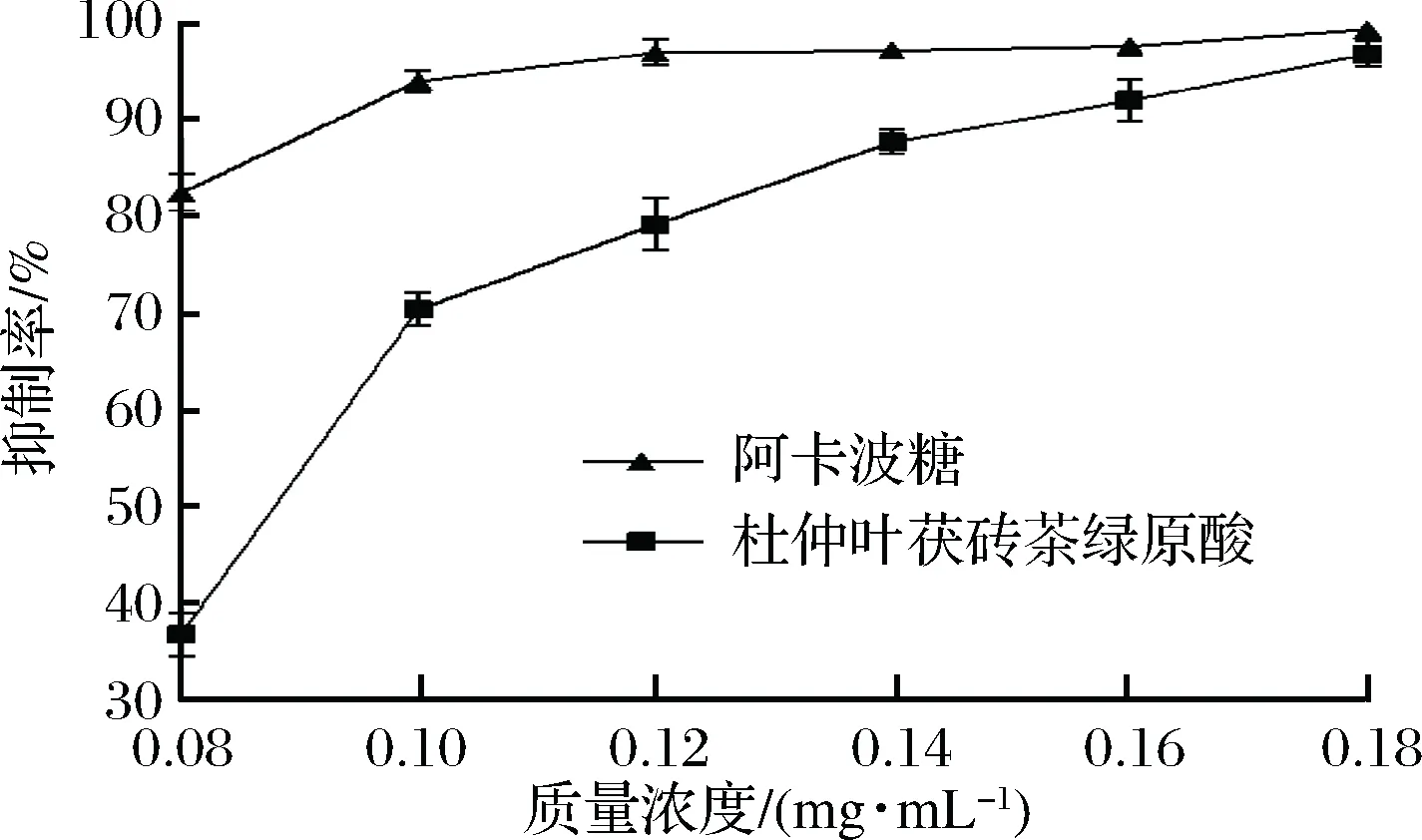
图8 不同质量浓度杜仲叶茯砖茶绿原酸对α-葡萄糖苷酶抑制活性Fig.8 α-glucosidase inhibitory activity of chlorogenic acid from eucommia ulmoides leaves of fu brick tea at various concentrations
2.3.2 体外抗氧化活性研究
2.3.2.1 DPPH自由基清除作用
从图9可以看出,杜仲叶茯砖茶绿原酸具有较好的DPPH自由基清除作用,其清除能力优于Vc,其对DPPH自由基的清除效果随质量浓度的增大而增大,当绿原酸浓度达12 μg/ mL时,其对DPPH自由基的清除率为91.84%,继续增大绿原酸质量浓度,清除率增加缓慢。当绿原酸质量浓度达24 μg/ mL时,其对DPPH自由基的清除率可达97.94%。

图9 不同质量浓度杜仲叶茯砖茶绿原酸对DPPH自由基清除作用Fig.9 Scavenging activity of chlorogenic acid from eucommia ulmoides leaves of fu brick tea at various concentrations against DPPH free radicals
2.3.2.2 还原力测定
由图10可以看出,当质量浓度低于0.16 mg/mL时,杜仲叶茯砖茶绿原酸的还原力随着质量浓度的增大而显著增大,当质量浓度高于0.16 mg/mL时,其还原力增加稍有变缓。此外,由图10可以看出,绿原酸的还原力明显优于Vc。

图10 不同质量浓度杜仲叶茯砖茶绿原酸还原力Fig.10 Ferric reducing power of chlorogenic acid from eucommia ulmoides leaves of fu brick tea at various concentrations
3 结论
本实验所用杜仲叶茯砖茶以杜仲叶茶为原料,采用茯砖茶加工工艺制作而成,具有普通茯砖茶金花普茂,菌香浓郁,开汤后汤色红浓,滋味醇和,香气纯正等特征,品质较杜仲叶茶大大提高。绿原酸是杜仲叶重要活性成分之一,杜仲叶茯砖茶绿原酸的提取工艺研究结果表明,最佳提取条件为:超声功率90 W,乙醇体积分数39%,提取时间50 min,液料比25∶1 (mL∶g),提取温度60 ℃,该条件下绿原酸得率为2.446 1%。降血糖实验结果表明,杜仲叶茯砖茶绿原酸对α-胰淀粉酶和α-葡萄糖苷酶的活性均有一定的抑制作用,因此,经常饮用杜仲叶茯砖茶可以起到降低餐后血糖和糖化血红蛋白水平、减低血糖值波动、防治糖尿病有关并发症的作用。此外,杜仲叶茯砖茶绿原酸还具有较强的抗氧化活性,其对DPPH自由基的清除作用以及铁还原力均高于Vc。
