分子改造提高谷氨酰胺转氨酶的催化活性
2018-10-17任蕊蕊刘松李江华堵国成陈坚
任蕊蕊,刘松*,李江华,堵国成,陈坚
1(江南大学 生物工程学院,江苏 无锡,214122)2(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122)
谷氨酰胺转氨酶(EC 2.3.2.13, Transglutaminase, TGase),可以催化肽链中的谷氨酰胺残基中的γ-羧酰胺基与酰基受体发生转酰基反应,从而使蛋白质或多肽之间发生共价交联[1]。TGase在食品加工领域的应用广泛,比如,TGase可使蛋白质与必须氨基酸(如赖氨酸)交联,提升缺少该必须氨基酸的肉制品等食品的营养价值[2]。TGase可以改善肉制品的特性,比如持水性、黏性、乳化稳定性,减少储藏损失和烹饪损失[3]。此外,TGase在生物技术研究和医药[4-7],纺织业[8]及皮革加工[9]等领域均有广泛的应用。
由于催化活性不高,较高的应用成本导致TGase在工业应用上受到了一定的限制[10]。YOKOYAMA等[11]通过对其活性中心Cys64附近氨基酸进行随机突变,在151种突变体中获得了34个正向突变;对整个成熟区氨基酸进行随机突变,在24 000个突变体中获得了10个正向突变。随机突变需要大规模的筛选,获得正向酶突变体的时间较长。随着生物信息学的发展,部分软件已经可以通过蛋白质的结构计算氨基酸突变能(如Discovery Studio[12-13]等),预测能影响酶蛋白与其底物复合物相互作用的关键氨基酸位点,进而对其突变,提高酶与底物的亲和力。
本研究通过Discovery Studio 2017软件分析,预测了能提高茂源链霉菌(Streptomycesmobaraense)TGase与其底物α-N-CBZ-GLN-GLY亲和力的氨基酸位点,通过定点突变获得了酶活和催化活性提高的突变体,为发酵法制备pro-TGase提供了潜在工业化生产菌株。
1 材料与方法
1.1 材料与试剂
菌株与质粒:表达质粒pINA1297、宿主解脂耶氏酵母Yarrowialipolyticapo1h来源于本实验室前期构建保存[14]。pINA1297/TGase为作者实验前期构建。
种子培养基(YPD,g/L):酵母膏 10,蛋白胨 20,葡萄糖 20。
筛选培养基(酵母基础氮源培养基,YNB,g/L):YNB 6.7,葡萄糖20。
固体培养基则是在液体培养基中加2%的琼脂。
发酵培养基(g/L):甘油 15,酵母膏 20,氯化铵2.64,KH2PO40.32,无水MgSO40.25,VB13.34×10-4,调pH至8.0。
酶、试剂、引物和DNA序列测定:限制性核酸内切酶购自Thermo Fisher Scientific公司,胶回收试剂盒和Competent Cell Preparation Kit试剂盒购自Takara(大连)公司,Bradford蛋白浓度测定试剂盒购自碧云天公司。引物合成和DNA测序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 软件分析
利用Discovery Studio 2017软件(BIOVIA,美国)的虚拟氨基酸突变模块进行计算突变后的酶与wild type的结合自由能差值[ΔΔGmut=ΔGbind(mut)-ΔGbind(WT)]。利用在线服务器SWISS-MODEL (http://swissmodel.expasy.org/),以S.mobaraenseTGase(PDB,1iu4,与本研究中TGase的氨基酸序列完全一致)为模板,利用构建了TGase及其突变体的模拟结构。利用PIC在线服务器分析TGase及其突变体分子内作用力的变化。
1.2.2 定点突变基因的克隆和重组质粒的构建
以StreptomycesmobaraenseTGase基因组DNA为模板,P1和P2,P3和P4,P1和P5(表1)为引物进行PCR,通过PCR扩增得到含有Y24W、E300W、Y302R的突变基因片段。PCR产物经DpnI消化后,分别进行胶回收。

表1 基因克隆及定点突变引物Table 1 Primers used for gene cloning and site-specific mutagenesis
以质粒pINA1297/TGase为模板,以上述回收产物为大引物,分别进行大引物PCR获得定点突变的表达载体片段。PCR产物经DpnI消化后进行胶回收。回收产物转入大肠杆菌JM109感受态中,菌落PCR后挑选1~2个转化子交由上海生工生物工程有限公司进行测序。测序成功,则说明上述突变基因成功整合到质粒pINA1297(hp4d,ura3d4,XPR pre,XPR2t)上,质粒pINA297/Y24W、pINA297/E300W和pINA297/Y302R构建成功。
1.2.3 解脂耶氏酵母的转化与重组子的筛选
将构建的重组质粒pINA1297/Y24W、pINA1297/E300W、pINA1297/Y302R,分别经快切酶NotI酶切后,胶回收得到相应的线性化质粒。然后用醋酸锂转化法转化Y.lipolyticapo1h感受态[15],质粒通过zata整合位点将突变基因整合到Y.lipolyticapo1h(Ura-,ΔAEP,ΔAXP,Suc+)基因组中。整合成功的Y.lipolyticapo1h会使其从尿嘧啶(ura)缺陷型菌株转化为非缺陷型菌株。通过缺乏ura的YNB培养基28 ℃,培养3~6 d后,获得重组菌Y.lipolyticapo1h/Y24W、Y.lipolyticapo1h/E300W、Y.lipolyticapolh/Y302R的阳性转化子。
1.2.4 pro-TGase的表达
选取10~15个重组菌的阳性转化子,接种于YPD液体培养基中,于28 ℃,200 r/min的摇床中培养24 h。将种子液以10%的接种量转接于发酵培养基中,28 ℃,200 r/min摇瓶培养120 h。
1.2.5 pro-TGase的纯化方法
采用强阳离子纯化柱Fractogel EMD SO3-进行纯化,具体参考刘松等[16]所述的方法。
1.2.6 浓度的测定
蛋白质浓度测定采用Bradford蛋白浓度测定试剂盒,具体按说明书操作。
1.2.7 动力学常数的测定
在底物质量浓度为0~30 mg/mL范围内设定浓度梯度,均按1.2.6中所述的方法测酶活,通过双倒数作图法计算可得动力学参数Km值。
1.2.8 半衰期检测
将纯化后TGase及其突变体稀释到同一浓度,放置于55 ℃水浴保温120 min,每15 min取1次样测TGase酶残余活力。蛋白的半衰期(t1/2)可通过作活力-时间的关系图解得。
1.2.9 最适反应温度的检测
测定纯化后的TGase在20~70 ℃(20、30、37、50、55、60、70 ℃)下的酶活,分析TGase及其突变体的最适反应温度。
1.2.10 最适反应pH及pH稳定性的检测
在37 ℃条件下,测定不同pH值底物条件下的酶活,分析TGase及其突变体的最适反应pH。将样品用不同pH值的缓冲液值稀释至pH3.0~10.0,37 ℃保温1 h后测残余酶活,分析TGase及其突变体在不同pH下的稳定性。
2 结果与分析
2.1 突变位点的确定
运用Discovery Studio 2017软件的分子对接模块,构建S.mobaraenseTGase[17]与其底物α-N-CBZ-GLN-GLY的复合物。再利用该软件的虚拟氨基酸突变模块,对TGase的所有氨基酸进行丙氨酸扫描,基于突变能变(ΔΔGmut)分析影响其与底物α-N-CBZ-GLN-GLY亲和力的关键氨基酸[12]。一般认为,ΔΔGmut值是负值就表明突变后能量下降,结合更稳定,酶对底物亲和力提高;反之就表明突变后能量上升,酶对底物亲和力下降[12]。基于此,选取ΔΔGmut值最小的8个关键氨基酸分别进行虚拟氨基酸饱和突变,根据预测结果,选取ΔΔGmut降低的3个突变体(Y24W、E300W和Y302R)进行突变验证(表2)。

表2 S. mobaraense TGase突变体突变能分析Table 2 Partial amino acids with reduced mutation energy in S. mobaraense TGase
2.2 TGase突变体在Y. lipolytica 中的表达与纯化
前期研究发现,TGase前导肽对其正确折叠和分泌有重要影响[18],在异源宿主中通常以酶原pro-TGase形式表达,通过体外添加活化蛋白酶切割其前导肽下得到成熟TGase[19]。本研究在Y.lipolytica中,以酶原形式表达分泌pro-TGase及其突变体,表达质粒结果如图1所示。
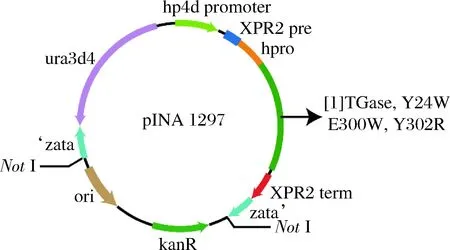
图1 TGase及其突变体质粒示意图Fig.1 The plasmids map of TGase and its mutants注:[1]为TGase,Y24W,E300W或Y302R基因在质粒pINA1297中所处的位置
重组菌摇瓶发酵培养,取其发酵上清液,经dispase活化后测TGase酶活。经检测重组菌Y24W、E300W、Y302R的最高酶活分别为0.916、16.99、0.635 U/mL,出发菌株pro-TGase的酶活为11.7 U/mL。结合SDS-PAGE图,发现E300W较野生酶的酶活和表达量均有提高;Y24W和Y302R的酶活和表达量均大大降低(图2)。
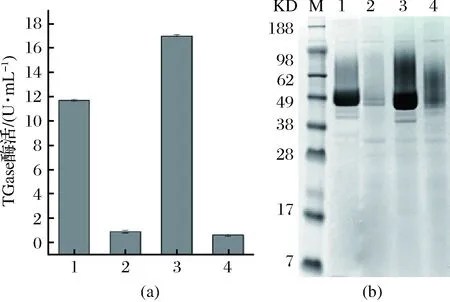
M-Marker;1-pro-TGase;2-Y24W;3-E300W;4-Y302R图2 TGase及其突变体酶活(a)与对应重组菌的发酵上清SDS-PAGE分析图(b)Fig.2 The enzyme activity of TGase and its mutants(a),and SDS-PAGE analysis of the corresponding fermentation supernatant(b)
通过强阳离子交换柱Fractogel EMD SO3-进行纯化。SDS-PAGE分析显示(图3),纯化后的pro-TGase及突变体条带出现了3条带,且其实际分子质量大于理论分子质量(43 kDa)的条带脱尾。通过CBS Net NGlyc 1.0 Server在线服务网站(http://www.cbs.dtu.dk/services/Net NGlyc/)预测了TGase基因中的N-糖基化位点(图4),发现N282和N297两个位点是TGase的潜在糖基化位点。故出现上述结果的原因可能是酶表达后发生了不同程度的糖基化[14]。

M-Marker;1-pro-TGase;2-Y24W;3-E300W;4-Y302R;5-用糖苷酶Endo H酶处理过的pro-TGase;6-Endo H图3 pro-TGase及其突变体纯化后SDS-PAGE分析Fig.3 The SDS-PAGE analysis of pro-TGase and its mutants after purification

图4 TGase中糖基化位点预测结果Fig.4 Potential glycosylation sites in TGase
2.3 突变对酶反应动力学的影响
将纯化后的pro-TGase及其突变体用dispase处理,转化为成熟TGase及对应的突变体,进行酶反应动力学分析。与野生酶相比,突变体E300W的比酶活提高了31%;Y24W和Y302R的比酶活分别下降63%和78%。突变体Y24W、E300W和Y302R的Km值分别上升了15%、10%和18%,说明突变会不同程度的影响酶与底物的亲和力。突变体E300W的kcat值提高了42%;另外2种突变体均有下降。突变体E300W的kcat/Km值提高了29%,酶的催化效率提高;Y24W和Y302R的kcat/Km值分别降低了68%和81%,酶的催化效率降低。与野生酶相比,Y24W、E300W和Y302R在55 ℃下的半衰期t1/2均降低。
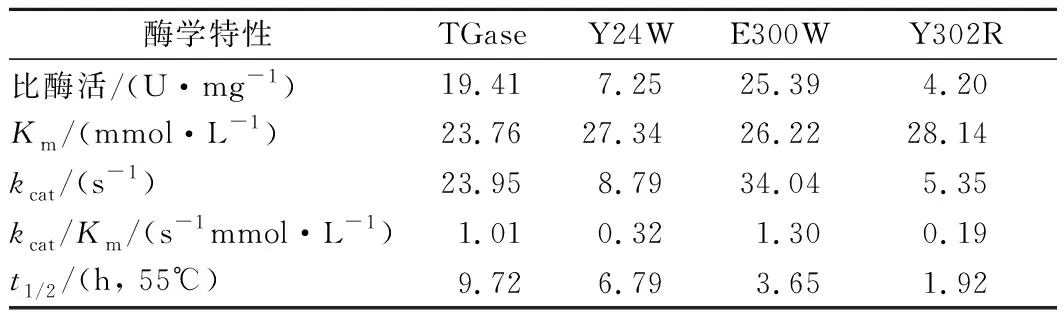
表3 TGase及其突变体酶学特性Table 3 Enzyme properties of TGase and its mutants
2.4 最适反应温度的研究
对TGase及其突变体进行最适反应温度的研究。研究发现,Y24W、E300W、Y302R及TGase在20~70 ℃的酶活变化情况基本一致,最适反应温度都是55 ℃(图5)。低于55 ℃时,随温度升高,TGase酶活缓慢上升;高于55 ℃时,随温度升高,TGase酶活下降。反应温度在50~60 ℃范围内酶的催化效率均是最高酶活的75%以上;反应温度为70 ℃时,酶的催化效率仍是最高酶活的20%以上。
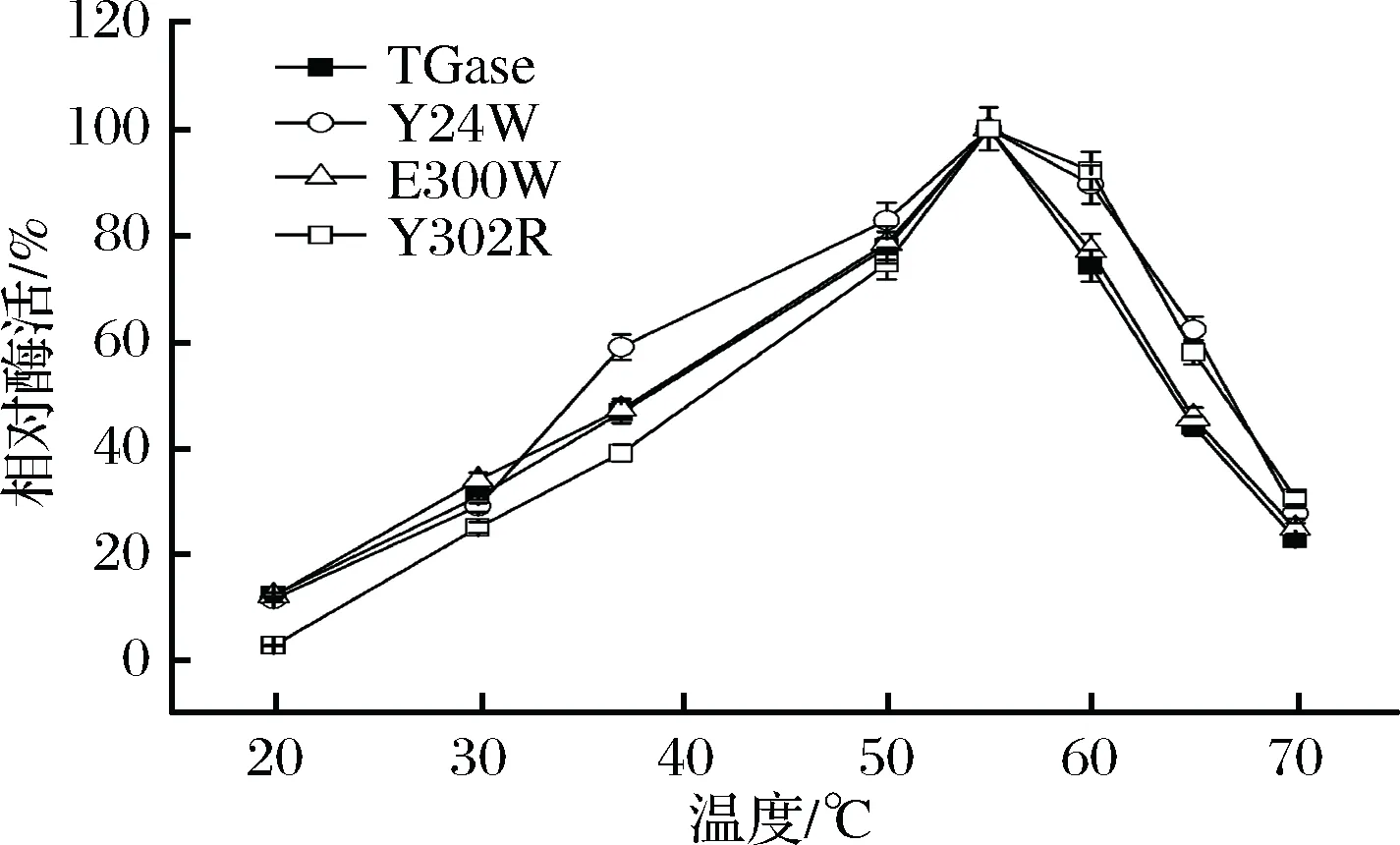
图5 TGase及其突变体的最适反应温度Fig.5 The optimum temperature of TGase and its mutants
2.5 最适反应pH和pH稳定性的研究
对TGase及其突变体进行最适反应pH的研究。结果显示(图6-a),TGase及其突变体的最适反应pH均为7.0。低于最适反应pH时,TGase活性随pH增加而缓慢增加;高于最适反应pH时,TGase活性随pH增加而缓慢下降。突变体Y302R在pH 3.0~10.0范围内相对残余酶活均在48%以上。
对TGase及其突变体进行pH稳定性的研究。结果显示(图6-b),Y24W、E300W、Y302R及TGase的pH稳定范围均为5.0~9.0。TGase及其突变体在pH 6.0~8.0范围内的相对残余酶活均大于75%,在pH 5.0~9.0范围内的相对残余酶活均大于50%。pH低于5.0或高于9.0后,酶活急剧下降。
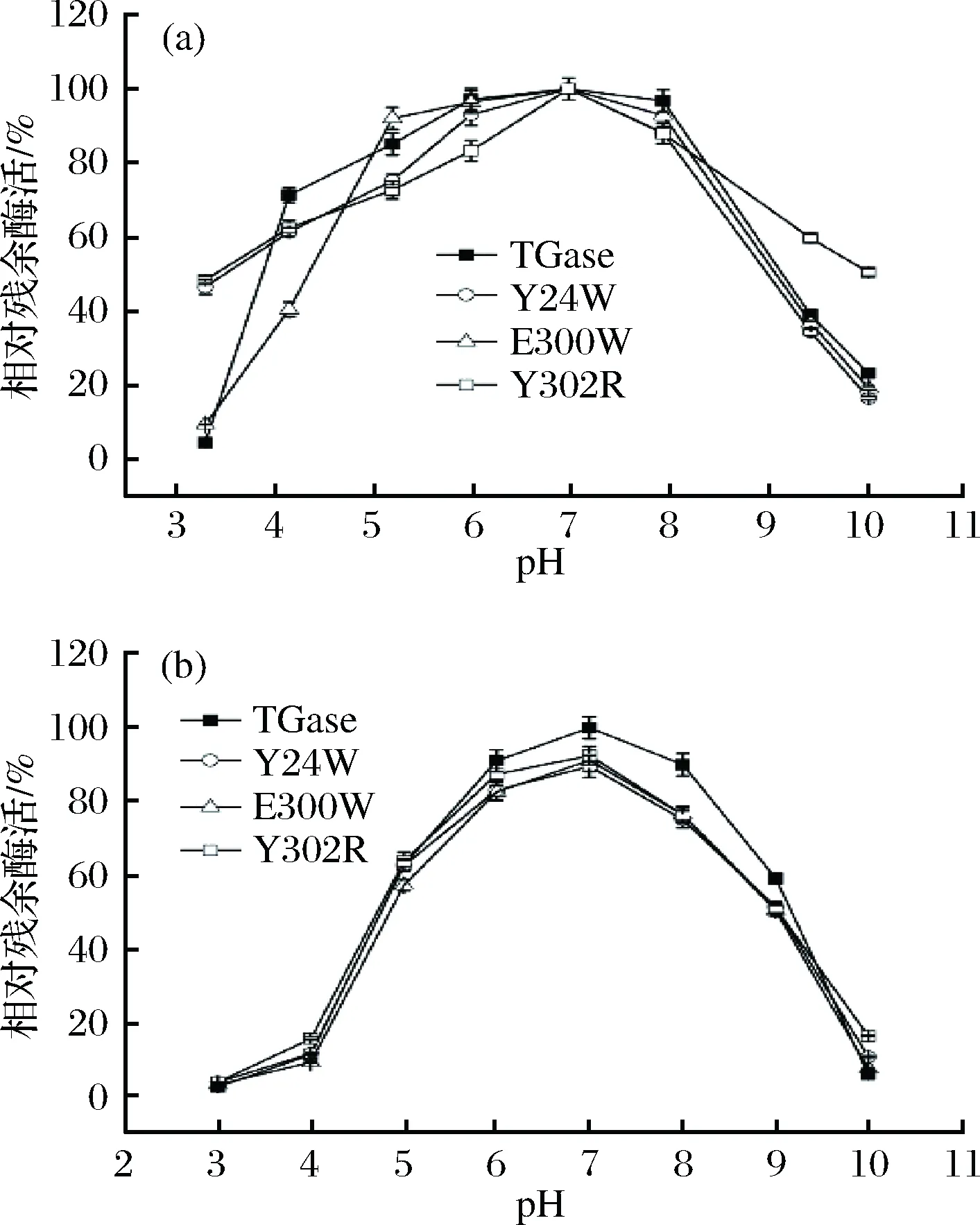
图6 TGase及其突变体最适反应pH(a)和pH稳定性(b)Fig.6 The optimum pH (a) and the pH stability (b) of TGase and its mutants
2.6 催化效率和稳定性机制分析
研究表明,蛋白质分子内作用力的种类和数量对酶分子的催化效率和热稳定性有重要影响[20]。为解析E300W催化效率提高的机制,TGase分子的催化活性基团Cys64、Asp255和His274均位于分子裂缝的底部[17](图7)。TAGAMI等[21]通过分子对接实验模拟了TGase与底物CBZ-Gln-Gly的结合方式,显示CBZ-Gln-Gly在分子裂缝中被拉伸,活性位点通过疏水相互作用与底物结合。YOKOYAMA等[11]研究显示分子正面(Tyr75Phe,Gln74Ala,Thr77Phe等)及背面(Arg26Phe,Ser299Leu,Ser303Phe等)的疏水性氨基酸取代突变可提高TGase催化活性。与上述报道一致,在本研究中,TGase第300位氨基酸残基位于分子背面且与裂缝区域临近,且由野生酶的Glu突变为疏水性更强的Trp,酶的催化活性提高。然而,E300W底物亲和力较野生酶有轻微下降,而酶转换数显著提高。基于突变位点的位置特点,E300W中的亲核攻击能力可能得到了加强,进而提高了酶的催化活性[21]。
为解析TGase突变体稳定性变化的机制,利用PIC在线服务器分析了TGase及其突变体分子内作用力的变化(表5)。结果显示,与TGase相比,Y24W、E300W和Y302R的主链-主链氢键分别减少1、2、4个;Y24W、E300W和Y302R分子在的氢键分别增加3、0和1个。因此,主链-主链氢键的减少可能是造成TGase及其突变体稳定性下降的重要原因。
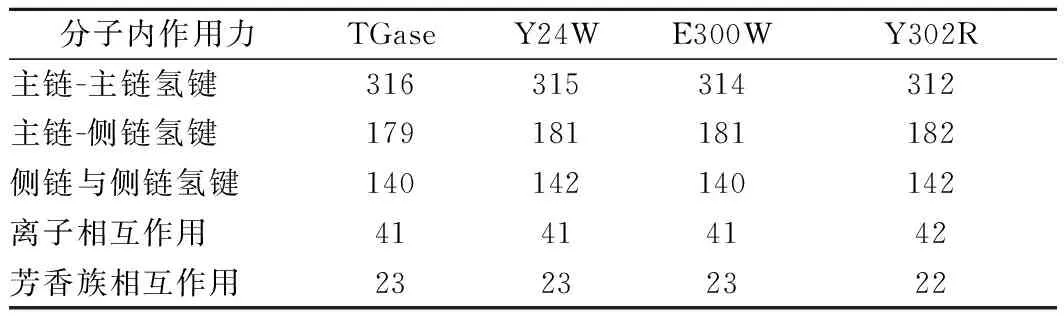
表4 TGase及其突变体分子内相互作用力分析Table 4 Interactions potentially involved in the stability of TGase and its mutants

图7 TGase(a)及E300W(b)三维结构图Fig.7 The model structure of TGase (a) and E300W (b)(注:蓝紫色部分表示催化三联体,黄色部分表示TGase和E300W的第300位氨基酸。)
3 结论
本研究利用Discovery Studio2017软件,通过对TGase及其配体复合物进行基于相互作用力的虚拟氨基酸突变,预测了能提高亲和力的氨基酸突变目标Y24W、E300W、Y302R。实验证明突变体E300W酶活、比酶活和催化活性分别比野生TGase提高45%、31%和29%;Y24W、Y302R的酶活、比酶活和催化活性降低。上述结果表明,TGase第24、300、302位氨基酸是影响TGase结构的关键氨基酸。值得注意的是,上述突变导致酶稳定性在不同程度下降。下一步研究中,可以对上述3个位点进饱和突变及组合突变,以期获得高催化活性和高稳定性的TGase。此外,E300W到在重组Y.lipolyticapo1h中的产量达到16.99 U/mL,较野生酶(11.7 U/mL)表达水平明显提高,可作为替在工业生产菌株。
