两性双子表面活性剂的合成及其耐蚀性
2018-10-16
(武汉职业技术学院 生物工程学院,武汉 430074)
阳离子表面活性剂在众多的表面活性剂中最为常见,虽然产量不足所有表面活性剂的10%,但产品种类繁多,应用领域非常广泛。除具有一般表面活性剂的基本性质外,阳离子表面活性剂中的活性组分溶于水后会发生电离带正电,因而会表现出一些特殊的物理化学性能[1-4]。例如,阳离子表面活性剂与纤维、塑料、金属及其氧化物、硅酸盐以及生物细胞组织等固体表面可产生较强烈的物理化学吸附作用,在表面(界面)可形成紧密的单分子层,致使表面(界面)具有强烈的疏水性[5-9]。
当前,限制双子表面活性剂大规模应用的主要原因是原料昂贵、合成条件要求高,真正实现工业化生产的产品只有几种[10-14]。目前的研究多集中于阳离子型双子表面活性剂,而关于柔性联结基连接的两性双子表面活性剂的报道较少,尚处于实验室研究开发阶段。通常鲜少使用某双子表面活性剂对金属进行防腐蚀,实践证明,将两性离子表面活性剂与离子型双子表面活性剂复配后,能改变溶液的某些性质,使其防腐蚀性能更好[15]。赵景茂等[16]采用氯丙醇、十二烷基二甲基氯化铵等原料通过酯化反应、还原反应等合成了一系列含有羟基的双子表面活性剂:1,3-双(十二烷基二甲基氯化铵)-2-丙醇(12-3OH-12)、1,3-双(十四烷基二甲基氯化铵)-2-丙醇(14-3OH-14)、1,3-双(十六烷基二甲基氯化铵)-2-丙醇(16-3OH-16)以及1,3-双(十八烷基二甲基氯化铵)-2-丙醇(18-3OH-18)等物质,结果表明,所合成的几种物质的缓蚀效果由强到弱依次为:14-3OH-14>12-3OH-12>16-3OH-16>18-3OH-18。其中,12-3OH-12和14-3OH-14都表现出很好的缓蚀效果,缓蚀率均达到95%以上。LING等[14]研究温度及体系中有无氯离子对双子表面活性剂在硫酸溶液中缓蚀性能的影响。结果表明,随着试验温度的升高,其缓蚀作用呈减弱趋势;双子表面活性剂和氯离子的复配作用呈现明显的协同作用,与单一使用双子表面活性剂相比,双子表面活性剂复配氯离子具有高效、经济的优点。
本工作以脂肪伯胺与二卤代乙醚首先合成中间体N,N′-二烷基-3-氧杂-1,5-戊二胺,再与卤代羧酸反应得到目标产物两性双子表面活性剂N,N′-二烷基-N,N′-二羧酸基-3-氧杂-1,5-戊二胺,使用双子表面活性剂与其他具有防腐蚀性能的物质进行复配,对目标产物双子表面活性剂的防腐蚀性能进行了测定。
1 试验
1.1 双子表面活性剂的合成
1.1.1 制备中间产物N,N′-二烷基-3-氧杂-1,5-戊二胺
称取50 g十二伯胺(0.27 mol,分析纯级)、19.32 g十六伯胺(0.27 mol,分析纯级)、二氯乙醚(0.13 mol,分析纯级)、1.6 g四丁基溴化铵(0.005 mol,分析纯级)溶于100 mL甲苯中制成溶液,然后加入带有机械搅拌、温度计、冷凝装置的1 000 mL四口烧瓶中,升温至75 ℃,将10.80 g NaOH溶于100 mL水中制成溶液,滴液漏斗滴加约0.5 h,滴加完毕后继续回流搅拌4.5 h,反应完毕后在分液漏斗中分层,甲苯萃取水层并合并至有机相,有机相水洗至中性、 无水氯化钙干燥,减压蒸馏除去溶剂得到淡黄色固体中间体N,N′-二烷基-3-氧杂-1,5-戊二胺,合成路径见图1。

图1 中间体的合成路径Fig. 1 Synthesis pathway of mtermeatiale
1.1.2 制备目标产物N,N′-二烷基-N,N′-二羧酸基-3-氧杂-1,5-戊二胺
称取18.9 g氯乙酸(0.2 mol,分析纯级)与16 g NaOH(0.4 mol,分析纯级)溶于250 mL水中,加入到带有机械搅拌、温度计、冷凝装置的1 000 mL四口烧瓶中,加入24 g N,N′-二烷基-3-氧杂-1,5-戊二胺以及1.6 g四丁基溴化铵(0.005 mol),搅拌升温至反应温度80 ℃,连续反应6 h。反应完成后,减压蒸馏除去大部分水,调节pH至2左右,析出固体,过滤洗涤得到黄色固体沉淀物,即是目标产物新型两性双子表面活性剂N,N′-二烷基-N,N′-二羧酸基-3-氧杂-1,5-戊二胺:GBCS12-2(a),GBCS12-6(b)。

(a) GBCS12-2

(b) GBCS12-6图2 两性双子表面活性剂的合成路径Fig. 2Synthetic pathway of amphoteric gemini surfactant
1.2 试样及溶液
试验材料为Q235钢,采用线切割将材料切割成尺寸为1 cm×1 cm×1 cm的试样,用砂纸逐级打磨试样表面至表面呈光亮镜面,经丙酮除油,去离子水清洗后,置于干燥皿中备用。其中,电化学试验用试样的工作面积为1 cm2。
分别配置nGBCS12-2∶nGBCS12-6=2∶1(1号表面活性剂),1∶1(2号表面活性剂),1∶2(3号表面活性剂)的双子表面活性剂,将其加入到1.0 mol/L盐酸溶液中,缓蚀剂加入量为20×10-6,30×10-6mol/L。
1.3 试验方法
将试样置于含不同表面活性剂的1.0 mol/L盐酸溶液中浸泡7 d,然后去除试片表面腐蚀产物,按照失重法计算缓蚀率。采用TESCAN扫描电子显微镜观察试样表面腐蚀形貌。电化学试验在上海辰华仪器公司生产的CHI660B型电化学工作站上完成,采用三电极体系,工作电极为试样, 参比电极为饱和甘汞电极(SCE),辅助电极为铂电极。极化曲线扫描范围为-0.6~0.5 mV(相对于SCE),扫描速率为1 mV/s。采用自腐蚀电位-时间曲线研究导电高分子膜对不锈钢在1 mol/L H2SO4溶液中的耐蚀性,电位扫描速率为0.002 V/s。电化学阻抗谱( EIS)测试频率范围为10-2~105Hz。正弦交流波信号的振幅为10 mV。试验温度为(25±2) ℃。采用zview软件对电化学阻抗谱结果进行拟合。
2 结果与讨论
2.1 失重法
由图3可见:单独使用双子表面活性剂GBCS12-2或GBCS12-6时,缓蚀效果不佳;复配使用GBCS12-2和GBCS12-6,缓蚀效果良好,随着缓蚀剂加入量的增大,其对试样的缓蚀作用越明显,当其使用浓度为30×10-6mol/L时,继续增加缓蚀剂的量,缓蚀率基本维持平稳,达到91%。由图3还可见:GBCS12-2与GBCS12-6的复配物质的量比为2∶1时,缓蚀效果最佳。
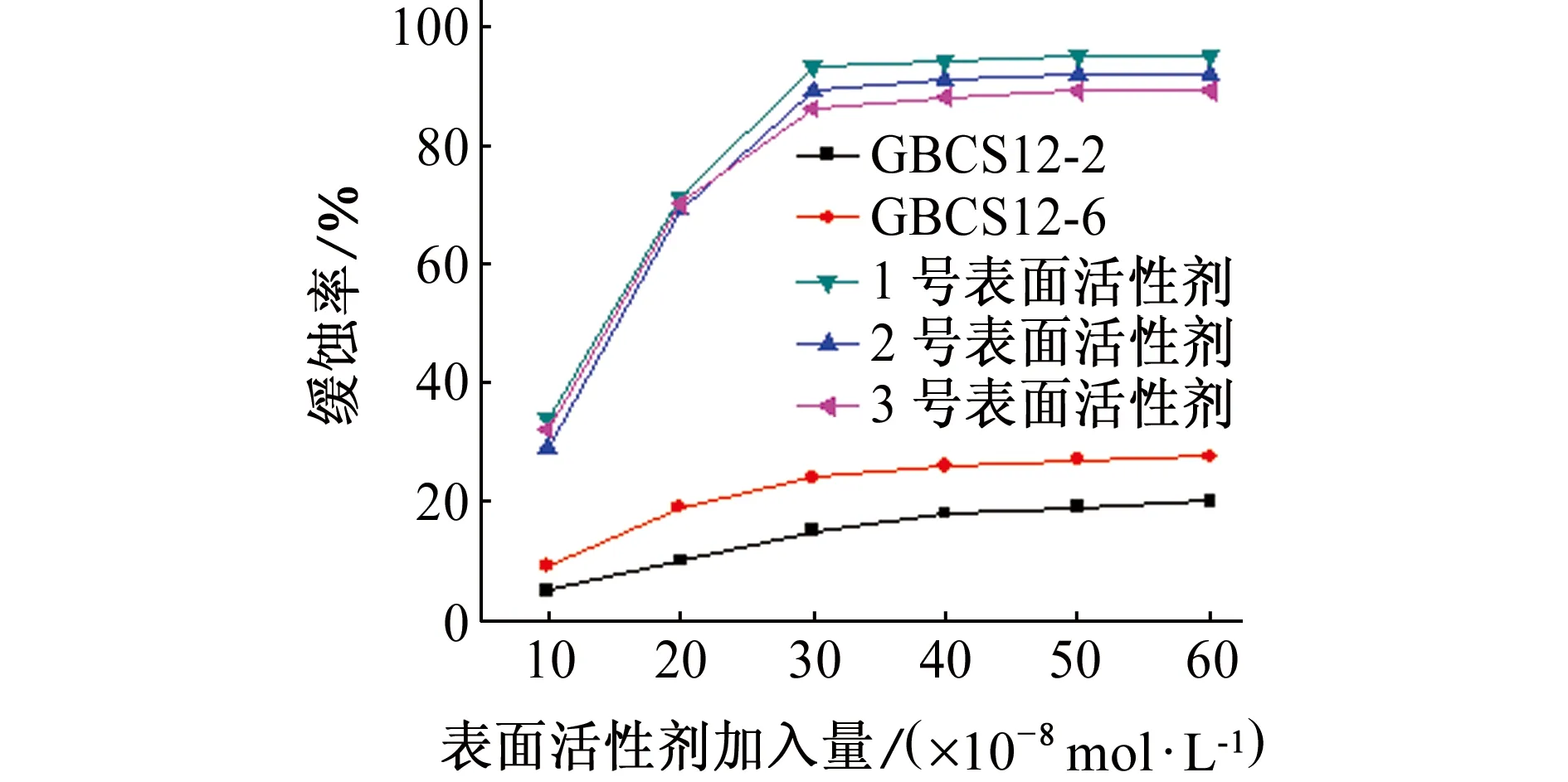
图3 不同量表面活性剂对试样在1.0 mol/L盐酸溶液中的缓蚀作用Fig. 3 Inhibition effect of surfactants with different content for samples in 1.0 mol/L HCl solution
2.2 电化学方法
2.2.1 极化曲线
由图4可见:在不含表面活性剂的1.0 mol/L盐酸溶液中,试样的阳极曲线显示有一段稳定的钝化区,即试样在此阶段呈现出典型的阳极钝化特征,这可能是因为试样表面生成一层保护膜,阻止试样表面与盐酸等腐蚀性介质的接触,使其免受腐蚀;加入复配表面活性剂后试样的自腐蚀电位(Ecorr)正移,腐蚀电流密度明显降低,且随着双子表面活性剂含量的增加,缓蚀效果增强。因此双子表面活性剂是一种典型的阳极抑制型缓蚀剂。由表1可见:试样在1.0 mol/L HCl溶液中的Ecorr最低,大约为-0.49 V,腐蚀电流密度最大,约为3.26×103μA/cm2。向体系中加入双子表面活性剂后,Q235钢自腐蚀电位Ecorr值变负,腐蚀电流密度明显降低。当双子表面活性剂的浓度为30×10-6mol/L时,其自腐蚀电位最小,并且n(GBCS12-2)∶n(GBCS12-6)=2∶1时,其腐蚀电流密度最小,为1.5 μA/cm2,即此时对Q235钢的保护作用最好。这一结果与失重法测得的结果相一致。
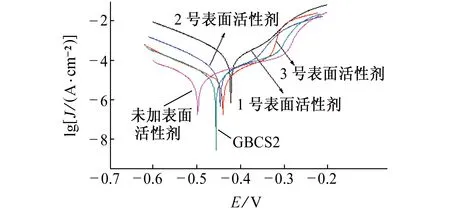
图4 试样在含不同表面活性剂(30×10-6 mol/L)的1.0 mol/L HCl溶液中的极化曲线Fig. 4 Polarization curves of samples in 1.0 mol/L HCl solution containing different surfactants (30×10-6 mol/L)
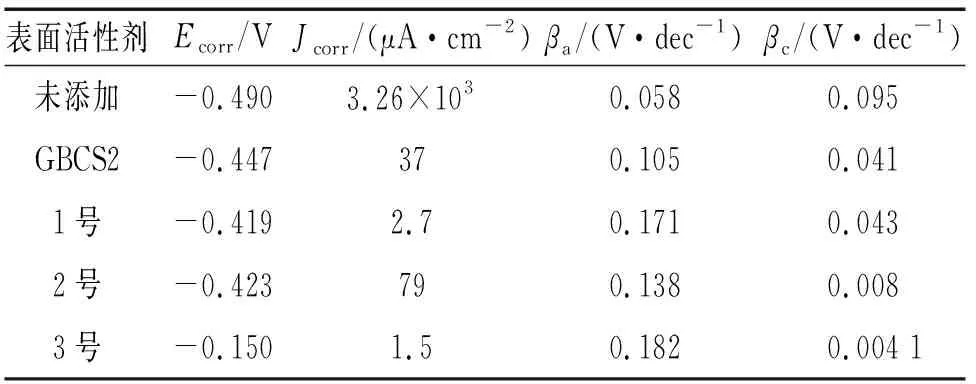
表面活性剂Ecorr/VJcorr/(μA·cm-2)βa/(V·dec-1)βc/(V·dec-1)未添加-0.4903.26×1030.0580.095GBCS2-0.447370.1050.0411号-0.4192.70.1710.0432号-0.423790.1380.0083号-0.1501.50.1820.004 1
2.2.2 电化学阻抗谱
由图5可见:几种曲线的形状大体相似,在不含表面活性剂的1.0 mol/L HCl 溶液中,容抗弧半径最小;溶液中加入30×10-6mol/L 3号表面活性剂后,Q235钢片的容抗弧半径最大,表明此时电化学电荷转移电阻最大,对Q235钢的保护作用最明显。
2.3 腐蚀形貌观察
由图6可见:试样在未加双子表面活性剂的盐酸介质中腐蚀较严重。盐酸中加入30×10-6mol/L 3号面活性剂后,试样表面形成了一层吸附保护膜,这也是双子表面活性剂在失重法、EIS和极化曲线中表现出优异的缓蚀效果的原因。

图5 试样在含不同表面活性剂(30×10-6 mol/L)的1.0 mol/L HCl 溶液中的电化学阻抗谱Fig. 5 EIS of samples in 1.0 mol/L HCl solution containing different surfactants (30×10-6 mol/L)

(a) 未添加(b) 添加3号表面活性剂图6 试样在不含和含有3号表面活性剂的盐酸溶液中浸泡7 d后的表面形貌Fig. 6 Surface morphology of the samples after soaking for 7 days in hydrochloric acid solution without (a) and with (b) No. 3 surfactant
2.4 吸附等温式
假定两性双子表面活性剂分子GBCS12-6在Q235钢表面的不完全吸附是导致Q235钢在盐酸溶液发生缓蚀的主要原因,并且在Q235钢表面的吸附行为符合Langmuir方程,根据Langmuir方程得出:
(1)
其中,
(2)
采用c/η对c作图,根据Langmuir方程,可以得到一条直线,其中直线的斜率为1,截距为1/K,并可根据方程式(2)可以计算出两性双子表面活性剂对Q235钢表面的吸附自由能ΔGads,见图7。

图7 两性双子表面活性剂η/(1-η)-c曲线图Fig. 7 The relation chart of η/(1-η)-c about Gemini amphoteric SAA
由图7可见:两性双子表面活性剂的η/(1-η)-c直线斜率为1.051 24,且η/(1-η)-c线性回归因子为0.999 98,这一结果充分说明两性双子表面活性剂分子在Q235钢表面的吸附是Q235钢在盐酸溶液缓蚀的原因,并且其在Q235钢表面的吸附行为符合Langmuir方程。
由两性双子表面活性剂公式计算得知,其K值大约为135 760.1,由公式(2)即可求出试样表面吸附自由能为-40.17 kJ/mol。两性双子表面活性剂在Q235钢表面的吸附既存在物理吸附又存在化学吸附,并且以化学吸附为主。
2.5 复配缓蚀机理
在酸性介质中,两种有机物复配,其缓蚀效果明显提高。这是因为有机胺在酸性水溶液中能与H+形成翁离子。翁离子是指含有未公用电子对元素的化合物,以其未公用电子对与H+形成配位键,从而使该元素的共价键值加1,并变成相应的翁离子。由于翁离子带有正电荷,因而它必须在带正电荷的金属表面才能很好地被金属所吸附。如果在介质中添加少量的活性阴离子,能使阳离子更容易吸附在金属表面,从而提高了缓蚀剂的吸附效果。
3 结论
以脂肪伯胺与二卤代乙醚首先合成中间体N,N′-二烷基-3-氧杂-1,5-戊二胺,再与卤代羧酸反应得到目标产物两性双子表面活性剂N,N′-二烷基-N,N′-二羧酸基- 3-氧杂-1,5-戊二胺,使用双子表面活性剂进行复配,同时对目标产物双子表面活性剂的防腐蚀性能进行了测定。结果表明:双子表面活性剂复配后,其缓蚀性能优于单独使用两性双子表面活性剂的。两性双子表面活性剂的复配比例(摩尔比)为2∶1时,Q235钢的腐蚀电流密度最小,为1.5 μA/cm2,容抗弧半径最大,缓蚀效果最好(缓蚀率可达91%);两性双子表面活性剂分子在Q235钢表面的吸附是Q235钢在盐酸溶液缓蚀的原因,并且其在Q235钢表面的吸附行为符合Langmuir方程, 吸附自由能为-40.17 kJ/mol, 既存在物理吸附,又存在化学吸附,并以化学吸附为主。
