有氧运动调控肥胖小鼠棕色脂肪组织炎症反应相关基因表达及通路的研究
2018-10-16付鹏宇龚丽景朱镕鑫梅涛胡扬
付鹏宇 龚丽景 朱镕鑫 梅涛 胡扬
北京体育大学(北京100084)
由脂肪细胞增大、过多堆积和分泌功能异常而诱发的肥胖往往会引起免疫细胞在脂肪处形成细胞浸润,并随着细胞因子的分泌将促炎因子释放给其它组织,加剧代谢紊乱[1],导致机体处于炎症状态,并由此引发糖尿病和心血管疾病。对肥胖机制的探索多以脂肪细胞为中心,其中脂肪组织又分为储存能量的白色脂肪组织(white adipose tissue,WAT)和燃烧脂肪酸(fatty acid,FA)以产热的棕色脂肪组织(brown adipose tissue,BAT)。而有氧运动不仅可以通过减少WAT的堆积,增强BAT的产热耗能以缓解机体的肥胖状态,也可通过降低WAT炎症细胞浸润[2]和循环系统中促炎因子的水平[3,4],改善肥胖所致的机体炎症反应。近来研究发现,BAT对肥胖诱导的炎症反应有较强的抵抗性[5]。那么有氧运动是否通过激活BAT中相关信号通路而调控肥胖机体的免疫细胞状态和炎症因子的分泌,以抑制肥胖所致的炎症状态?
mRNA表达谱芯片的原理是将被不同荧光分子标记的处理组及对照组样品与固定于载体芯片上已知序列的核酸探针进行杂交,通过计算两组杂交荧光信号强度的比值,来反应表达水平存在较大差异的基因[6]。并通过生物信息学处理,将差异表达基因进行分类(聚类分析)、功能注释(gene ontology,GO)[包括细胞组分(cellular component,CC)、分子功能(molecular function,MF)和生物学过程(biological process,BP)分析]和信号通路(Pathway)富集度统计分析,从而高效全面地探究某组织或细胞在干预前后基因变化的情况。虽有研究提示了BAT在抑制肥胖机体炎症状态的作用,但其中的免疫相关信号通路还未被系统研究过,且有氧运动对BAT免疫相关功能的影响也未被全面探究,因此mRNA表达谱芯片可作为探究此问题的一种研究手段。
综上,本研究通过mRNA表达谱芯片扫描正常与肥胖小鼠、有氧运动干预后肥胖小鼠的BAT,筛选差异表达基因、分析差异基因的生物功能和富集的炎症相关信号通路,以探究有氧运动通过调控BAT而发挥抵抗肥胖机体炎症反应的可能机制。
1 材料与方法
1.1 实验动物及分组
离乳雄性C57BL/6J小鼠30只,购于北京维通利华实验动物技术有限公司(许可编号:SCXK-(京)2015-0004)。所有小鼠均单笼饲养,在北京体育大学动物实验室[温度(22±2)℃,湿度40%~70%,光照12 h/天,许可编号:SYXK(京)2011-0034]内进行。本研究已获得北京体育大学运动科学伦理委员会批准(批准号:2015040)。
将30只小鼠随机分为普通饮食对照组(NC,n=8),喂以普通维持饲料(军事医学科学院大小鼠维持饲料);高脂饮食组(HD,n=22),喂以高脂饲料(含脂量40%kcal,美国Research Diet公司D12109C)。饲喂8周高脂饲料建立肥胖模型后(以HD组大于NC组平均体重的20%作为肥胖模型建立成功判断标准,淘汰未达标准个体),将HD组随机分为:肥胖安静对照组(HC,n=8)和肥胖运动组(HE,n=8),均继续饲喂高脂饲料。每周记录各组小鼠体重和摄食量。
1.2 运动方案
NC组和HC组小鼠不施加运动干预,自由饮食和饮水。HE组的运动方案设定为坡度0°,速度10 m/min,持续1 h的跑台训练,每天1次,每周6天,持续4周。
1.3 取材方法
动物干预4周后,禁食12 h,用2%戊巴比妥钠溶液以40 mg/kg剂量腹腔注射麻醉,心脏取血放于抗凝管内,4℃,3000转/min离心10 min,收集血浆。取肩胛处BAT,放入RNA later保存液而后置于4℃冰箱过夜后转置于-20℃冰箱保存。
1.4 血液生化指标测试
使用全自动生化分析仪(日立7020)测试血浆中甘油三酯(triglyceride,TG)、总胆固醇(cholesterol,CHO)和血糖(glucose,GLU)水平(试剂盒:中生北控0220、0180、0230)。
1.5 总RNA的提取和芯片的制备
采用AmbionmirVanamiRNA Isolation Kit提取BAT的总RNA,再采用NucleoSpin®RNA clean-up试剂盒(MACHEREY-NAGEL,Germany)对总RNA进行过柱纯化,最后用分光光度计定量,甲醛变性胶电泳质检。使RNA纯度(A260/280≥1.90)、总量(≥10µg)和完整性均满足表达谱芯片检测要求。将所提RNA逆转录为cDNA后进行KLENOW酶标记,而后纯化后抽干。标记的DNA溶于杂交液中[2X GExHyb Buffer(HI-RPM),25%甲酰胺],于45℃杂交过夜。杂交结束后清洗,玻片甩干后即可用于扫描。因C57BL/6J小鼠属于近交系实验动物,个体间遗传差异小[7],每组随机测试3只动物样本即可满足基因芯片统计学分析要求[8-10]。
1.6 芯片图像采集和数据分析
利用 Agilent公司的 Mouse(V2)Gene Expression Microarray,8x60K mRNA单通道表达谱芯片检测小鼠物种BAT基因表达情况,芯片由北京博奥晶典生物有限公司提供。芯片用Agilent G2565CA Microarray Scan⁃ner进行扫描,得到杂交图片,并将其转化为数字信号。原始数据输入GeneSpring GX软件中,对信号值进行归一化处理。错误检出率(false discovery rate,FDR)控制在5%以内,并以1.5倍标准[FC(abs)>1.5]筛选差异表达基因[8]。利用Cluster3.0软件对具有表达信号的基因进行聚类分析。采用SAM软件进行差异表达基因的分析,对所筛选的差异基因用DAVID软件(https://david.ncifcrf.gov/summary.jsp)进行功能注释(gene ontology,GO)和信号通路(Pathway)富集度统计分析。
1.7 统计学分析
所得数据采用SPSS 19.0统计软件进行分析。建模后3组体重数据采用单因素方差分析。运动后体重、血液生化指标和基因芯片数据采用HC组与NC组相比,HE组与HC组相比,各进行独立样本t检验[11]。结果用平均值±标准差表示。P<0.05表示显著性差异,P<0.01表示非常显著性差异。
2 结果
2.1 干预前后各组小鼠的体重和摄食量变化
各组小鼠初始体重无显著性差异(初始体重为8.2±0.1g);如表1示,饲喂8周高脂饲料构建的肥胖模型成功,HE组运动4周后体重显著低于HC组(P<0.05);与HC组相比,运动干预前后HE组每周平均摄食量没有显著差异(数据略)。

表1 干预前后各组小鼠体重变化情况(g)(n=8)
2.2 各组小鼠血清生化指标结果
HC组血清的TG、CHO和GLU水平均显著高于NC组(P<0.05);HE组的血清TG和CHO与HC组相比无显著性差异;HE组血糖水平显著低于HC组(P<0.05),如表2示。

表2 各组小鼠血清TG、CHO、GLU水平(n=8)
2.3 芯片结果
2.3.1 差异基因及GO分析
分析结果显示,HC组与NC组相比,发生上调的基因有802个,下调的基因有1157个;HE组与HC组相比,发生上调的有859个,下调的基因有576个。利用GO数据库(http://www.geneongoloty.org/)对差异基因进行分子注释分析,并根据生物学过程(biological pro⁃cess,BP)进行分类。与NC组相比,HC组上调差异基因种类主要涉及免疫系统进程、炎症反应和免疫应答等功能,下调种类主要涉及脂质代谢、氧化还原和磷酸化等功能;与HC组相比,HE组上调的差异基因主要涉及糖脂代谢过程和氧化还原过程等功能,下调种类主要涉及转录调节、凋亡过程和细胞周期等功能,见表3。根据差异基因所富集的生物过程和其差异倍数,代表性地选取了6个与炎症反应相关的关键差异基因:Mpeg1、Mmd、Ccl28、Il6ra、Tnfrsf1b、Lepr。HC较NC组出现显著性上调,且上调倍数达1.5倍的基因有Mpeg1、Mmd、Ccl28、Tnfrsf1b(P<0.05或P<0.01);HE较HC组出现显著性下调,且下调倍数达1.5倍的基因有Mpeg1、Mmd和Ccl28(P<0.05或P<0.01),见表4。
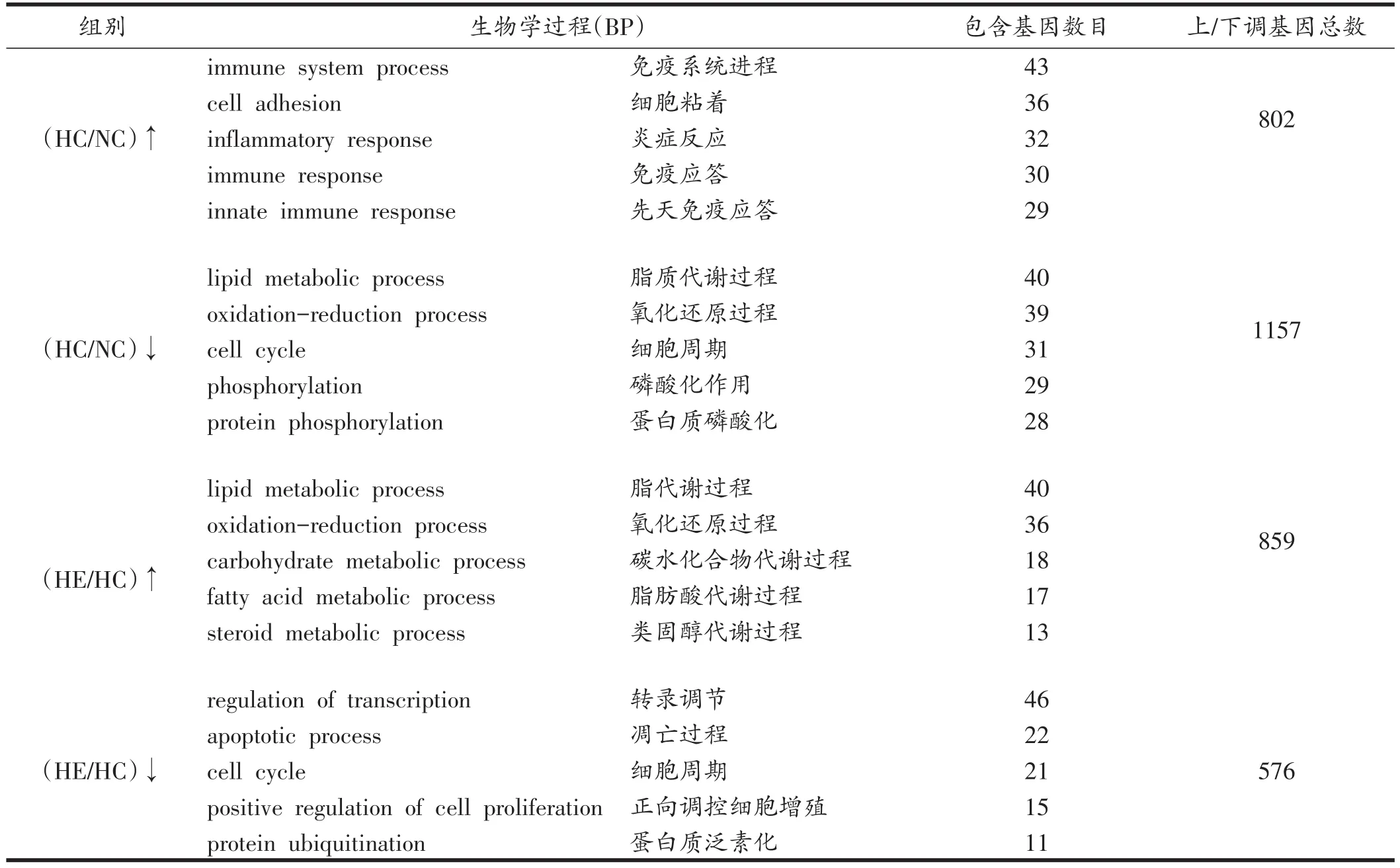
表3 差异基因所富集的主要生物学过程

表4 关键差异基因信息及差异倍数
2.3.2 差异基因的Pathway分析
利用 KEGG(Kyoto Encyclopedia of Genes and Ge⁃nomes)数据库分析差异基因所富集的信号通路(Path⁃way)。各组中发生显著上下调的通路如表5所示,HC组较NC组上调的通路有17条,其中关键的上调通路为Jak-STAT信号通路;下调的通路有11条,关键下调通路为胰岛素信号通路。HE组较HC组相比,上调的通路有8条,关键通路为胰岛素信号通路;下调的通路有7条,关键通路为Jak-STAT信号通路、ErbB信号通路和TGF-β信号通路。

表5 差异基因所富集的信号通路

注:1:Janus激酶/信号转导和转录激活子(Janus kinases/signal transducer and activator of transcription,JAK/STAT);2:V-Erb-B2禽红系细胞白血病病毒癌基因同源物(V-Erb-B2 Avian Erythroblastic Leukemia Viral Oncogene Homolog,ErbB);3:转化生长因子-β(Transforming growth factor-beta1,TGF-β)。表中显示的是各组的差异基因所富集的信号通路,其中↑表示上调,↓表示下调,下划线表示关键信号通路。
3 讨论
3.1 肥胖机体BAT中的炎症状态
本研究建立肥胖模型后,继续高脂膳食4周,HC组小鼠的体重和血脂血糖水平高于NC组。芯片结果也显示,HC组脂代谢水平显著降低,Ⅰ型糖尿病信号通路被激活;同时,肥胖会显著激活BAT中的炎症反应过程,提高了免疫系统进程、炎症反应和免疫应答功能,激活了白细胞跨内迁移、趋化因子信号通路、Jak-STAT信号通路等炎症反应相关通路。
激活的巨噬细胞浸润到组织中是诱发炎症反应的关键,而BAT拥有抑制巨噬细胞炎性特征的能力,WAT则表现出增强炎症反应的特点[5]。虽然,肥胖机体BAT炎症状态低于WAT,但仍高于正常机体[12]。本研究的芯片结果也证实了这一观点,肥胖机体Mpeg1表达增加,提示巨噬细胞浸润启动了BAT的慢性炎症过程,并刺激BAT释放IL-6、TNF-α和瘦素(分别对应Il6ra、Tn⁃frsf1b和Lepr基因)等促炎症因子,且BAT中具有诱导单核细胞向巨噬细胞转化功能的Mmd基因和趋化因子Ccl28基因[又称为粘膜相关上皮趋化因子(muco⁃sae-associated epithelia chemokine,MEC)][13,14]在肥胖机体中表达增加。另一方面,肥胖机体中炎性因子的上调反过来又会降低BAT的活性,炎症因子的释放和补体系统的激活会增加瘦素的分泌,而瘦素又会使促炎因子聚集至炎症部位,造成恶性循环。该过程还与自由基的生成有关,进而诱发BAT特异性基因的表达减少[15],降低BAT的活性。
3.2 运动调控BAT发挥抗炎作用
本实验4周有氧运动后,BAT中炎症反应相关基因Mpeg1、Mmd、Ccl28出现下调,且由肥胖所增加的诸如免疫系统进程、炎症反应和免疫应答等生物学过程及趋化因子、补体系统等信号通路未见继续上调;同时与促炎因子相关的Il6ra、Tnfrsf1b和Lepr6也出现下调。推测有氧运动通过激活BAT调控炎症反应的原因可能为:(1)运动可调控脂解速率:FA释放增加可刺激巨噬细胞的浸润[16],而BAT具有较高的β氧化能力,可以快速动员血液中的FA以供有氧运动时的能量消耗,以使局部FA释放入血的速率减慢[17];(2)运动可调控免疫细胞状态:运动可通过激活BAT提高其产热性能,诱导巨噬细胞处于静息状态,创造局部低炎性的细胞环境[5,18];同时运动所诱导的去甲肾上腺素等激素的增加可在重塑BAT免疫细胞(B细胞)的表型中发挥重要作用[19];(3)运动可调控炎症因子的分泌:运动通过提高交感神经兴奋性而抑制BAT中促炎因子瘦素的表达[15];(4)运动可改善氧化应激状态:肥胖机体活性氧(reactive oxygen species,ROS)的增多可促进炎症反应的进程[20],而规律的有氧运动可通过改善机体的糖脂代谢,促进BAT中氧化系统和抗氧化系统平衡以改善炎症状态[21]。
Pathway结果显示,运动干预后,机体多条炎症相关通路发生改变,以其中Jak-STAT、ErbB和TGF-β三条下调和Insulin一条上调的信号通路为例初步阐释运动通过调控BAT以发挥抗炎作用的可能机制。
3.2.1 ErbB信号通路
神经调节因子-1(Neuregulin1,NRG1)通过与表皮生长因子受体ErbB3/4结合,介导ErbB2受体的活化,进一步激活部分细胞外调节蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)和/或PI3K(Akt)通路而发挥促进血管新生等作用[22],而大量的新生血管可将促炎因子等转运至循环系统内,加剧机体代谢性病变的进程。ErbB2受体抑制剂PD168393可阻断NRG1-ErbB2信号通路以抑制炎症介质IL-1β的释放[23]。本研究显示,有氧运动通过下调BAT中ErbB信号通路(NRG-1→ErbB2→ERK/PI3K(Akt))而发挥抗炎的作用。
3.2.2 JAK-STAT信号通路
JAK-STAT3通路可在下丘脑被瘦素受体激活而调控糖脂代谢,促进BAT白色化,参与炎症反应及免疫应答[24,25]。IL-6与受体结合后激活JAK激酶而上调JAKSTAT通路[26]。细胞因子信号转导抑制因子-3(suppres⁃sor of cytokine signaling 3,SOCS-3)是JAK-STAT下游的基因,7周的游泳训练可降低SOCS-3 mRNA水平,预防瘦素抵抗的发生[27]。本研究结果中,运动干预后BAT中JAK-STAT信号通路及Il6ra、Lepr基因均出现下调,提示运动通过介导JAK-STAT信号通路(JAK→STAT3→SOCS-3)而激活了肥胖机体中BAT的抗炎作用。
3.2.3 TGF- β信号通路
转化生长因子-β(transforming growth factor-β,TGF-β)信号通路(TGF-β→Smad2/3)作为一条重要的细胞内信号转导途径,对免疫细胞具有多种生物学效应。TGF-β在炎症介质[IL、核转录因子kappa B(nu⁃clear factor kappa-light-chain-enhancer of activated B cells,NF-κB)]及ROS作用下被激活[28],通过自分泌或旁分泌调节巨噬细胞等免疫细胞的趋化、活化和生存,参与免疫反应进程。Smad是TGF-β/Smad信号通路中的自身负反馈调节信号[29],Smad3在TGF-β1介导抑制巨噬细胞活化中发挥重要作用,同时,也可单独发挥抑制巨噬细胞标记基因表达的作用。6周中等强度有氧运动可以有效抑制TGF-β经典(Smad依赖性)及非经典(MAPKs)通路[28]。本研究结果也显示有氧运动可通过下调BAT中TGF-β信号通路而抵抗炎症反应。
3.2.4 Insulin信号通路
肥胖机体血浆游离脂肪酸(free fatty acid,FFA)水平的提高,会导致代谢超负荷和脂质不完全氧化,累积的代谢产物神经酰胺(Ceramide)可激活蛋白磷酸酶2A去磷酸化抑制PKB/Akt,破坏Insulin信号通路[30]。其中,饱和FA作为一种炎症介质,可激活脂肪组织巨噬细胞中的NF-κB,刺激巨噬细胞趋化作用和增加IR水平[31]。有氧运动可显著改善机体的糖脂代谢状况,提高胰岛素敏感性,激活BAT活性以消耗肥胖机体过多的FFA,上调Insulin信号通路[(INS→IR(insulin recep⁃tor)→IRS(insulin receptor substrate)→PI3K→AKT/PKB)]而抵抗炎症状态。
4 结论
4周的有氧运动可通过调控BAT中Jak-STAT、ErbB、TGF-β和Insulin等信号通路及一系列生物学过程而发挥抵抗机体免疫细胞和促炎因子相关基因表达的作用,改善并增强BAT的抗炎作用,进而改善肥胖机体的炎症状态。
