UPF1在肺腺癌中的表达及其临床意义的研究*
2018-10-16孙蓓曹璐杨灵伊李玲妹刘昶煦黄秋娟王雅蕾齐丽莎曹文枫
孙蓓 曹璐 杨灵伊 李玲妹 刘昶煦 黄秋娟 王雅蕾 齐丽莎 曹文枫
肺癌是目前发病率最高的恶性肿瘤,是全球癌症相关死亡的主要原因。肺腺癌(adenocarcinoma,ADC)是原发性肺癌最常见的组织学类型。肺癌患者的5年生存率低于其他癌症患者,ADC发生的相关机制阻碍了肺癌的有效治疗[1]。获取治疗ADC的分子靶点,并进行靶向治疗是目前研究的热点。因此,研究ADC的特点及其恶化的机制具有重要意义。
无意义介导的mRNA降解(nonsense-mediated mRNA decay,NMD)是一种广泛存在于真核生物细胞中的mRNA质量监控机制。该机制通过识别和降解含有提前终止密码子(premature translational-termi⁃nation codon,PTC)的转录产物防止有潜在毒性的截短蛋白产生[2-3]。另外,在肿瘤研究中,NMD可通过靶向突变的基因蛋白发挥监管机制[4-6]。然而,NMD在肿瘤细胞营养缺乏和内质网压力高的情况下表达下调,说明肿瘤发生过程中可能抑制了NMD的发生[4]。NMD 的发生主要由UPF1、UPF2、UPF3、Y14、SMG1、SMG5、SMG6、SMG7等多种多肽发挥作用[7-8],而上游移码突变体1(up-frame shift mutant 1,UPF1)是NMD途径中的关键参与者[9]。并且,UPF1表达的上、下调可以决定NMD过程的激活或者抑制[8,10]。
本研究应用免疫组织化学方法测定150例ADC患者的UPF1表达情况,探讨UPF1的表达与ADC各个临床病理指标的关系,以及其表达与ADC患者整体生存期(overall survival,OS)与无病生存期(recu⁃nence-free survival,RFS)的关系,以期发现新的分子靶点,指导临床治疗。
1 材料与方法
1.1 病例资料
收集2011年1月至12月就诊于天津医科大学肿瘤医院未接受过化疗或放疗、临床病理及随访资料完整并且均经组织病理学证实的ADC患者150例。其中男性75例,女性75例。年龄<50岁21例,≥50岁129例。从未吸过烟的患者89例,有吸烟史61例。肿瘤直径<3 cm 72例,≥3 cm 78例。依照第8版AJCC分期,150例ADC患者中,TNMⅠ、TNMⅡ、TNMⅢ和TNMⅣ期分别为36、50、25和29例(表1)。本研究经过天津医科大学肿瘤医院伦理委员会批准。
1.2 方法
1.2.1 HE染色 将组织在10%中性缓冲的福尔马林中固定24 h,石蜡包埋,4 μm切片厚度,常规H&E染色。使用Olympus BX51显微镜观察。
1.2.2 免疫组织化学法(SP法) 1)载玻片预处理。2)UPF1表达检测:切片置于二甲苯60℃脱蜡2次。切片逐级乙醇脱水,PBS洗3次。抗原修复液修复后等待切片自然冷却,PBS洗3次。加一抗,阴性对照以PBS代替,4℃冰箱过夜,PBS冲洗3次;加生物素化二抗,37℃孵育30 min,PBS冲洗3次;加辣根过氧化物酶标记的链酶卵白素,37℃水浴箱孵育30 min。PBS冲洗3次;DAB显色,显微镜下控制显色;封片后光镜Olympus数码相机照相。阳性对照由abcam公司提供。3)结果判定在光镜下观察,细胞质内出现棕黄色颗粒的细胞为UPF1表达细胞。两位病理科医师独立对UPF1的表达进行评估。采用染色阳性细胞的染色强度和染色范围得分相乘评法,总分为0~6分。阳性细胞比例为(0%~25%)评分为0,阳性细胞比例为(26%~50%)评分为1,阳性细胞比例为(>50%)评分为2;不显色或显色模糊者评分为0(无染色),浅黄色者评分为1(弱染色),棕黄色者评分为2(中等染色),棕褐色者评分为3(强染色)。总分>0和≤3表示UPF1的低表达,总分≥4分为UPF1高表达,0分为UPF1阴性表达。
1.3 统计学分析
使用SPSS 22.0软件进行统计学分析。采用χ2检验评估UPF1的表达水平与不同临床病理特征(包含年龄、原发肿瘤大小、组织学类型、TNM分期、淋巴和远处转移等)之间的相关性。采用Kaplane-Mei⁃er分析UPF1的表达与生存期之间的关系。以P<0.05为差异具有统计学意义。

表1 150例ADC患者临床病理资料
2 结果
2.1 UPF1表达水平与ADC各临床病理参数之间的关系
免疫组织化学结果显示,UPF1在ADC组织的细胞质内表达,ADC组织中细胞质内出现棕黄色颗粒的细胞为UPF1表达细胞。如表2所示,150例ADC样本中,85例(56.9%)UPF1表达阴性或弱阳性,65例(43.1%)UPF1表达阳性。UPF1表达量与患者性别、年龄、是否吸烟或肿物大小无显著相关性,与组织学类型(P<0.001)、TNM分期(P=0.014)、淋巴结转移(P=0.016)和远处转移(P=0.035)密切相关。另外,在微乳头为主型样本中,UPF1均为阴性或低表达所占比例为100.0%(19/19);在实性为主型的组织中比例为69.6%(16/23),乳头状癌中为40.0%(4/10),伏壁型为51.1%(23/45),腺泡状癌为39.6%(21/53)(图1)。由此可见,在实性为主型和微乳头为主型的恶性程度较高的ADC类型中,UPF1低表达率显著高于其他组织学类型。此外,UPF1表达水平还与TNM分期有关。在45例(45/64,70.3%)晚期肿瘤(TNMⅢ和Ⅳ期)和42例(42/86,48.8%)早期肿瘤(TNMⅠ和Ⅱ期)患者中发现UPF1阴性表达或低表达。ADC出现淋巴结转移中,UPF1阴性表达或低表达占67.7%(42/62,67.7%);ADC出现远处转移中,UPF1阴性表达或低表达共占68.0%(31/45,68.0%)。UPF1阴性表达或低表达患者的淋巴结转移率(42/62,67.7%)和远处转移率(31/45,68.0%)远高于UPF1高表达患者(20/62,32.3%)和(14/45,31.1%)。150例病例中UPF1的表达情况与EGFR和K-RAS基因突变的关系如表2所示,UPF1高表达病例有41.2%(35/85,41.2%)发生EGFR基因突变;UPF1高表达病例中有4.70%(4/85,4.70%)发生K-RAS基因突变。UPF1蛋白的高低表达情况和EGFR基因突变(P=0.201)和KRAS基因突变(P=0.650)差异无统计意义。
2.2 UPF1的表达与ADC患者的生存期的关系
采用Kaplane-Meier分析UPF1的表达与患者生存的关系。UPF1的表达水平与患者的OS呈显著相关性,UPF1不表达或低表达的ADC患者OS远低于UPF1高表达的患者,UPF1低表达会显著缩短患者的OS(图2A)。UPF1的表达水平与患者的RFS存在显著相关性,UPF1不表达或低表达的ADC患者RFS远低于UPF1高表达的患者,UPF1低表达者RFS较短(图2B)。

图1 UPF1在不同类型ADC中的表达(SP×200)

表2 150例ADC患者临床病理特征与UPF1表达水平之间的关系
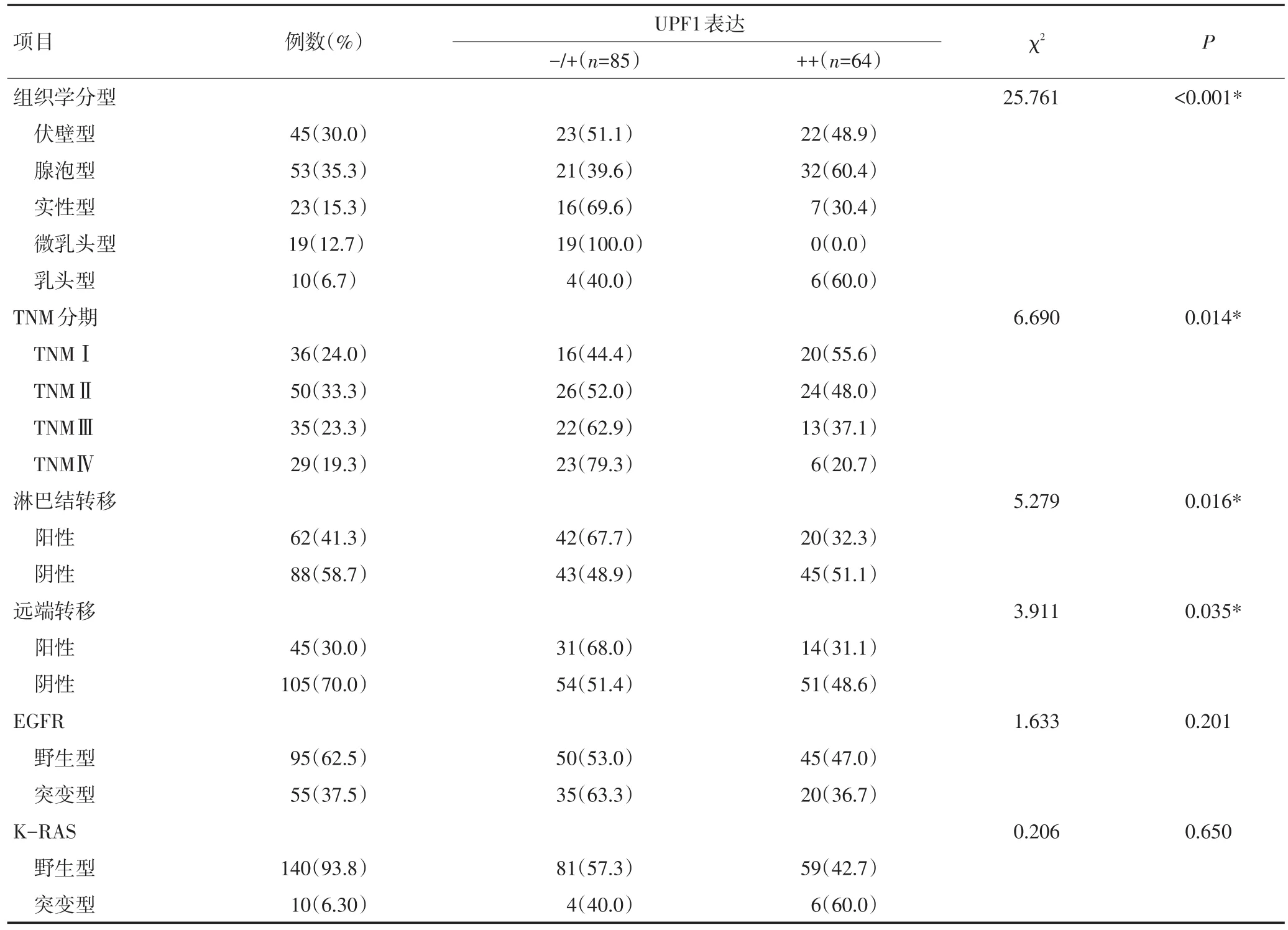
表2 150例肺腺癌患者临床病理特征与UPF1表达水平之间的关系(续表2)

图2 ADCUPF1高表达组和低表达组患者生存的比较
2.3 单因素及多因素分析
选取TNM分期、淋巴结转移、远处转移、UPF1表达和病理类型对150例ADC患者OS进行单因素和多因素分析发现。单因素分析中,TNM分期(P=0.029)、UPF1表达情况(P=0.009)以及伏壁型与微乳头型病理类型(P=0.021)差异具有统计学意义。选取以上进行多因素分析发现,UPF1表达情况(P=0.007)对患者生存有统计学意义(表3)。

表3 150例ADC患者OS单因素与多因素分析
3 讨论
ADC发病率近年来迅速上升,癌细胞转移是ADC治疗失败的主要原因。研究ADC发生和发展的分子机制是近年来ADC的研究热点[11-13]。NMD途径作为一种有效的mRNA降解机制,其核心分子UPF1表达的高低可以直接促进或抑制NMD的发生[4]。有报道称,UPF1在其他肿瘤中作为抑癌基因,其表达水平与肿瘤的发生、发展存在密切的相关性[14-15]。UPF1在肝细胞肿瘤和结直肠肿瘤中的研究较多,但在ADC中鲜见报道。
在本研究中,首先使用免疫组织化学分析了150例患者ADC组织样品,发现UPF1在ADC组织中的表达低于正常肺组织。此外,UPF1的表达与ADC的组织学类型(P<0.001)、TNM分期(P=0.014)、淋巴结转移(P=0.016)以及远处转移(P=0.035)有显著相关性,而与年龄、性别、是否吸烟及肿物大小无相关性。这些研究结果表明UPF1可能是一种潜在的肿瘤抑制基因,其在ADC进展过程中发挥重要作用。另外,本研究显示,UPF1低表达的ADC患者OS较其他患者更短,术后复发率更高,且其表达情况与ADC的病理类型、TNM分期、淋巴结转移及远处转移呈显著相关性。以上研究结果表明,UPF1可以作为ADC治疗及预后评估的参考指标,并且UPF1有可能成为新的ADC药物治疗靶点。
有研究发现,通过建立模拟肿瘤生存微环境如缺氧、营养缺乏、活性氧增加等,肿瘤细胞的UPF1表达被明显下调,NMD过程被抑制[13-15]。一些mRNA的表达上调,许多利于细胞适应这种恶劣环境的生物分子量增加[16]。反过来说,UPF1表达下调抑制NMD的过程,可能促进了肿瘤细胞对恶劣环境的适应能力。肿瘤生长过程中,瘤组织紊乱的供血系统会导致严重的缺氧,营养缺乏,另外肿瘤细胞的代谢会有活性氧的产生[17-18]。肿瘤细胞的生长经常处于低氧、营养缺乏的状态,猜测肿瘤细胞中的NMD过程可能经常处于被抑制状态。传统的ADC的治疗方法主要以手术及术后辅助治疗为主。随着对ADC发生、发展机理认识的不断加深,越来越多的研究集中于新的抑瘤靶点的发现及分子靶向药物的开发。
近年来,通过对EGFR等相关信号通路的研究及对EGFR酪氨酸激酶抑制剂(EGFR-TKIs)疗效及安全性的探索,证实了EGFR-TKIs在EGFR突变的肺癌患者中取得的确切疗效。K-RAS基因定位于人类染色体12p12.1,编码一种具有GTP酶活性的鸟嘌呤核苷酸结合蛋白,定位于细胞膜内侧,是EGFR功能信号的下游分子,在膜受体到腺苷环化酶信号传导中起重要作用,相关研究证实,K-RAS基因状态与EGFR-TKIs和抗EGFR单抗治疗ADC的疗效密切相关[16-18]。本研究分析了UPF1的表达和EGFR基因突变以及K-RAS基因突变的关系,发现UPF1的表达和EGFR基因突变两者之间差异无统计意义。关于EG⁃FR突变和K-RAS基因突变与临床病理参数及预后的关系的报道不一,这可能由检测方法不同、样本量大小不同等原因造成。EGFR突变以及K-RAS基因突变与患者UPF1表达的关系以及与患者预后的关系如何,仍需进一步的多中心临床随访研究。
作为NMD的关键调节因子,UPF1低表达可能使NMD在ADC组织中被抑制。这引起了临床对NMD如何在肿瘤组织中受到抑制从而使肿瘤恶化、进展的质疑,关于其中的机制还需要进一步研究。
