hrHPV DNA载量 分型和E6蛋白对宫颈癌前病变进展的预测作用*
2018-10-16张莉李佳瑶热米拉热扎克胡尚英徐小倩赵雪莲赵爽胡芳芳陈凤张询乔友林赵方辉
张莉 李佳瑶② 热米拉·热扎克 胡尚英 徐小倩 赵雪莲 赵爽 胡芳芳② 陈凤 张询乔友林 赵方辉
近十余年来,我国宫颈癌的发病率和死亡率呈升高趋势,2015年我国宫颈癌新发9.9万例,死亡3.1万例[1]。自2009年,我国政府在农村地区启动了宫颈癌和乳腺癌的两癌筛查项目,随着筛查规模的逐步扩大和高危型人乳头瘤病毒(high risk human papil⁃lomavirus,hrHPV)DNA检测的推广应用,越来越多的hrHPV阳性和宫颈上皮内瘤样病变1级(cervical in⁃traepithelial neoplasia grade 1,CIN1)妇女被检出,CIN1主要由hrHPV一过性感染引起,逆转率高,尤其是多发于年轻妇女中。国际上推荐针对CIN1和hrHPV阳性妇女均采取定期随访、无需手术的管理方式[2]。
目前尚无明确预测CIN1进展的生物学标志物,也无有效治疗hrHPV感染的方法,因此识别hrHPV阳性和CIN1妇女中真正具有进展风险的高危人群并进行风险分层管理是目前亟需解决的难题。本研究基于以人群为基础的宫颈癌筛查队列,从hrHPV DNA和E6蛋白两个层面,探讨影响妇女hrHPV阳性和CIN1进展的分子标志物,为我国宫颈癌筛查的管理提供科学依据。
1 材料与方法
1.1 研究对象
2010年10月至2012年8月中国医学科学院肿瘤医院与美国卫生适宜技术研究所合作,在宫颈癌高发区山西省阳城县、河南省新密市以及江西省铜鼓县招募7 543名妇女。入组条件为25~65岁,无宫颈癌及癌前病变史,具有完整的宫颈,目前处于非妊娠期,能够理解并自愿签署知情同意书。满足以下条件者纳入本研究:1)基线hrHPV阳性但病理结果正常者;2)病理诊断CIN1者;3)参与1年后随访且筛查结果完整者。
1.2 方法
每名妇女均自愿签署知情同意书,由经过培训的当地调查员进行宫颈癌危险因素问卷调查,再进行妇科检查和标本收集。
1.2.1 筛查方法 宫颈癌筛查基线采用HC2和careHPV对妇女自我取样、医生取样的hrHPV DNA检测、E6蛋白(Onco E6)检测以及醋酸染色后肉眼观察6种方法。所有careHPV阳性的标本进行careHPV16/18/45分型检测。1年后采用同样的方法对基线任一结果阳性妇女进行随访[3]。
hrHPV DNA检测以医生取样的careHPV检测结果为准,careHPV以及进一步分型的careHPV16/18/45均基于杂交捕获的原理,通过荧光信号放大的手段,提供检测标本中相应hrHPV的病毒载量,当标本的相对光单位值大于或等于阈值时(即RLU/PC≥1.0)为阳性。careHPV可在2.5 h内一次性检测14种hrH⁃PV(16/18/31/33/35/39/45/51/52/56/58/59/66/68),而careHPV16/18/45检测出3种hrHPV(16/18/45)。根据相对光单位值对HPV载量进行分组[4],在RLU/PC≥1.0的基础上,RLU/PC<10.0为低载量组,RLU/PC≥10.0为中高载量组。Onco E6是一种基于免疫色谱法的hrHPV E6蛋白检测技术,通过试纸条可半定量检出hrHPV16/18/45型的E6蛋白,并提供具体的分型信息。
1.2.2 阴道镜和组织病理学检查 初筛结果任一阳性者转诊行阴道镜检查,阴道镜下异常时直接活检,若阴道镜下无异常表现,将进行四象限2、4、8、10点活检并进行颈管搔刮术,所有活检标本均由中国医学科学院肿瘤医院的2名病理医生独自阅片,结果不一致时,经讨论给出一致的诊断结果。所有诊断为宫颈上皮内瘤样病变2级及以上(cervical intraepithe⁃lial neoplasia grade 2 or worse,CIN2+)的标本,由美国的1名病理医生再次阅片质控。
1.2.3 转归 1年后的病理结果较基线发生进展为主要研究终点,包括由正常进展至CINs或由CIN1进展至CIN2+,设为进展组。病理结果维持不变/减轻者,纳入维持/逆转组。
1.3 统计学分析
应用SPSS 18.0软件进行统计学分析。计数资料分析采用χ2检验,单因素分析及多因素Logistic回归模型分析影响病理进展的相关因素。P<0.05为差异具有统计学意义。
2 结果
2.1 纳入分析与未纳入分析妇女在基线时的社会人口学特征
基线hrHPV阳性或CIN1者共958例,其中164例因失访或无明确的病理结果未纳入分析,最终纳入分析794例。年龄以及其他社会人口学特征在纳入分析和未纳入分析妇女中的分布差异无统计学意义(P>0.05,表1)。
2.2 不同转归组基线筛查结果的比较
在纳入分析的794例妇女中1年后病理进展者为88例,进展至CIN2+者为23例。进展组基线hrH⁃PV载量75%分布在中高载量组,而维持/逆转组基线hrHPV载量48%左右分布在低、中高载量组,两组间分布差异具有统计学意义(P<0.05)。进展组中hrH⁃PV16/18/45分型以及E6蛋白(Onco E6)的阳性率均高于维持/逆转组(表2)。
2.3 基线筛查结果对病理进展的预测作用
单因素分析结果显示,hrHPV中高载量组进展的风险约是低载量组3倍。hrHPV16/18/45、E6蛋白(Onco E6)阳性者1年后进展的风险分别为阴性者的2.4、2.9倍(表3)。多因素Logistic回归模型分析显示,E6蛋白(Onco E6)与进展的关联无显著性差异,hrHPV中高载量者、hrHPV16/18/45阳性者进展的风险分别是hrHPV低载量、hrHPV16/18/45阴性者的2.6倍(95%CI为1.6~4.4)、1.9倍(95%CI为1.2~3.1)。

表1 794例纳入分析和164例未纳入分析的妇女基线人口学特征比较
进一步分析妇女不同筛查结果进展至CIN2+的风险,基线中高载量和hrHPV16/18/45阳性者,1年后进展为CIN2+的绝对风险分别为4.9%(95%CI为3.2~7.4)和9.0%(95%CI为9.5~14.3)。对于E6蛋白(Onco E6)阳性妇女的风险高达18.8%(95%CI为10.2~31.9),见图1。
2.4 hrHPV16/18/45载量联合E6蛋白对病理进展的预测作用
妇女careHPV16/18/45阴性者的E6蛋白亦阴性,1年后病理级别的进展绝对风险为8.9%(56/626),而hrHPV16/18/45中高载量且E6蛋白(Onco E6)阳性者的进展绝对风险高达32.4%(11/34),且进展者中72.3%(8/11)进展至CIN2+。以hrHPV16/18/45阴性组妇女为对照,hrHPV16/18/45低载量且E6蛋白(On⁃co E6)阴性、hrHPV16/18/45低载量但E6蛋白(Onco E6)阳性、hrHPV16/18/45中高载量但E6蛋白(Onco E6)阴性、hrHPV16/18/45中高载量且E6蛋白(Onco E6)阳性的进展相对风险分别为2.1、1.7、1.7、4.9倍,而hrHPV16/18/45低载量且E6蛋白(Onco E6)阳性、hrHPV16/18/45中高载量且E6蛋白(Onco E6)阴性组妇女较少,相对风险比较差异无统计学意义(表4)。

表2 不同转归组基线筛查结果分布

表3 基线筛查结果对病理进展预测作用的单因素分析
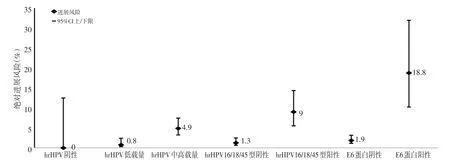
图1 妇女不同筛查结果进展至CIN2+的绝对风险

表4 hrHPV16/18/45载量联合E6蛋白对病理进展的预测作用
3 讨论
hrHPV DNA检测灵敏度较高,在国际上已广泛作为筛查宫颈癌的方法,但其特异度和阳性预测值较低。宫颈癌的自然史表明,CIN1人群中仅约10%进展至CIN2+,而大部分将逆转至正常或维持CIN1。目前影响妇女hrHPV阳性和CIN1进展的因素尚不明确。国内外开展了多项研究,探索hrHPV分型、P16(INK4A)、宿主基因甲基化等对宫颈病变进展的预测作用[5-6]。本研究基于大样本的宫颈癌筛查前瞻性队列结果显示,hrHPV中高载量、hrHPV16/18/45分型以及E6蛋白对妇女hrHPV阳性和CIN1的病理进展具有良好的预测作用,特别是hrHPV16/18/45中高载量且E6蛋白阳性的妇女,近1/3者1年内发生进展。
hrHPV病毒载量与宫颈癌的关系仍存在争议。研究显示,hrHPV高载量者与hrHPV清除呈负相关,与CIN2+的发生呈正相关,随着宫颈病变的进展,hrHPV DNA载量逐渐增加[7]。但hrHPV病毒载量与宫颈癌之间的关系仍存在争议[8]。一项纳入38个研究的Meta分析显示,hrHPV阳性的CIN1妇女进展的风险为hrHPV阴性者的3.0倍(95%CI为2.4~3.8)[9]。在印度开展的一项大规模宫颈癌筛查研究发现,hrHPV阳性且病理结果为正常或CIN1妇女中,平均随访时间为2.01年,hrHPV DNA中高载量者进展的风险是低载量的1.9~2.4倍[10]。在我国开展的一项以人群为基础的宫颈癌筛查队列发现,在病理结果为正常或CIN1妇女中,1.3%hrHPV低载量者以及11%左右的中高载量者,6年后进展至CIN2+[11]。本研究也发现,中高载量对宫颈病变进展的预测作用的具体结果之间的不同主要由随访时间和检测方法不同导致。
不同型别的hrHPV致癌风险不同,hrHPV16、18和45是宫颈癌中最常见的3种高危型别,世界范围内约75%宫颈癌是由这3种型别引起。尤其是hrH⁃PV16与宫颈癌的病因学关系最为密切。我国的一项研究发现,hrHPV16阳性妇女10年发生CIN2+的累积风险高达47.5%[12]。近期我国的一项研究也发现,hrHPV16/18基因分型对于CIN1的进展具有预测作用,2年内hrHPV阳性妇女发生CIN1进展的风险是阴性者的2.7倍[13]。国内学者从分流hrHPV阳性人群临床效果的角度,发现hrHPV16/18/45分型可以显著降低阴道镜转诊率,提高阳性预测值。本研究从预测宫颈病变进展风险的角度也证明了hrHPV16/18/45分型在宫颈癌筛查中的作用。
E6蛋白作为hrHPV致癌的主要分子,通过E6-AP介导,结合并降解p53,使其丧失抑癌作用从而导致肿瘤的发生发展[14]。本研究发现,hrHPV16/18/45型E6蛋白阳性者,近1/5短期内进展至CIN2+。我国开展的一项队列研究发现,hrHPV16/18型E6蛋白阳性妇女10年发生CIN3+的累计风险高达53.0%[15]。此外,本研究发现,hrHPV16/18/45型的中高载量且E6蛋白阳性的妇女,近1/3者1年内发生进展。本研究仅检测了hrHPV16/18/45三种型别的hrHPV病毒载量联合其E6蛋白的预测作用,随着多价hrHPV E6蛋白检测技术的发展与成熟,未来将更加全面地探讨hrHPV病毒载量和E6蛋白在宫颈癌发生发展中的协同作用。
综上所述,本研究基于前瞻性的队列研究,首次从hrHPV DNA联合E6蛋白层面,探讨对宫颈癌前病变进展具有预测作用的生物学标志物,研究发现hrHPV DNA中高载量、hrHPV16/18/45分型以及E6蛋白可以作为妇女hrHPV阳性和CIN1进展的生物学标志物,但本研究主要局限性在于随访时间仅为1年,需更长随访时间的队列研究以进一步验证。此外,careHPV16/18/45和E6蛋白检测简单、快速、成本低,适宜在资源缺乏地区推广应用,对于改善资源缺乏地区宫颈癌的筛查具有重要的现实意义。
