远端上游元件结合蛋白1在幽门螺杆菌相关性胃炎中的表达及机制研究
2018-10-15沈潇然党旖旎张国新
沈潇然, 叶 峰, 党旖旎, 张国新
南京医科大学第一附属医院消化科,江苏 南京 210000
幽门螺杆菌(Helicobacter pylori,H.pylori)是一种革兰阴性微需氧菌,1994年WHO将H.pylori定义为Ⅰ类致癌因子[1],H.pylori的内毒素脂多糖(LPS)及其毒力因子(CagA、VacA等)均对胃内黏膜有损伤,有研究表明,H.pylori感染是慢性胃炎的重要病因[2],且其在胃黏膜的炎、癌转化中扮演着重要的角色。远端上游元件结合蛋白1(far upstream element-binding protein 1,FUBP1)是一种单链核酸结合蛋白[3],作为原癌基因c-Myc的转录调控因子[4],与细胞的增殖、迁移能力有密切关系。目前发现FUBP1在多种肿瘤中表达异常,并且在胃癌中表达显著升高[5-6]。H.pylori是Ⅰ类致癌因子,但目前暂无FUBP1在H.pylori相关疾病中的研究报道。本研究旨在探讨H.pylori相关性胃炎中FUBP1表达水平及其机制初步探究。
1 资料与方法
1.1一般资料收集2017年1月至2017年3月就诊于南京医科大学第一附属医院的慢性胃炎患者32例,男13例,女19例,均于内镜下活检行病理检查确诊,其中H.pylori阳性17例,H.pylori阴性15例。H.pylori感染检测采用13C呼气试验及快速尿素酶试验,两项检查均为阳性判定为H.pylori感染阳性,两项检查均为阴性则判定为阴性。本研究得到南京医科大学第一附属医院伦理委员会批准,患者本人同意及签署知情同意书。
1.2细胞株与菌株人低分化胃癌AGS细胞株、人中分化胃癌SGC7901细胞株、国际标准测序株H.pylori26695野生株由南京医科大学第一附属医院消化科实验室提供。
1.3H.pylori感染AGS细胞、SGC7901细胞将冻存的H.pylori标准株22695复苏后,接种于含质量浓度为50 g/L的脱纤维羊血的哥伦比亚琼脂培养基,于微需氧条件下培养72 h,用含质量浓度为100 g/L的胎牛血清的培养基配成菌液备用,用分光度计测其OD600值(1OD=2×108CFU/ml);AGS细胞和SGC7901细胞以0.5×106ml-1铺于直径60 mm培养皿中,按MOI(细菌和细胞数量比值)=100∶1的比例向培养皿中加入菌液,在37 ℃、体积分数为5%的CO2条件下共同培养24 h。
1.4H.pylori-LPS提取将H.pylori标准株22695菌液通过苯酚、乙醚、RNaseA、DNaseⅠ、蛋白酶K处理提取并纯化LPS,并送至厦门鲎试剂实验厂有限公司检测定量(单位换算标准:1 EU=0.4 ng)。并H.pylori菌液提取纯化LPS,用高压灭菌的PBS稀释成1 g/L备用。
1.5H.pylori-LPS刺激AGS和SGC7901细胞AGS细胞和SGC7901细胞以0.25×106ml-1铺于6孔板中,浓度为1 g/L的H.pylori-LPS以终浓度1 μg/ml、10 μg/ml刺激AGS、SGC7901细胞24 h。
1.6H.pylori、H.pylori-LPS感染小鼠模型构建将H.pylori标准株22695复苏后培养72 h,以高压灭菌的PBS配成混悬液,制成1×109CFU/ml备用,并将1×109CFU/mlH.pylori菌液提取纯化LPS,用PBS稀释成1 ml备用。选择6周龄C57BL/6雄性小鼠,禁食禁饮24 h,灌胃前6 h以质量浓度为20 g/L的NaHCO3溶液0.3 ml灌胃预处理,对照组0.3 ml PBS液,隔日1次,连续灌胃3次;H.pylori组0.3 mlH.pylori菌液,隔日1次,连续灌胃3次[7];H.pylori-LPS组0.3 mlH.pylori-LPS溶液,隔日1次,连续灌胃3次。灌胃结束分别于4周、8周后用颈椎脱臼法处死小鼠,取其胃组织灌胃成功后4周采用粪便抗原检测法证实H.pylori感染。
1.7FUBP1mRNA检测Trizol法提取组织和细胞的总RNA,逆转录成cDNA(试剂盒:RR036A,Takara,Japan)。以GAPDH作为内参,进行RT-qPCR(试剂:RR420,Takara,Japan),所得实验数据应用比较Ct值法,组织mRNA用2-ΔΔCt法求相对表达量,细胞mRNA用2-ΔΔCt法进行结果分析(见表1)。

1.8FUBP1蛋白检测
1.8.1 免疫组织化学技术:将收集到的组织进行甲醛固定、石蜡包埋切片,然后对切片进行FUBP1免疫组织化学SP法染色,随机观察5个高倍镜下视野,计数100个细胞,按以下标准进行评分[8],首先进行染色强度评分:0分为无色;1分为淡黄色;2分为棕黄色;3分为棕褐色。其次再将阳性细胞所占百分比评分:0分为阴性;1分为阳性细胞≤10%;2分为11%~50%;3分为51%~75%;4分为>75%。染色强度与阳性细胞百分比的乘积分别为0、1、2、3、4、6、8、9、12。积分<3为阴性,3~5分为弱阳性,6~8为阳性,9~12为强阳性。
1.8.2 Western blotting:组织用强效RIPA裂解液(试剂:P0013B,碧云天,中国),细胞用中效RIPA裂解液(试剂:P0013C,碧云天,中国)裂解30 min后,4 ℃离心20 min(离心半径为8 cm,离心率为1 200 r/min)收集上清液,BCA法测定蛋白浓度,进行Western blotting检测,FUBP1一抗为Anti-FUBP1兔单克隆抗体(ab181111 Abcam,England,稀释浓度1∶1 000),FUBP1二抗为辣根过氧化物酶标记山羊抗兔IgG(A0208,碧云天,中国,稀释浓度1∶1 000)。
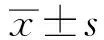
2 结果
2.1FUBP1在H.pylori阳性和H.pylori阴性胃炎组织中的表达H.pylori阳性胃炎组织中FUBP1 mRNA水平低于H.pylori阴性胃炎组织(H.pylori阳性组织:0.10±0.09,H.pylori阴性组织:0.20±0.13,P=0.25),差异无统计学意义(见图1A)。免疫组化结果显示:H.pylori阳性胃炎组织中14例FUBP1表达阴性;3例呈弱阳性;在H.pylori阴性胃炎组织中,FUBP1阴性1例,6例弱阳性,8例阳性,两组差异有统计学意义(P<0.05)(见图1B)。Western blotting结果显示:H.pylori阴性组织FUBP1蛋白表达量高于H.pylori阳性组织,灰度值分别为0.51±0.47和0.17±0.11,差异有统计学意义(P=0.04)(见图1C)。
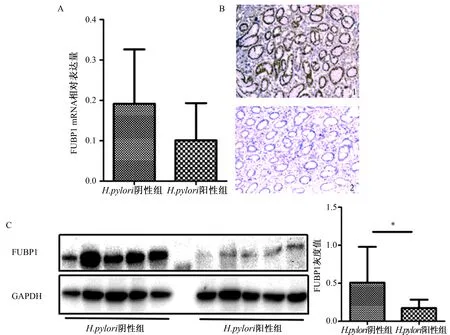
图1 胃炎组织FUBP1表达 A:FUBP1 mRNA表达水平;B:免疫组化结果(1:H.pylori阴性胃炎组织;2:H.pylori阳性胃炎组织)(40×);C:FUBP1蛋白表达水平Fig 1 The expression of FUBP1 in gastritis tissues A: the expression of FUBP1 mRNA; B: immunohistochemical results (1: H.pylori negative gastritis tissues; 2: H.pylori positive gastritis tissues) (40×); C: the expression of FUBP1 protein
2.2H.pylori刺激对AGS、7901细胞FUBP1表达的影响与对照组相比,H.pylori刺激后,FUBP1 mRNA表达水平在AGS和SGC7901细胞中均下降(P<0.05)(见图2A)。Western blotting结果表明,H.pylori刺激AGS细胞6 h后,FUBP1蛋白表达水平开始降低,呈时间依赖性;H.pylori刺激SGC7901细胞12 h后,FUBP1表达水平开始逐渐降低,呈时间依赖性(见图2B)。
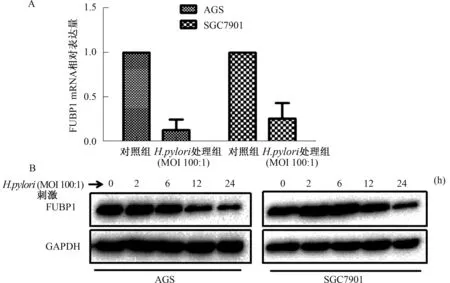
图2 H.pylori刺激AGS和SGC7901细胞FUBP1表达 A:FUBP1 mRNA表达水平;B:FUBP1蛋白表达水平Fig 2 The expression of FUBP1 in AGS and SGC7901 cells stimulated by H.pylori A: the expression of FUBP1 mRNA; B: the expression of FUBP1 protein
2.3H.pylori-LPS对AGS、SGC7901细胞FUBP1表达的影响H.pylori-LPS分别以1 μg/ml和10 μg/ml的终浓度刺激AGS和SGC7901细胞,RT-qPCR结果和Western blotting结果均显示H.pylori-LPS组FUBP1表达较对照组降低,但不同浓度间差异无统计学意义(P>0.05)(见图3A、3B)。进一步以H.pylori-LPS 1 μg/ml终浓度刺激细胞,在AGS细胞中,刺激6 h后FUBP1下降;在SGC7901细胞中,刺激24 h后开始降低,均无时间依赖性(见图3C)。
2.4H.pylori和H.pylori-LPS动物模型中FUBP1的表达情况RT-qPCR分别检测4周后对照组、H.pylori组和H.pylori-LPS组小鼠胃黏膜组织中FUBP1 mRNA相对表达量为0.21±0.13、0.04±0.02、0.09±0.07(P=0.12);8周后三组小鼠胃黏膜组织中FUBP1 mRNA相对表达量为0.30±0.11、0.12±0.01、0.02±0.01(P=0.003)(见图4A)。与对照组比较,H.pylori组和H.pylori-LPS组中FUBP1 mRNA表达水平均下降。Western blotting结果同样显示,H.pylori组和H.pylori-LPS组的FUBP1蛋白表达水平比对照组明显降低(见图4B)。
图3 H.pylori-LPS刺激AGS和SGC7901细胞FUBP1表达 A:FUBP1 mRNA表达水平;B~C:FUBP1蛋白表达水平Fig 3 The expression of FUBP1 in AGS and SGC7901 cells stimulated by H.pylori-LPS A: the expression of FUBP1 mRNA; B-C: the expression of FUBP1 protein
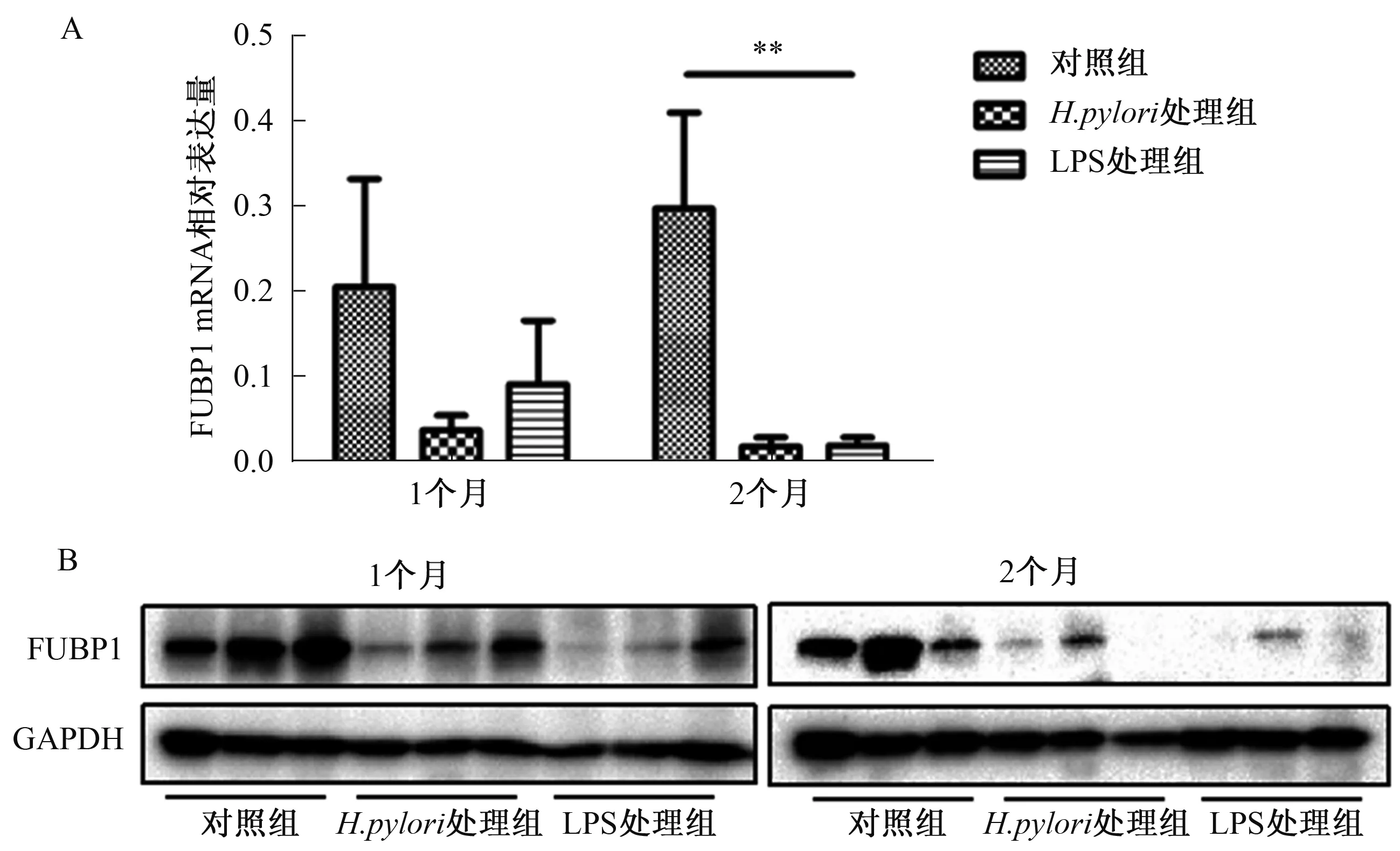
图4 H.pylori和H.pylori-LPS动物模型中FUBP1表达 A:FUBP1 mRNA表达水平;B:FUBP1蛋白表达水平Fig 4 The expression of FUBP1 in H.pylori infected animal models and H.pylori-LPS infected animal models A: the expression of FUBP1 mRNA; B: the expression of FUBP1 protein
3 讨论
H.pylori是一种定植在人体消化道内细菌,H.pylori感染的发病率非常高,并可能在世界一半人口中出现[9]。随着对H.pylori研究的深入及积极有效的治疗,H.pylori的感染率逐渐降低,但它仍是引起慢性胃炎、消化性溃疡、胃癌的高危因素[10]。且所有H.pylori感染者几乎都存在慢性活动性胃炎[11]。LPS是位于革兰氏阴性细菌细胞壁的类脂多糖类物质,有研究[12-13]表明,H.pylori-LPS具有细菌内毒素的生物学活性。H.pylori-LPS诱导产生的细胞因子和毒力因子破坏胃黏膜的完整性,引起炎症反应[14],在H.pylori感染及H.pylori相关性疾病中扮演着重要的角色。
FUBP1是远端上游元件结合蛋白家族中的一员,其定位于细胞核内,作为一种DNA结合蛋白,可调控原癌基因c-Myc的转录,抑制细胞凋亡,增强细胞增殖、迁移能力,影响一些肿瘤的发生、发展。在消化道疾病中,有研究[15]报道FUBP1表达在结直肠癌中呈高表达。但一项小鼠肠炎模型的研究[16]发现,不同于在肿瘤组织中的高表达,FUBP1在炎症性肠病小鼠模型中的表达降低,认为是由于炎症导致细胞凋亡,FUBP1从细胞核中清除导致的。FUBP1与胃癌的研究结果显示,胃癌中FUBP1的表达水平升高[5]。但在胃癌的高危人群H.pylori相关性胃炎患者中FUBP1表达情况是否也增高,还是同肠炎模型研究一样表达降低,目前并无相关研究。
本研究首先检测了H.pylori阳性和阴性胃炎组织中FUBP1 mRNA表达量,结果显示,H.pylori阳性胃炎患者中FUBP1的表达量比H.pylori阴性低。进一步通过免疫组化和Western blotting进行验证,发现FUBP1表达在H.pylori相关性胃炎中降低。在H.pylori刺激细胞的研究结果中发现,FUBP1的表达降低,且随时间延长而逐渐降低。LPS是H.pylori常见的毒力因子,可释放相关炎性因子引起细胞损伤,因此我们进一步探讨H.pylori感染引起的FUBP1表达降低是否通过LPS。用1 μg/ml和10 μg/ml两个不同浓度的H.pylori-LPS刺激细胞,发现FUBP1表达降低,但不同浓度间无明显差异,FUBP1表达与H.pylori-LPS的刺激浓度并无相关性,进一步研究发现,与刺激作用的时间同样也无明显相关性。LPS参与H.pylori引起的FUBP1表达降低。随后我们在构建的H.pylori感染小鼠模型中进行验证发现,H.pylori感染4周和8周的小鼠胃组织FUBP1表达降低。同样,H.pylori-LPS感染小鼠模型中FUBP1的表达下降。因此推测H.pylori感染后,引起炎性反应,细胞凋亡增加,细胞坏死,导致FUBP1从细胞核中逐步被清除,表达降低。在此过程中H.pylori的毒力因子LPS参与FUBP1的下调,但是否有其他毒力因子共同作用引起FUBP1变化,有待进一步研究。因本次研究无论细胞刺激还是动物模型都是一个短时早期的炎症模型,如果不断炎症诱导刺激,导致进入到一个慢性感染阶段,动物建模到慢性萎缩性胃炎,甚至胃癌阶段,则FUBP1的表达及作用机制可能出现不同的变化。
综上所述,FUBP1在H.pylori相关性胃炎中表达降低,H.pylori和H.pylori毒力因子LPS均能诱导FUBP1表达下降,FUBP1可能成为评估慢性胃炎患者H.pylori感染的一个潜在指标。但H.pylori-LPS与FUBP1的相互作用是否存在其他协同因子及FUBP1在胃黏膜的炎、癌转化中作用机制仍需进一步研究。
