血清炎症标志物与肝静脉压力梯度相关性的临床评价
2018-10-15黄晓铨蒋颖溢刘成凤陈世耀
黄晓铨,张 瑞,蒋颖溢,刘成凤,陈世耀
复旦大学附属中山医院消化科,复旦大学循证医学中心,上海 200032
肝硬化门脉高压食管胃静脉曲张破裂出血是门脉高压常见而致命的并发症,再出血率和死亡率极高,准确测定肝硬化患者门脉压力并进行及时的干预是提高患者生存的关键[1-2]。肝静脉压力梯度(hepatic venous pressure gradient, HVPG)是间接反映门脉压力的金标准,当HVPG>5 mmHg时,即可诊断门脉高压。一般认为食管胃静脉曲张破裂出血在HVPG>12 mmHg时出现,当HVPG>20 mmHg时,其出血和死亡风险增加5倍[3]。由于HVPG测定属有创操作,具有一定技术难度,大部分医院难以开展,费用高,因此,寻找门静脉压力的无创诊断方法为临床迫切需要解决的问题。
肝硬化患者门脉压力增加导致的全身内脏动脉血管扩张,高动力循环状态伴发门体侧支循环形成,由于肝硬化患者肝脏代谢能力下降,毒素积累,肠壁通透性增加,肠动力受损,肠道菌群失调与易位,可引发全身系统亚临床炎症状态,影响肝硬化患者的血流动力学稳定性[4-5]。既往研究发现,未出现食管静脉曲张的代偿期肝硬化患者外周血炎症指标可用于诊断食管胃静脉曲张,避免胃镜检查,一些血清炎症指标也可用于预测肝硬化患者长期并发症的发生及预后[6-8]。但尚未有肝硬化食管胃静脉曲张患者外周血炎症指标诊断门脉压力的研究。因此,本研究拟探究外周血炎症指标与HVPG的相关性,及作为无创血清标志物诊断门静脉高压的效能。
1 资料与方法
1.1一般资料收集2016年1月1日至2017年8月31日因肝硬化门脉高压食管胃静脉曲张入住复旦大学附属中山医院并进行HVPG测定的患者。纳入标准:(1)年龄为18~80岁;(2)有门脉血管CTA检查;(3)进行血清炎症指标IL-1β、sIL-2R、IL-6、IL-8、IL-10和TNF-α检测。排除标准:(1)非肝硬化患者;(2)急性出血期(<5 d)治疗的患者;(3)合并恶性肿瘤患者;(4)已有感染的患者;(5)过去2周使用过抗生素或免疫抑制剂;(6)门静脉压力梯度测定提示重度肝内分流的患者。
1.2HVPG测定排除HVPG测定相关禁忌证后,术前禁食至少6 h。患者取仰卧位,在局麻下行右侧颈内静脉穿刺,置入导丝至下腔静脉,引入球囊导管(Synergy, Boston Scientific,USA)至肝中或肝右静脉,扩张球囊,连接压力传感器,校零后测肝静脉游离压(free hepatic venous pressure,FHVP),再次校零后扩张球囊闭塞肝静脉后测肝静脉楔入压(wedged hepatic venous pressure,WHVP),注入造影剂确认闭塞是否良好,如有异常交通支存在,调整导管位置后重新测定。FHVP及WHVP均重复3次测定后取平均值,HVPG=WHVP-FHVP。测压结束后拔管局部压迫并观察15~20 min。
1.3外周血炎症标志物测定血清内毒素浓度通过去热源抗凝管采血,使用革兰氏阴性细菌磷酸脂多糖检测试剂盒(光度法)检测(Photometric Assay,湛江安度斯),血清IL-1β、sIL-2R、IL-6、IL-8、IL-10和TNF-α浓度检测采用化学发光法通过西门子医学解决方案检测系统(Immulite 1000全自动化学发光免疫分析仪,Siemens)检测。
1.4统计学方法采用SPSS 24.0(SPSS Inc., Chicago, Illinois, USA)和Graphpad PRISM 7.0(GraphPad Software, San Diego, CA, USA)进行统计分析和绘图。两组计量资料比较以均数±标准误表示,采用t检验,并使用Levene’s对方差齐性进行检验矫正。相关性分析使用Spearman检验。以95%CI,所有均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1患者信息共纳入134例患者,基本信息如表1所示,年龄以中年患者为主,大部分为男性(59.0%),肝硬化病因超过一半为乙肝后肝硬化(54.5%),其中Child A级94例,Child B级39例,Child C级1例,MELD评分为(9.0±0.2)分。所有患者均通过胃镜证明存在食管和/或胃静脉曲张,肝静脉压力梯度HVPG测定平均值为(16.0±0.5)mmHg(中位数值=15 mmHg;范围6~35 mmHg)。有30例(22.4%)患者HVPG<12 mmHg(食管胃静脉曲张破裂出血风险较低)和43例(32.1%)患者HVPG≥20 mmHg。

2.2HVPG与临床特性及炎症指标相关性HVPG与Child评分呈正相关(r=0.194,P=0.024),与年龄、MELD评分等相关指标均无相关性(P>0.05)。外周血细胞因子IL-1β、IL-6、IL-8、IL-10及内毒素与HVPG无显著相关性,而sIL-2R及TNF-α与HVPG呈正相关(r=0.416,P<0.0001;r=0.185,P=0.032)。将Child评分、sIL-2R和TNF-α这3个因素纳入Logistic回归,以HVPG<12 mmHg或HVPG≥12 mmHg分组(临床认为食管胃静脉曲张破裂出血风险高)后,发现Child评分(OR=0.882,95%CI:0.571~1.363,P=0.572)、TNF-α(OR=1.008,95%CI:1.004~1.012,P=0.259),仅sIL-2R与HVPG独立相关(OR=1.008,95%CI:1.004~1.012,P=0.000)(见表2)。外周血sIL-2R与HVPG相关性的散点图见图1。
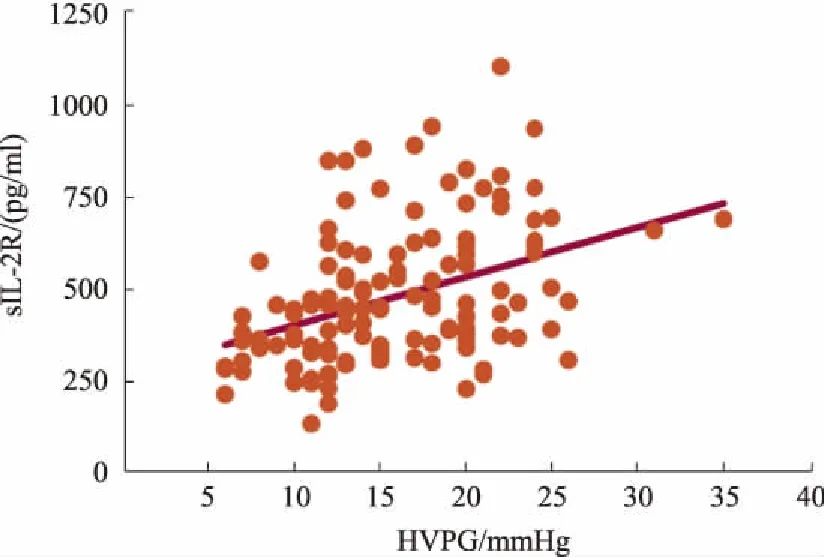
图1 sIL-2R与HVPG相关性的散点图Fig 1 Scatter diagram of correlation between sIL-2R and HVPG
2.3外周血sIL-2R诊断HVPG的效能分析为了进一步探究sIL-2R与HVPG≥12 mmHg的预测效能,使用ROC曲线评估(见图2),在诊断HVPG≥12 mmHg时,sIL-2R的AUC值为(0.772±0.044)(P<0.001,95%CI:0.686~0.857),最佳临界值为475 pg/ml,其敏感度为51.9%,特异度为93.1%,阳性预测值为96.4%,阴性预测值为35.1%。
3 讨论
食管胃静脉曲张破裂出血是失代偿期肝硬化患者最常见而凶险的并发症,早期识别肝硬化患者门脉压力升高并及时内镜治疗预防静脉曲张再出血是提高患者生存的关键。肝硬化门脉高压病程进展伴随着亚临床系统炎症状态与血小板活化,肝内血管阻力增加和体循环血流动力学的改变共同引起门脉高压的升高,导致侧支循环开放,食管胃静脉曲张形成[9]。肝脏的持续损伤和纤维化形成与门脉高压相关[10],更有研究提示,在急性肝炎、急性肝衰竭时,无肝纤维化的情况下,肝脏损伤及炎症反应也可以引起门脉高压[11]。门脉压力升高伴随肠道黏膜通透性改变,肠道菌群及其代谢物通过门脉系统进入体循环,进一步激活炎症通路。因此,通过炎症血清标志物寻找一种准确、方便、经济、快捷的无创标志物诊断门脉高压在临床诊疗中具有重要的意义,可以使患者获益并提高临床效率。
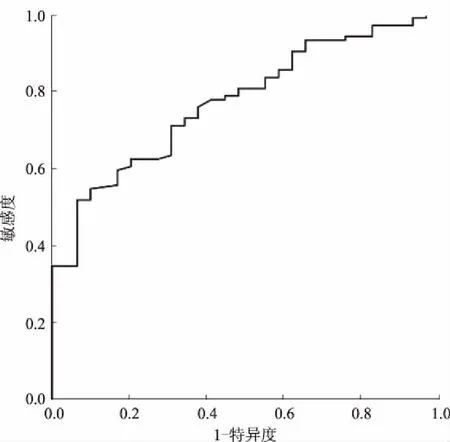
图2 HVPG≥12 mmHg时sIL-2R浓度水平的ROC曲线Fig 2 ROC curve of sIL-2R concentration when HVPG ≥12 mmHg
既往研究发现,在不合并食管胃静脉曲张的代偿期肝硬化患者中,血清IL-1β、IL-1Rα、Fas-R和血清血管黏附因子-1(VCAM-1)与HVPG相关,多因素分析发现联合TGF-β、热休克蛋白-70、饮酒和Child B级对诊断HVPG≥12 mmHg有较好的特异度和敏感度,避免不必要的胃镜检查筛查静脉曲张,但对于明确存在食管胃静脉曲张患者的门脉压力诊断效能未知[6]。多种血清学指标被研究可用于预测肝硬化失代偿期患者的预后,外周血可溶性CD163可用于预测长期生存和肝硬化相关并发症的发生情况[7],vWf因子可提示肠道菌群易位,炎症和凝血功能紊乱并预测门脉高压的严重程度及其相关并发症的发生[5]。
在本研究中,我们发现外周血可溶性IL-2R与肝硬化门脉高压的金标准HVPG显著相关,可能可以作为门脉高压诊断的无创血清标志物。IL-2受体在炎症反应中,可与IL-2结合促进炎症,可激活包括T淋巴细胞、B淋巴细胞、单核细胞和NK细胞等多种细胞,外周血可溶性IL-2R的升高与多种疾病进展及临床预后有关[12-13]。肝硬化患者存在免疫功能异常,体内激活淋巴细胞增加,肝细胞对sIL-2R清除能力下降。IL-2R特异性结合IL-2后,其构型发生变化,可启动JAK/STAT5通路、丝裂原激活的蛋白激酶(MAPK)通路及PI3K/Akt/mTOR通路进行信号传导并发挥生物学效应,与免疫稳态及机体清除微生物的能力相关[14-16]。
本研究纳入患者以乙肝后肝硬化为主,均进行胃镜检查证明存在食管胃静脉曲张,HVPG平均值为(16.0±0.5)mmHg,均属于较高压力水平。本研究排除了合并恶性肿瘤,存在重度肝内分流或存在感染、自身免疫性疾病影响HVPG测定或影响血清炎症指标的因素。我们的研究发现,外周血细胞因子IL-1β、IL-6、IL-8、IL-10、内毒素与HVPG无相关性,sIL-2R及TNF-α与HVPG显著相关。为排除肝功能等疾病进展对sIL-2R的影响,进一步对HVPG与Child评分、MELD评分的相关性分析发现,HVPG与Child评分相关,与MELD评分无关。多因素分析发现,外周血sIL-2R水平与HVPG呈独立正相关,而Child评分及TNF-α浓度与门脉高压无关。当HVPG≥12 mmHg时,肝硬化食管胃静脉曲张破裂出血的风险显著增加[17],我们使用了ROC曲线评估sIL-2R对HVPG≥12 mmHg的预测效能。在诊断HVPG≥12 mmHg时,sIL-2R的ROC曲线下面积为0.772,临界值为475 pg/ml,其特异度达93.1%,阳性预测值为96.4%,故当sIL-2R>475 pg/ml,可基本诊断HVPG≥12 mmHg,但由于其敏感度较低,当sIL-2R<475 pg/ml,并不能排除门脉高压。即当外周血sIL-2R≥475 pg/ml时,肝硬化患者门脉高压较高,有较大的食管胃静脉曲张破裂出血风险。
本研究存在一些局限性。本研究仅纳入肝硬化合并食管胃静脉曲张的患者,对无静脉曲张的失代偿期肝硬化患者的预测价值未知;本研究纳入患者肝硬化病因多样,可能不同病因会对sIL-2R产生不同影响;本研究纳入患者基本为Child A级和B级,Child C级的患者对sIL-2R的影响是否会影响与HVPG的相关性,由于样本量较小,研究结论仅能作为初步探索性结论,需要多中心、大样本的临床病例验证。
综上,本研究发现,肝硬化伴食管胃静脉曲张患者,外周血sIL-2R水平与HVPG呈正相关,可能作为门脉高压无创诊断的血清标志物,间接预测门脉压力。
