TGFBR1基因调控Wnt/β-catenin信号通路对结缔组织病相关的肺间质病变中抗纤维化的机制研究
2018-10-12岳彩芳付冰冰
岳彩芳 付冰冰 骆 鹏
(佳木斯大学附属第一医院,佳木斯154002)
结缔组织引起的间质性肺疾病称为结缔组织病相关性疾病(Connective tissue disease interstitial lung disease,CTD-ILD),主要的病理过程为炎性细胞的弥漫性浸润,肌成纤维细胞和成纤维细胞及一些细胞外的基质聚集在肺间质,并发生大量沉积,导致肺泡及毛细血管损伤,间质组织损伤和修复反复交替,最终引起肺结构发生重塑而导致肺的纤维化[1,2]。近些年来,虽然对该病的认识有一定的提高,但间质性肺病仍是难治的一类疾病,且无有效的治疗方法[3]。结缔组织生长因子(Connective tissue growth factor,CTGF)、转化生长因子β1(Transforming growth factor-β1,TGF-β1)等多种促进纤维化的因子在纤维变性过程中发挥作用,可增加成纤维细胞的增殖和分化,诱导其胞外机制合成增多,TGF-β1也被认为是在细胞和组织纤维化过程促纤维化最关键的细胞因子[4,5]。在人体的各个系统有TGF-βs超家族的分布,TGF-β受体Ⅰ(TGF-β receptor Ⅰ,TGFBR1)是TGF-β1/SMADs信号通路的一个重要环节,有研究发现,TGFBR1的敲除可阻断TGF-β1/SMADs信号通路,同样有抗纤维化的作用[6]。研究TGFBR1在肺纤维化中的作用及调控机制,将为CTD-ILD的治疗开辟一条新思路。因此,本研究首先检测TGFBR1在CTD-ILD肺组织的表达,用TGF-β1刺激MRC-5细胞,检测抑制TGFBR1表达对细胞活力、Ⅰ型胶原、CTGF、α-平滑肌肌动蛋白(α smooth muscle actin,α-SMA)、E-钙黏蛋白(E-cadherin,E-Cad)表达的影响,并研究可能的分子机制。
1 材料与方法
1.1材料
1.1.1试剂和仪器 胎牛血清购自美国Gibco;DMEM培养基、LipofectamineTM2000转染试剂盒均购自美国Invitrogen公司;二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒、CCK8试剂盒均购自碧云天生物技术研究所;TGFBR1、Ⅰ型胶原、CTGF、E-Cad、α-SMA、β-连环蛋白(β-catenin)、c-Myc、GAPDH抗体均购自美国ABCam公司;酶标仪购自美国Bio-Tek公司。
1.1.2CTD-ILD患者一般资料 收集2014年5月至2016年7月在佳木斯大学附属第一医院风湿免疫科就诊的CTD-ILD行CT引导下细针穿刺肺活检术或纤维支气管活检术患者,共40例,其中男性10例,女性30例,平均年龄(46.83±2.02)岁,所有患者符合CTD-ILD的纳入标准,排除因遗传、药物、肿瘤、吸烟等因素引起的肺动脉高压、肺间质病变、慢性阻塞性肺疾病等肺部疾病。另选取不吸烟且无感染的肺癌患者的正常癌旁组织作为正常对照组,共25例,其中男性8例,女性17例。对照组与实验组的性别及年龄差异无统计学意义。所有样本的采集均得到患者的知情同意,本研究获当地伦理委员会的批准。
1.2方法
1.2.1细胞及其培养 人胚肺成纤维细胞系MRC-5购自上海;细胞置于37℃、5%CO2培养箱中用DMEM高糖培养基(含10%胎牛血清及100 U/ml的青霉素和100 U/ml的链霉素)中培养,细胞生长为贴壁,2 d传代一次。
1.2.2实验分组 细胞分为空白对照组、TGF-β1组(2 μg/L的TGF-β1刺激细胞)、阴性对照组(NC组,2 μg/L的TGF-β1刺激细胞48 h+转染无干扰作用的siRNA)、TGFBR1-siRNA组(2 μg/L的TGF-β1刺激细胞48 h+转染干扰TGFBR1表达的siRNA)。转染前将MRC-5细胞用含血清DMEM培养基常规培养,细胞生长达80%以上融合时,不含胎牛血清培养基静止细胞24 h,使同步化。转染参照LipofectamineTM2000说明书,转染后置于培养箱内正常培养48 h,用于后续实验研究。
1.2.3Western blot 提取4组细胞中的蛋白,BCA法测定蛋白浓度,40 μg/孔蛋白样品行10%的SDS-PAGE分离,PVDF转膜、5%的脱脂奶粉封闭后,4℃孵育皆按照1∶1 000稀释TGFBR1、Ⅰ型胶原、CTGF、α-SMA、E-cad、β-catenin、c-Myc、GAPDH一抗过夜,洗膜,二抗孵育,室温孵育1 h,洗膜。化学发光法显色。实验重复3次。
1.2.4细胞增殖实验 通过CCK8法检测细胞活力。于每孔细胞中加入CCK8试剂10 μl,37℃条件下孵育4 h。空白对照孔调零,酶标仪检测在490 nm 波长下的光密度值(OD),以光密度值反映细胞的活力,间接反映出各组细胞增殖能力。实验重复3次。
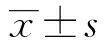
2 结果
2.1TGFBR1在CTD-ILD肺组织表达 TGFBR1在CTD-ILD肺组织及正常肺组织中均有表达,表达量分别为0.453±0.052、0.137±0.016,在CTD-ILD肺组织中的表达显著高于正常肺组织(t=36.734,P=0.000)。见图1。
2.2各组细胞中TGFBR1的蛋白表达 Western blot检测TGF-β1刺激及TGFBR1的siRNA转染后的MRC-5细胞中TGFBR1的蛋白表达,结果如图2和表1所示,TGF-β1组TGFBR1的蛋白表达显著高于空白对照组(t=9.076,P=0.000),TGF-β1组和NC组间TGFBR1表达差异无统计学意义(t=1.147,P=0.285),而TGFBR1-siRNA组TGFBR1的表达显著低于TGF-β1组(t=6.512,P=0.000)。
2.3TGFBR1基因对MRC-5细胞活力的影响 通过CCK8法检测各组细胞的活力,结果如表2所示,TGF-β1组OD值显著高于空白对照组(t=8.638,P=0.000),TGF-β1组和NC组间OD值差异无统计学意义(t=0.399,P=0.700),而TGFBR1-siRNA组OD值显著低于TGF-β1组(t=5.604,P=0.001)。
2.4TGFBR1基因对MRC-5细胞Ⅰ型胶原、CTGF、α-SMA、E-cad表达的影响 与空白对照组比较,TGF-β1组Ⅰ型胶原、CTGF、α-SMA蛋白表达均显著升高,E-cad蛋白表达显著降低(t1=7.522,P1=0.000;t2=10.210,P2=0.000;t3=12.809,P3=0.000;t4=9.709,P4=0.000),TGF-β1组和NC组间Ⅰ型胶原、CTGF、α-SMA和E-cad的表达差异均无统计学意义(t1=1.120,P1=0.295;t2=0.394,P2=0.704;t3=0.646,P3=0.536;t4=0.663,P4=0.526),而TGFBR1-siRNA组Ⅰ型胶原、CTGF、α-SMA表达均显著低于TGF-β1组(t1=2.484,P1=0.038;t2=3.944,P2=0.004;t3=8.116,P3=0.000),E-cad表达表达显著高于TGF-β1组(t=4.689,P=0.002)。见图3、表3。
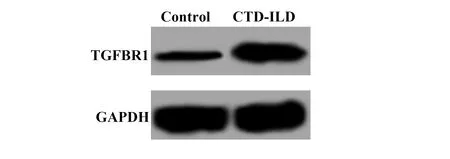
图1 TGFBR1在CTD-ILD肺组织表达(n=40)Fig.1 TGFBR1 expression in CTD-ILD lung tissue (n=40)

图2 各组细胞中TGFBR1蛋白的表达Fig.2 Protein expression of TGFBR1 in cells of each group
表1各组细胞中TGFBR1的蛋白相对表达量(n=3)
Tab.1RelativeexpressionofTGFBR1proteinincellsofeachgroup(n=3)
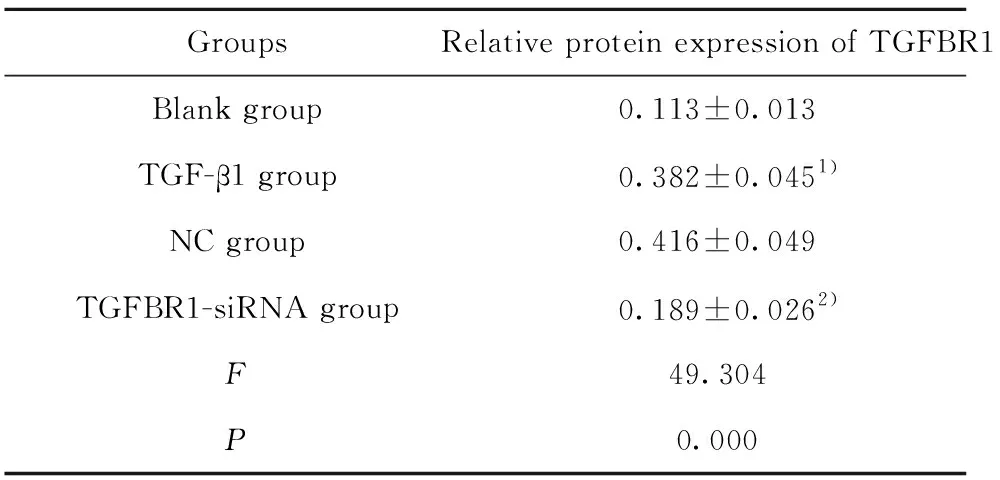
GroupsRelative protein expression of TGFBR1Blank group0.113±0.013TGF-β1 group0.382±0.0451)NC group0.416±0.049TGFBR1-siRNA group0.189±0.0262)F49.304P0.000
Note:Compared with the blank group,1)P<0.05;compared with the TGF-β1 group,2)P<0.05.
2.5TGFBR1基因对MRC-5细胞Wnt/β-catenin信号通路的影响 Western blot检测TGFBR1基因对MRC-5细胞Wnt/β-catenin信号通路β-catenin、c-Myc的蛋白表达的影响,结果如图4和表4所示,TGF-β1组β-catenin、c-Myc的蛋白表达均显著高于空白对照组(t1=14.245,P1=0.000;t2=7.528,P2=0.000),TGF-β1组和NC组β-catenin、c-Myc的蛋白表达差异均无统计学意义(t1=0.463,P1=0.656;t2=1.783,P2=0.112),而TGFBR1-siRNA组β-catenin、c-Myc的蛋白表达均显著低于TGF-β1组(t1=10.809,P1=0.000;t2=4.557,P2=0.002)。
表2TGFBR1基因对MRC-5细胞活力的影响(n=3)
Tab.2EffectofTGFBR1geneonMRC-5cellviability(n=3)
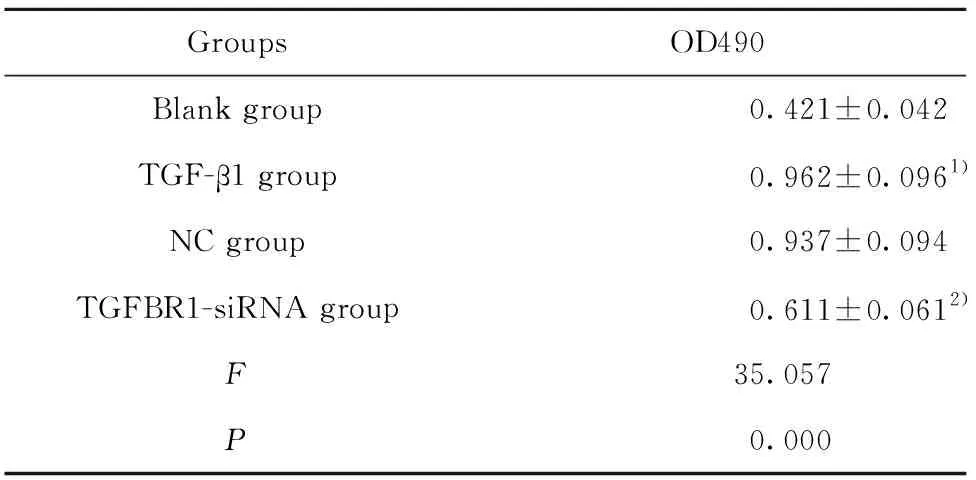
GroupsOD490Blank group0.421±0.042TGF-β1 group0.962±0.0961)NC group0.937±0.094TGFBR1-siRNA group0.611±0.0612)F35.057P0.000
Note:Compared with the blank group, 1)P<0.05;compared with the TGF-β1 group,2)P<0.05.

图3 TGFBR1基因对MRC-5细胞Ⅰ型胶原、CTGF、α-SMA、E-cad表达的影响Fig.3 Effect of TGFBR1 gene on expression of type Ⅰ collagen,CTGF,α-SMA and E-cad in MRC-5 cells
表3TGFBR1基因对MRC-5细胞Ⅰ型胶原、CTGF、α-SMA、E-cad表达的影响(n=3)
Tab.3EffectofTGFBR1geneonexpressionoftypeIcollagen,CTGF,α-SMAandE-cadinMRC-5cells(n=3)

GroupsRelative protein expressionCollagenⅠCTGFα-SMAE-cadBlank group0.111±0.0120.082±0.0090.118±0.0130.311±0.041TGF-β1 group0.326±0.0411)0.315±0.0381)0.653±0.0721)0.106±0.0121)NC group0.358±0.0490.306±0.0320.626±0.0670.120±0.015TGFBR1-siRNA group0.255±0.0262)0.225±0.0242)0.314±0.0252)0.205±0.0252)F29.50744.69076.02039.987P0.0000.0000.0000.000
Note:Compared with the blank group, 1)P<0.05;compared with the TGF-β1 group,2)P<0.05.

图4 TGFBR1基因对MRC-5细胞β-catenin、c-Myc表达的影响Fig.4 Effect of TGFBR1 gene on expression of β-catenin and c-Myc in MRC-5 cells
表4TGFBR1基因对MRC-5细胞β-catenin、c-Myc表达的影响(n=3)
Tab.4EffectofTGFBR1geneonexpressionofβ-cateninandc-MycinMRC-5cells(n=3)
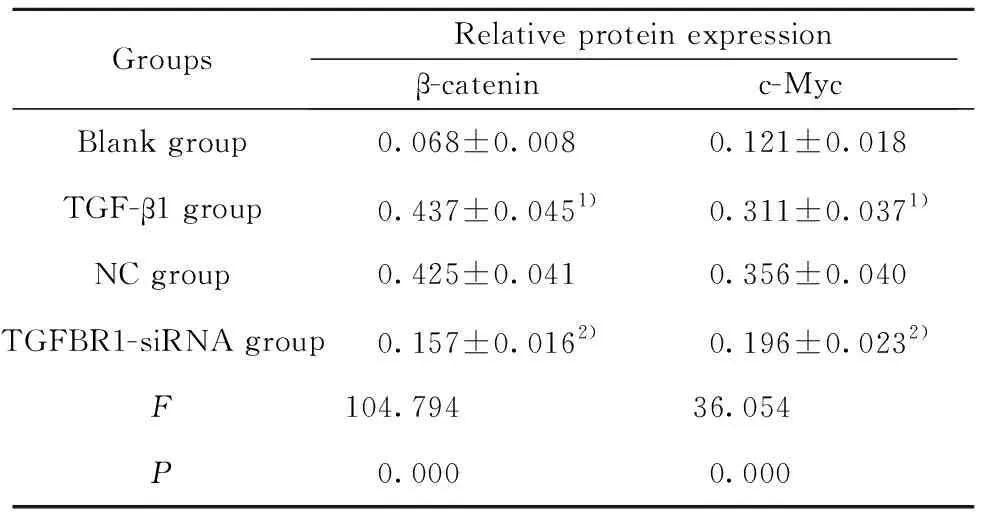
GroupsRelative protein expressionβ-cateninc-MycBlank group0.068±0.0080.121±0.018TGF-β1 group0.437±0.0451)0.311±0.0371)NC group0.425±0.0410.356±0.040TGFBR1-siRNA group0.157±0.0162)0.196±0.0232)F104.79436.054P0.0000.000
Note:compared with the blank group,1)P<0.05;compared with the TGF-β1 group,2)P<0.05.
3 讨论
CTD-ILD有较高的临床发病率和死亡率,缺乏有效的治疗方法,因此,间质性肺疾病受到人们的重视。肺成纤维细胞的增殖、活化、合成、分化及分泌细胞外基质是发生肺纤维化的中心事件,成纤维细胞增殖或凋亡不足是导致肺发生纤维化的重要环节,抑制肺成纤维细胞的增殖及诱导凋亡对于抗纤维化具有重要意义[7,8]。TGF-β1是一个重要的细胞因子,是目前发现的导致纤维化最重要的因子之一,有研究发现,TGF-β1能增强细胞外基质沉积,且还能抑制胶原的降解,在肺间质性纤维化患者和动物的纤维化模型中TGF-β1的表达量升高,TGF-β1的过表达可导致鼠的肺发生纤维化[9-11]。在CTD-ILD患者的肺组织也可检测到TGF-β1的表达升高[12]。这说明TGF-β1在肺的纤维化中发挥重要作用。研究发现,TGF-β1能与TGFBR1结合,抑制多种细胞的增殖、分化及促进细胞间质形成[13,14];肺纤维化过程中miR-181b的过表达可通过抑制靶蛋白TGFBR1表达,使TGF-β1信号阻断,从而降低肺的纤维化程度[15]。TGFBR1对肺的纤维化影响及机制研究并不多。
RNA干扰(RNAi)又称为基因沉默,是一种新的阻断基因表达技术,具有高效性和特异性,目前在研究基因功能等方面得到广泛的应用[16-18]。本研究首先检测到TGFBR1在CTD-ILD患者的肺组织表达量升高,用TGF-β1刺激MRC-5细胞,并将TGFBR1的siRNA转染细胞,以检测TGFBR1在CTD-ILD的纤维化中的作用。研究发现,TGF-β1可促进肺成纤维细胞的增殖[19],本研究也检测到TGF-β1可增加细胞活力,与前人研究一致,而转染TGFBR1的siRNA可降低细胞活力。Ⅰ型胶原是一种外分泌的胶原蛋白,由成纤维细胞合成并分泌到细胞外,参与构成细胞外成分,在肺纤维化中有重要作用[20,21]。有研究发现,在人胚肺成纤维细胞中可通过抑制Ⅰ型胶原表达降低矽肺的发生[22]。CTGF为TGF-β1下游的一个效应分子,在肺的纤维化发生及发展过程中发挥重要作用,抑制CTGF表达可降低MRC-5细胞增殖、细胞外基质合成及表型转化,可能是抗肺纤维化的一个靶点[23-25]。肺泡上皮-间充质转化(EMT)是肺损伤的一个环节,在EMT过程中,E-Cad表达下调,α-SMA、波形蛋白等间质表型标志物表达上调[26],因此,本研究选择E-Cad和α-SMA评定TGFBR1诱导的EMT过程。研究结果显示,转染TGFBR1的siRNA可下调TGF-β1引起的Ⅰ型胶原、CTGF、α-SMA表达升高,上调E-Cad表达。多种信号通路参与肺的纤维化发生,如TGF-β1/Smad3、细胞外调节蛋白激酶(ERK1/2)、Wnt等信号通路[27,28],Wnt/β-catenin信号通路是一条经典的Wnt信号通路,由Wnt蛋白、核内转录因子、跨膜受体胞质蛋白和下游的靶基因组成,与多种疾病的发生有关。研究显示,抑制Wnt/β-catenin信号通路可降低肺纤维化的发生发展[29,30]。本研究结果显示,转染TGFBR1的siRNA可降低Wnt/β-catenin信号通路β-catenin、c-Myc表达。
综上所述,GFBR1基因在CTD-ILD肺组织中表达升高,抑制TGFBR1的表达可通过下调Wnt/β-catenin信号通路降低肺成纤维细胞活力,下调Ⅰ型胶原、CTGF、α-SMA表达和上调E-Cad表达而达到肺的抗纤维化作用。本研究提示GFBR1可能是反映纤维化的一个指标,可能成为CTD-ILD治疗的分子靶点。但还需更多的理论及临床研究作支撑。